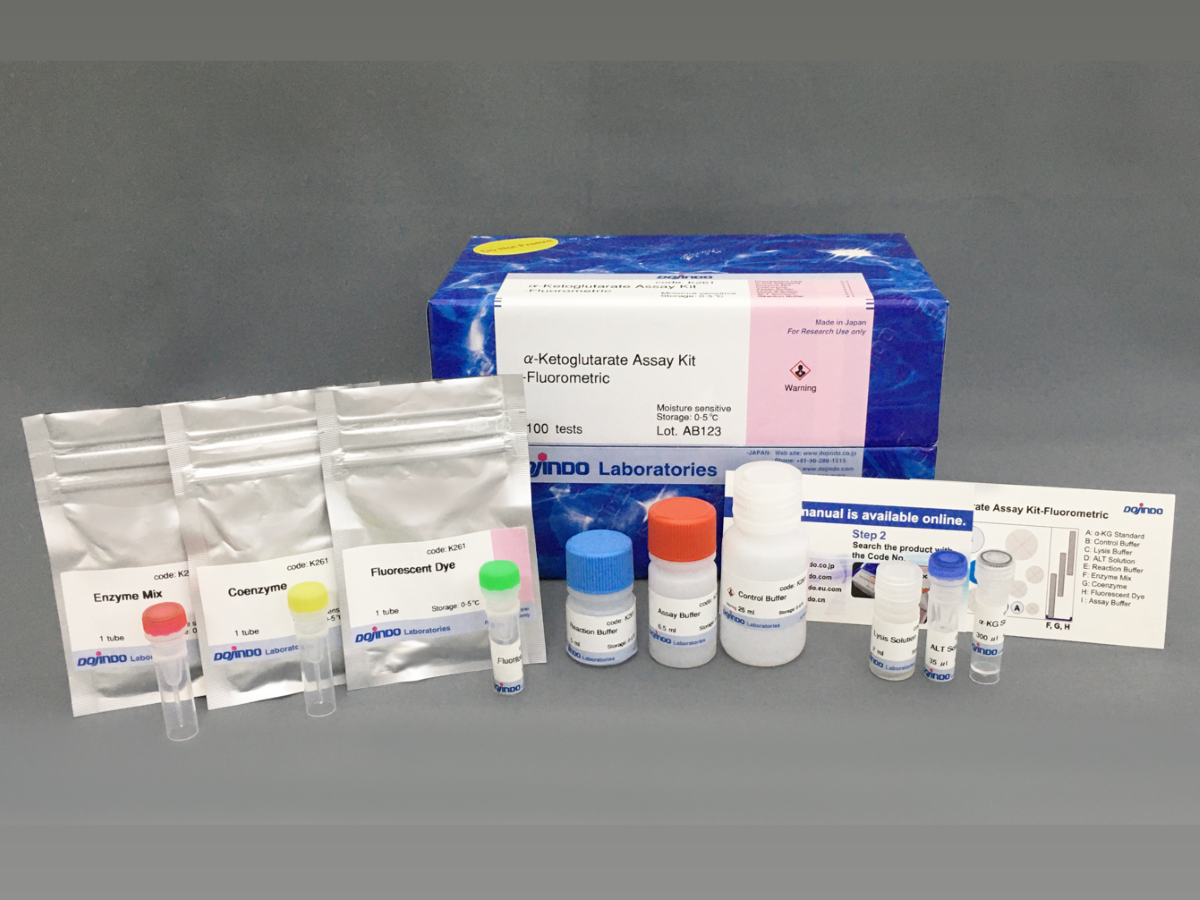
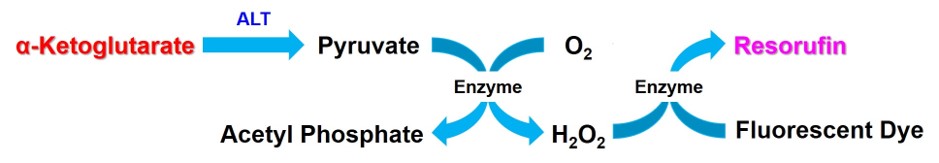
特点:
● 检测灵敏度高
● 操作简便,用时短
● 可以用荧光酶标仪做高通量筛选
● 荧光染料泄露少,数据重现性高


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Viability Assay Kit – Luminescent Detection 细胞增殖/毒性检测-发光法(CCK-L)
NO.2. Caspase-3 Assay Kit-Colorimetric- 细胞凋亡检测
NO.3. Cell Counting Kit-8 细胞增殖毒性检测
NO.4. DALGreen – Autophagy Detection 细胞自噬检测
NO.5. FerroOrange 细胞亚铁离子检测
产品概述
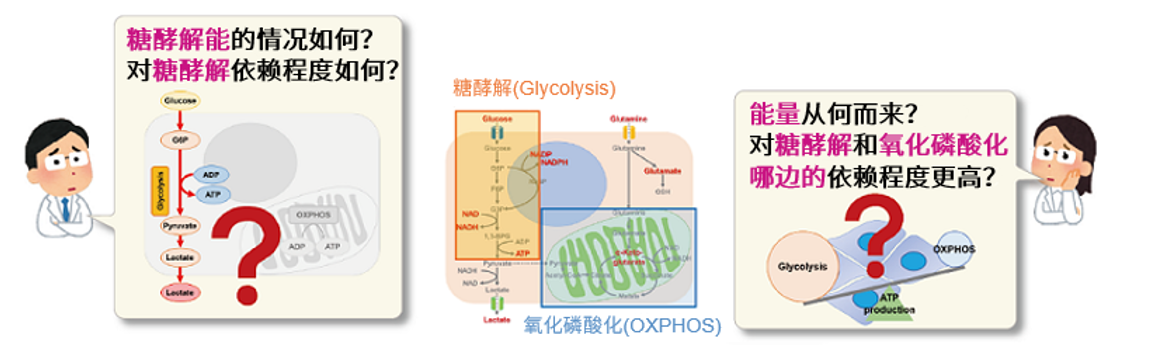
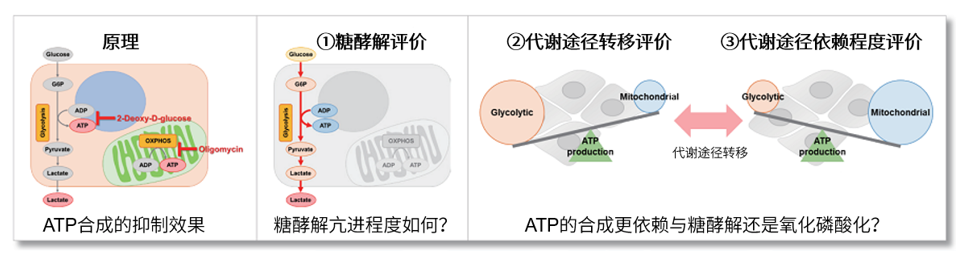
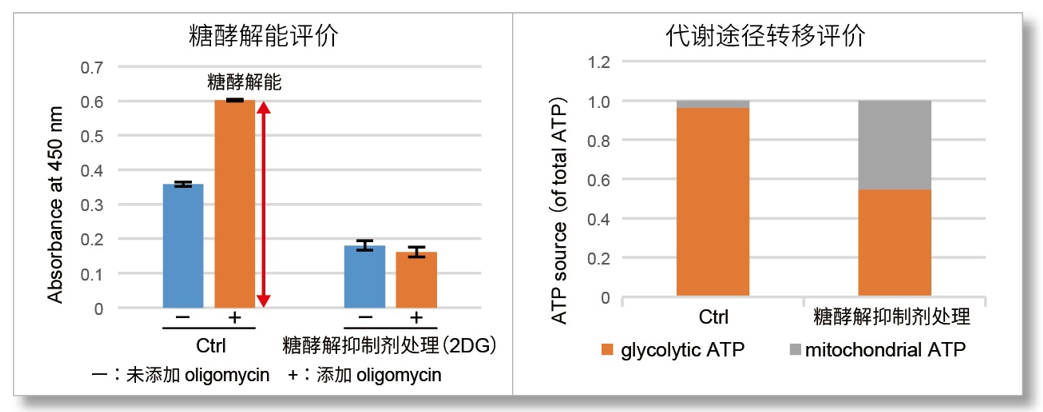
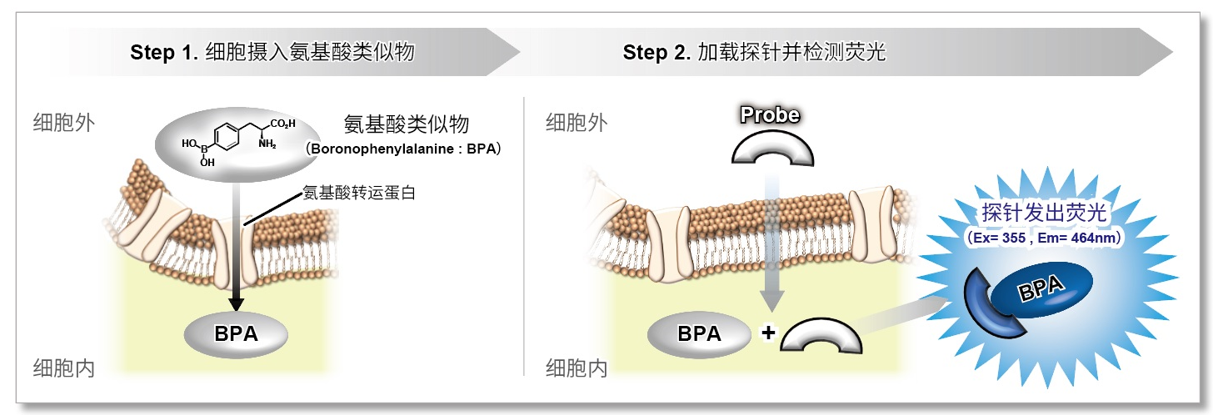
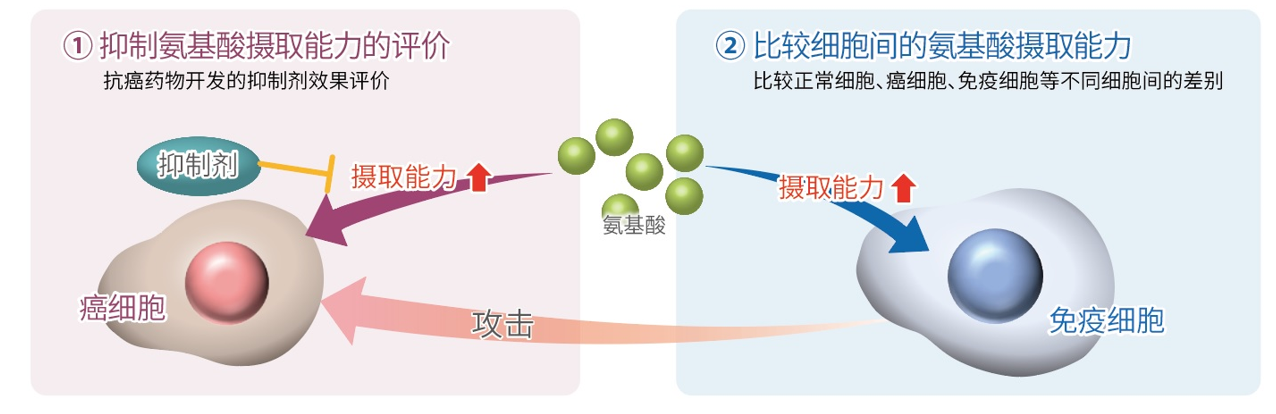
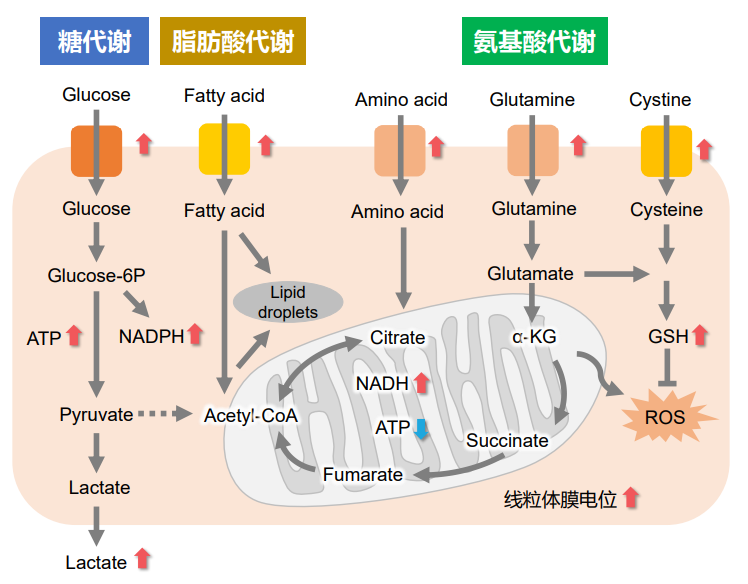
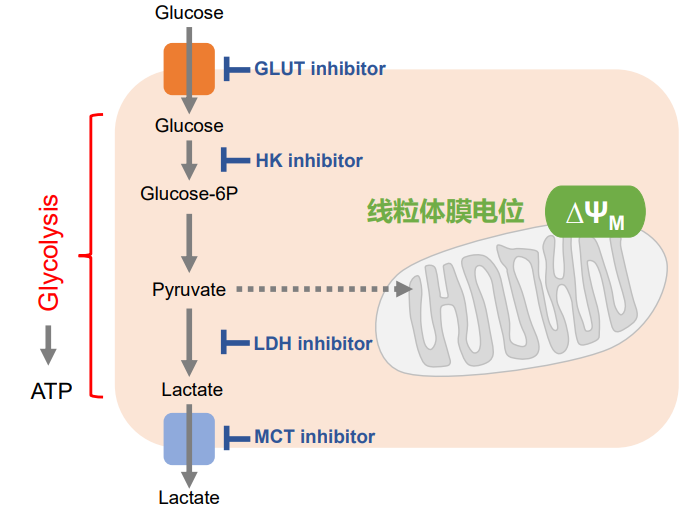
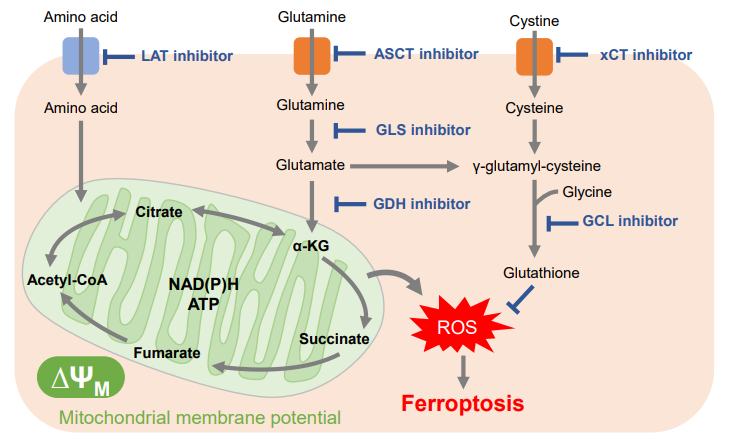
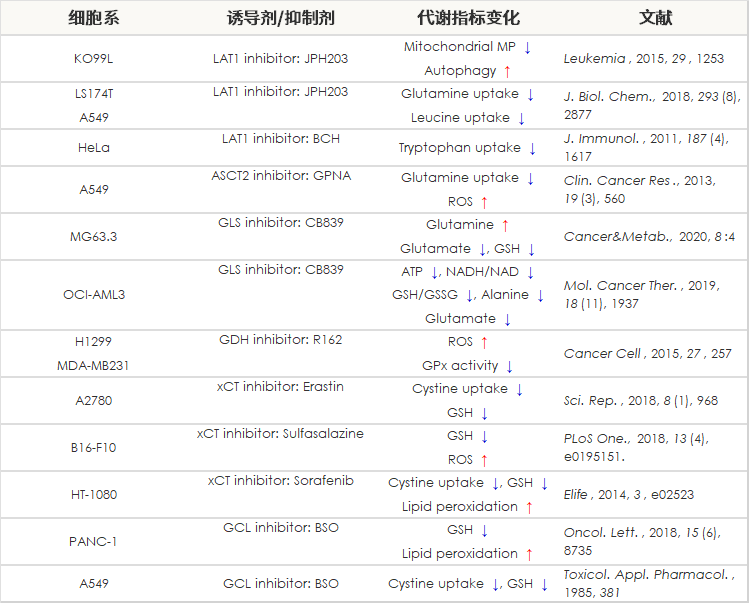
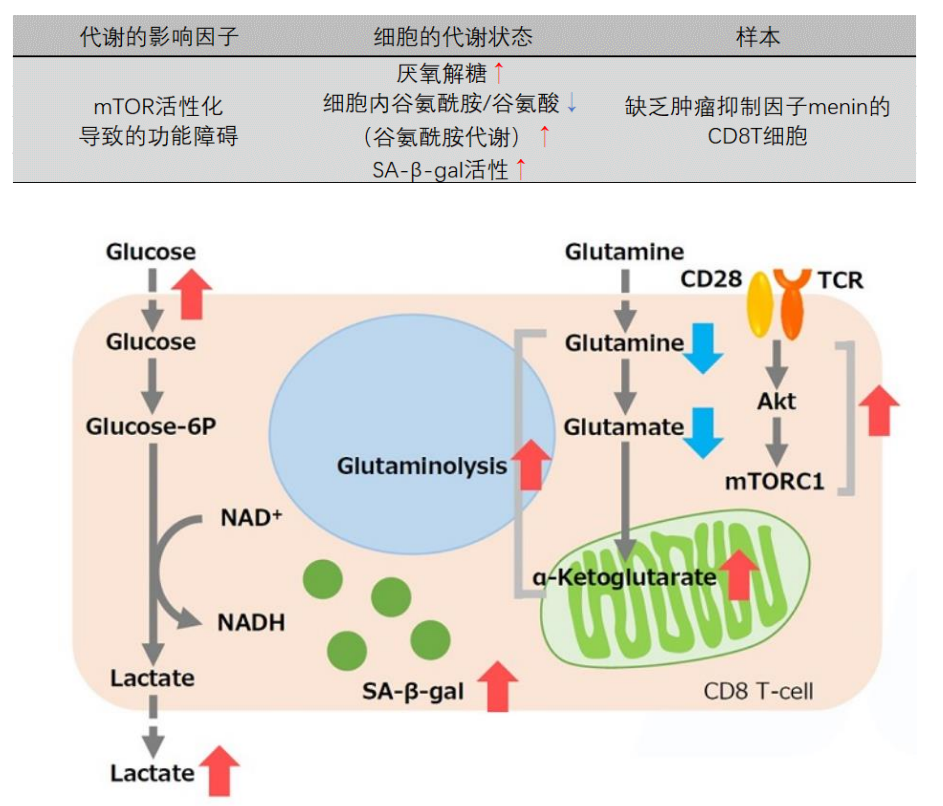
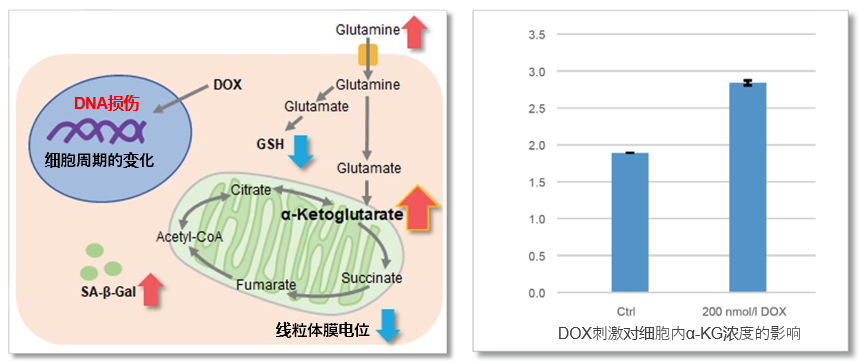
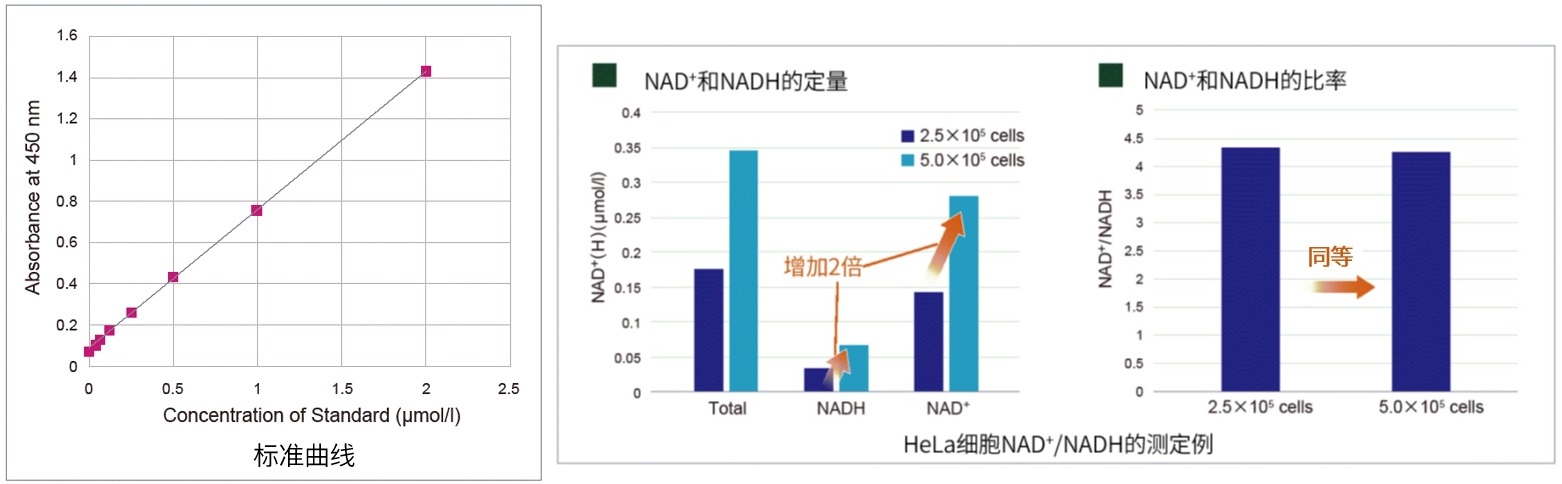
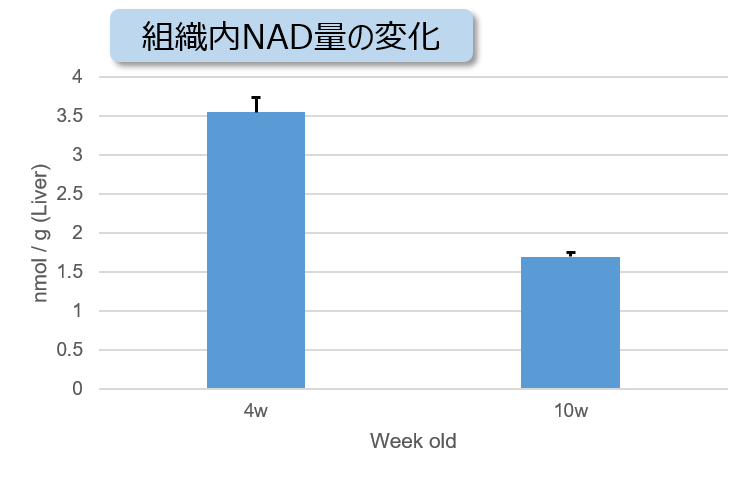
细胞通过摄入各种各样的营养物质并在胞内的代谢作用下产生能量。营养物代谢的过程随着细胞外环境、细胞状态、细胞种类的不同亦不尽相同。近年来的研究发现,营养代谢不仅与能量的产生密切相关,还与基因表达等各种各样的细胞调节机制有关。葡萄糖是最重要的一种营养物质,细胞摄取葡萄糖的过程对于研究和理解细胞机能非常重要。细胞摄取葡萄糖的评价方法主要是放射性同位素示踪法。但是由于放射性同位素示踪法操作繁杂,泛用性并不高。另外,还有一种使用2-Deoxy-D-glucose(2-DG)的酶循环法,该方法虽然可以进行孔板检测,但是无法用于荧光显微镜和流式细胞仪观察。因此,最近常用的方法是通过葡萄糖类似物2-NBDG的荧光检测法1)。然而,2-NBDG也有荧光强度弱、灵敏度低的问题,而且被细胞摄取的2-NGDG还有从细胞中向外泄漏的情况出现。同仁化学研究新开发的荧光葡萄糖类似物Glucose Uptake Probe-Green是一种比2-NBDG灵敏度更高的葡萄糖摄取能力检测试剂。而且使用本试剂盒中包含的Washing and Imaging (WI) Solution可以抑制探针从细胞内泄漏,得到重现性更高的实验数据。
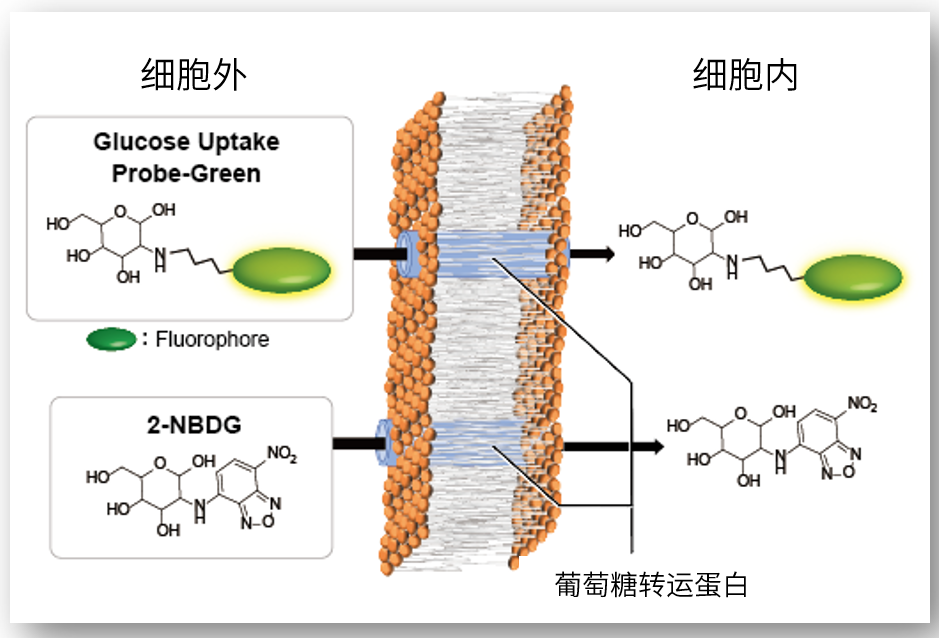
产品优势
与传统方向相比的优势! 4大特征
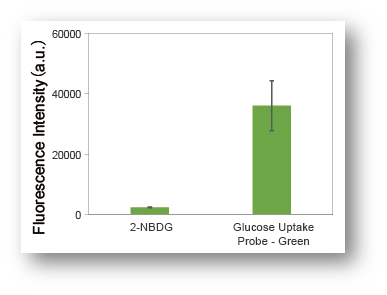
由于采用高亮度的荧光染料,相较于传统方法(2-NBDG)可以在更短时间内进行高灵敏度检测。
① 高灵敏度
2-NBDG在水中的荧光强度很低,而本试剂盒采用的荧光染料可以进行高灵敏度的葡萄糖摄取能力检测。
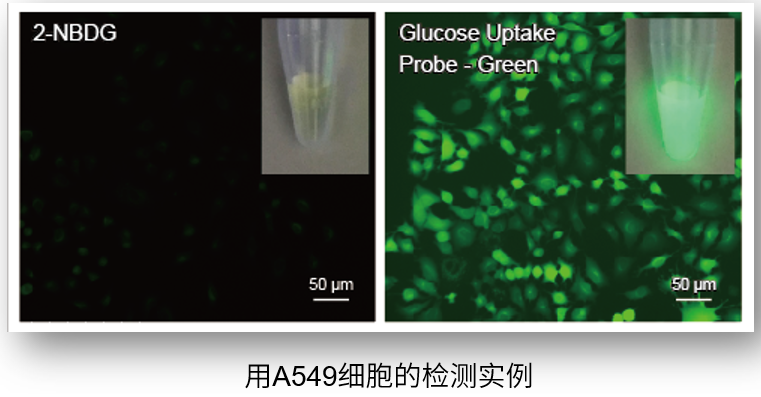
<观测条件>
细胞: A549细胞
检测仪器:荧光显微镜
检测滤光片:GFP (Ex: 470 /40 nm; Em: 525 /50 nm)
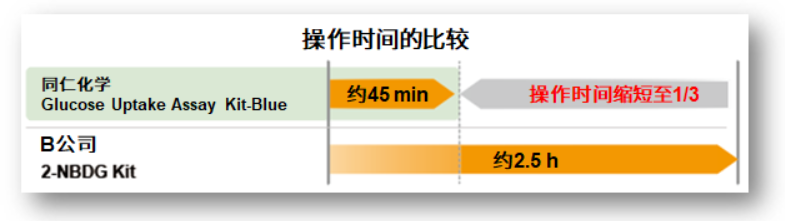
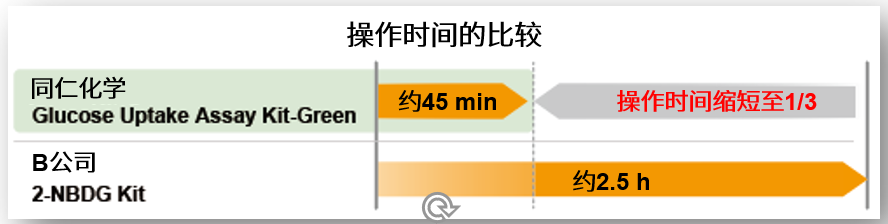
② 快速检测
使用高亮度的Glucose Uptake Probe-Green,即使使用2-NBDG完全相同的实验步骤,也可以大幅缩短实验时间。
操作的前处理、染色(进入细胞内的过程)的步骤只需要清洗3次,非常简便
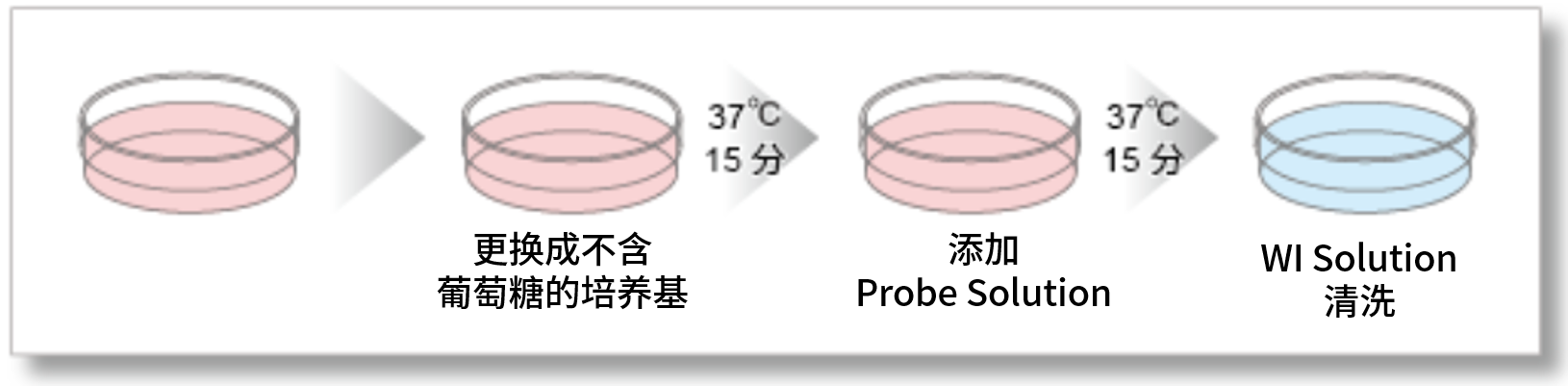
③ 荧光酶标仪的多样品检测
2-NBDG很难用于荧光酶标仪的检测,而本试剂盒可用于荧光酶标仪的高通量筛选实验。
<检测条件>
细胞:A549细胞
Ex: 488 nm; Em: 520 nm
④ 减少荧光染料的泄漏
使用试剂盒附带的WI Solution清洗细胞,可以抑制染料进入细胞后的泄漏,得到重现性更高的数据。
使用HBSS清洗细胞时
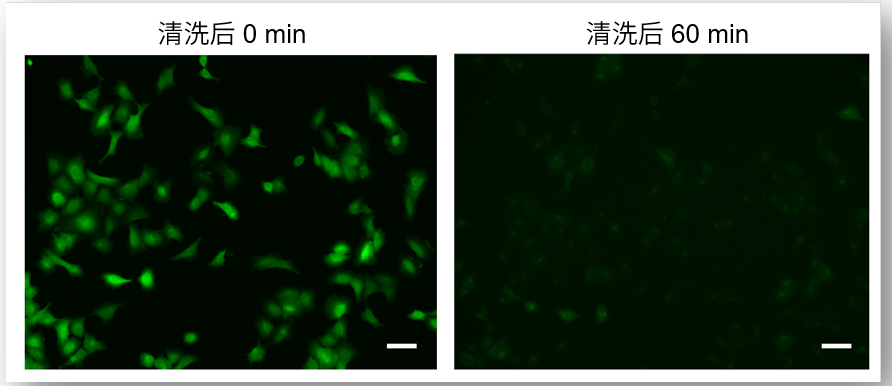
使用WI Solution清洗细胞时
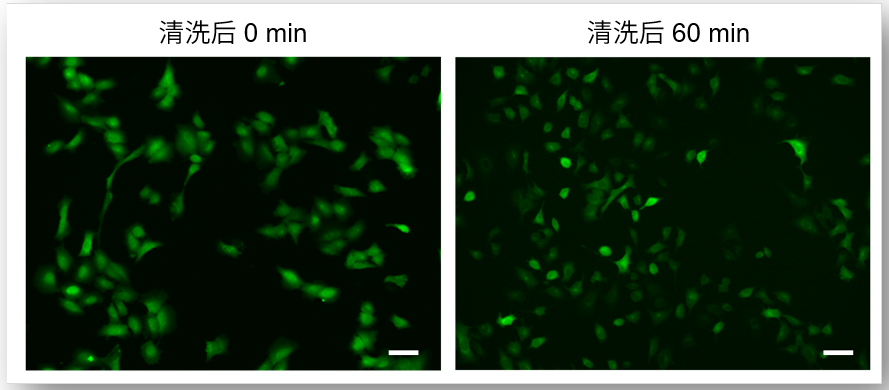
(Scale Bar: 50 μm)
<观测条件>
细胞:A549细胞
检测仪器:荧光显微镜
检测滤光片:GFP (Ex: 470 /40 nm; Em: 525 /50 nm)
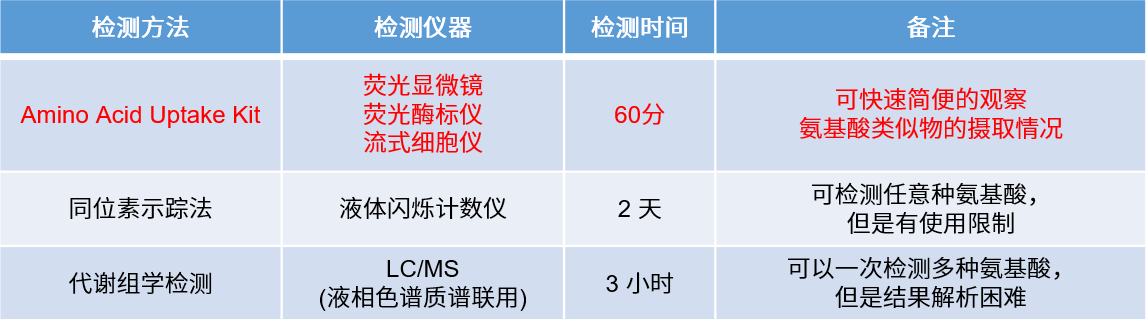
与传统法的比较
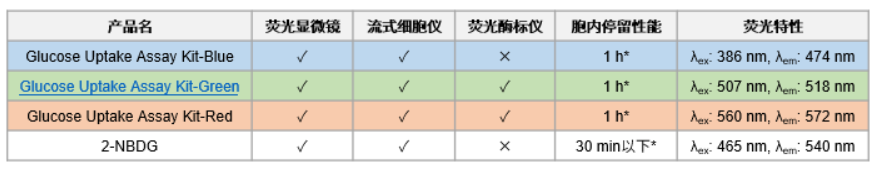
Glucose Uptake Probe-Green和2-NBDG都可以用于荧光显微镜和流式细胞仪的检测。而相比较于2-NBDG的激发波长,Glucose Uptake Probe-Green对于488 nm的激发光以及GFP, FITC滤光片的适用度更高。
| 产品名 | 荧光
显微镜 |
荧光
酶标仪 |
流式
细胞仪 |
染料滞留时间 | 荧光特性 |
| Glucose Uptake Assay Kit-Green | 〇 | 〇 | 〇 | 1 h※ | λex: 507 nm, λem: 518 nm |
| 2-NBDG | 〇 | × | 〇 | 30 min以下※ | λex: 465 nm, λem: 540 nm |
※A549细胞的检测结果,不同的细胞种类,染料的滞留时间可能会有差异。
相关产品区别
与Glucose Assay Kit的不同点
Glucose Uptake Probe-Green和Glucose Assay Kit-WST(货号:G264)的不同点。
1.Glucose Assay Kit-WST可以定量检测细胞上清液中葡萄糖的消耗量。
Glucose Uptake Assay Kit无法定量检测葡萄糖。
2.Glucose Uptake Assay Kit-Green可短时间内检测葡萄糖摄取能力的差值。
Glucose Assay Kit-WST无法在短时间内检测葡萄糖量的变化。
Glucose Assay Kit-WST与本试剂盒的差别,通过下面的检测实例来说明。
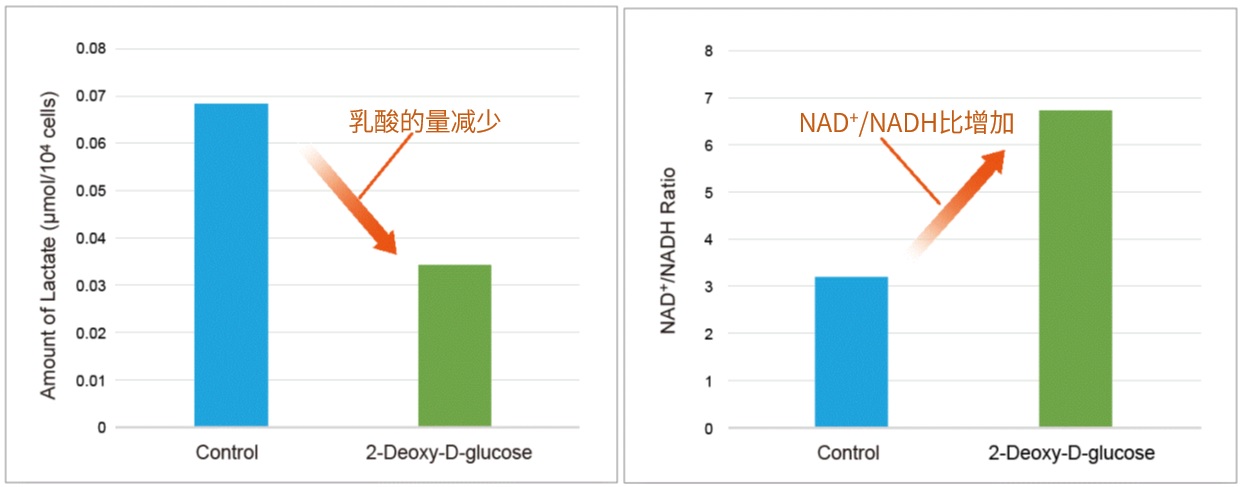
实验例:用葡萄糖摄取抑制剂(Cytochalasin B)处理的HepG2细胞的葡萄糖消费量和葡萄糖摄取能力的检测。
实验的流程和检测结果:

实验例
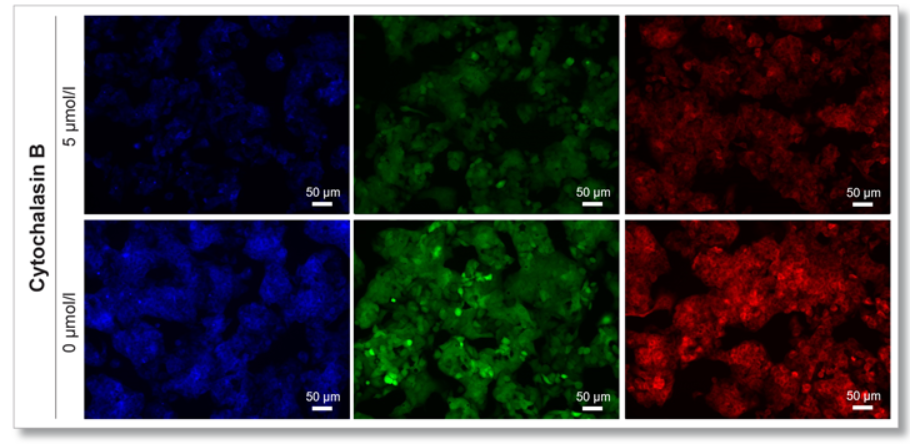
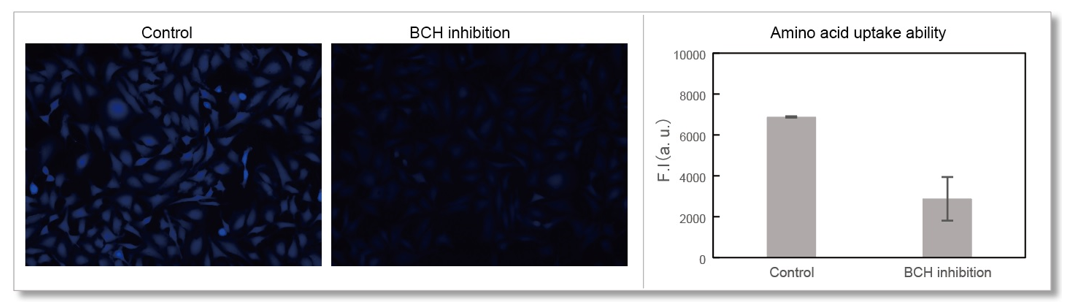
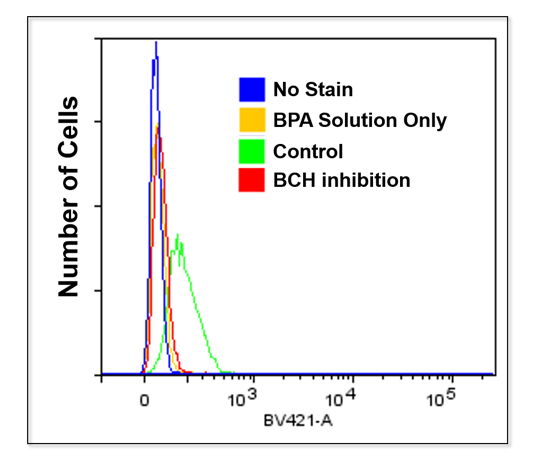
实验例1:Cytochalasin B对葡萄糖摄取的抑制作用
HepG2细胞经过葡萄糖转运蛋白抑制剂Cytochalasin B处理后,使用本试剂盒对葡萄糖摄取能力的抑制作用进行高灵敏度观察以及数值化的检测。
荧光显微镜观察
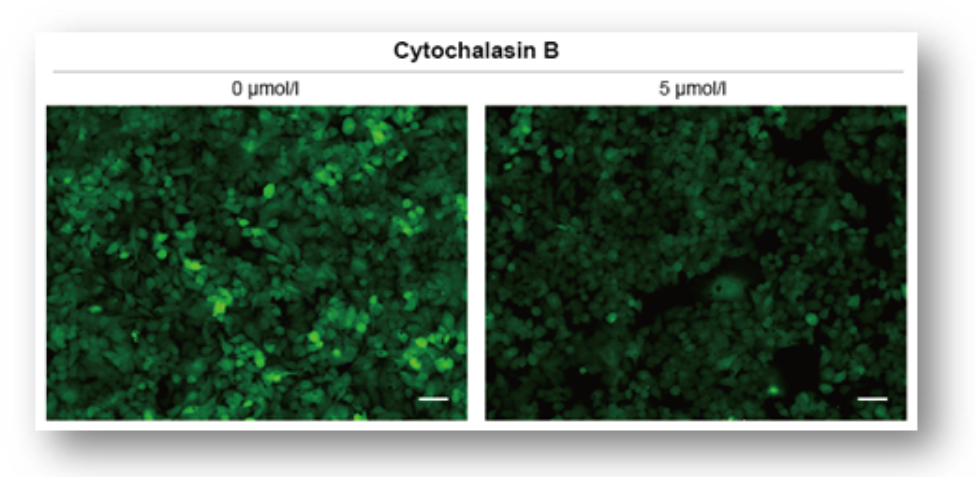
(Scale Bar: 50 μm)
<观测条件>
细胞:HepG2细胞
使用培养基:MEM (5.5 mmol/l Glucose)
培养条件:5 µmol/l Cytochalasin B / MEM (5.5 mmol/l Glucose, 10% FBS), 37℃, 24 h
染色条件:Glucose Uptake Probe (500倍稀释)/DMEM (0 mol/l Glucose), 37℃, 15 min
检测仪器:荧光显微镜; 滤光片:GFP (Ex: 470 /40 nm; Em: 525 /50 nm)
荧光酶标仪
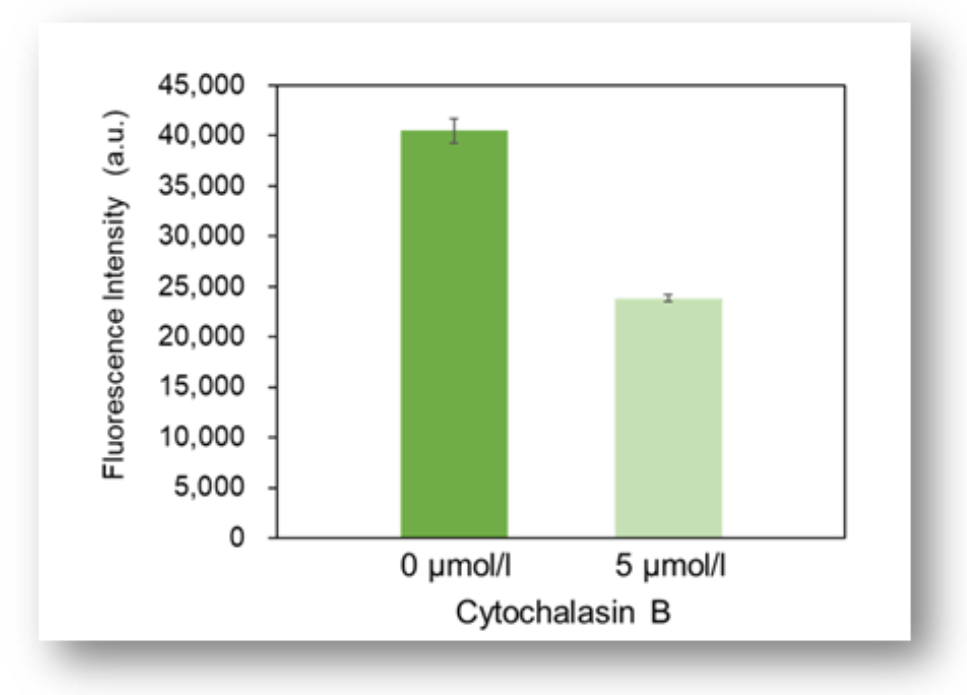
<检测条件>
Ex: 488 nm; Em: 520 nm
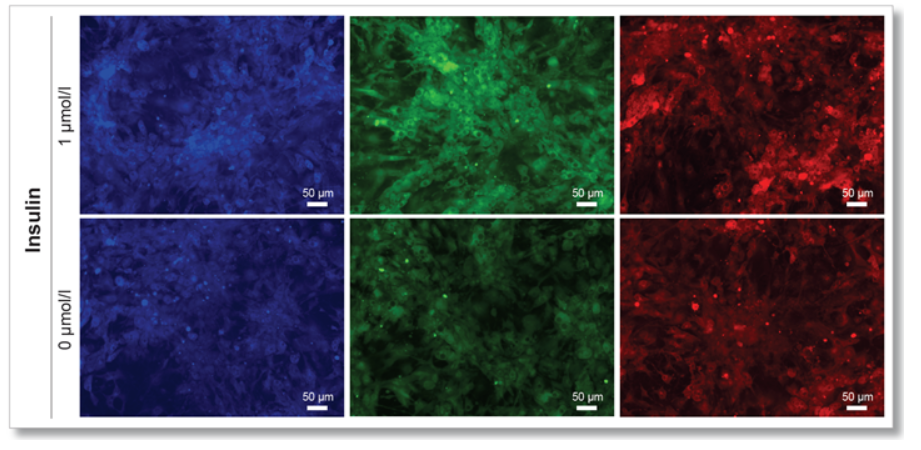
实验例2:Insulin(胰岛素)对细胞葡萄糖摄取能力的促进
胰岛素对脂肪细胞(adipocyte)的葡萄糖摄取能力的影响通过本试剂盒进行高灵敏度检测。
荧光显微镜观察
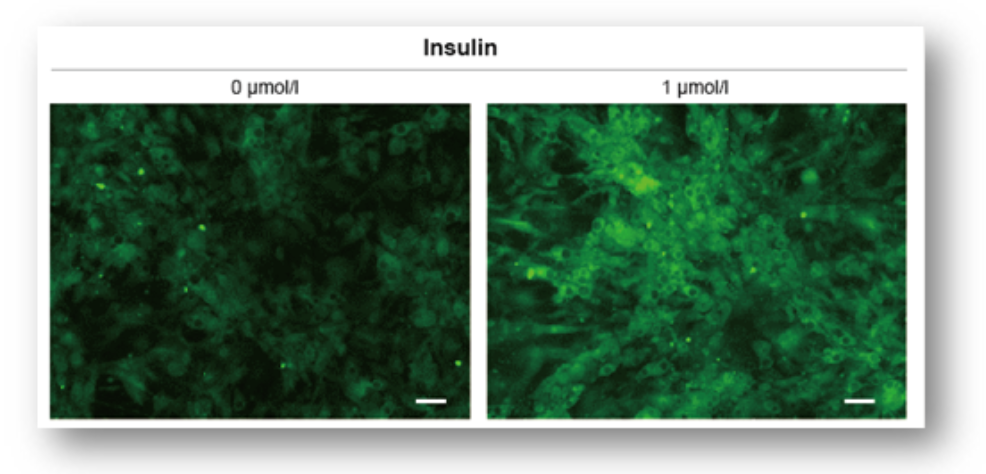
(Scale Bar: 50 μm)
<观测条件>
细胞:mouse adipocyte
使用培养基:DMEM (5.5 mmol/l Glucose, 10% FBS)
刺激条件:0 or 1 µmol/l Insulin / DMEM (0 mmol/l Glucose , serum free), 37℃, 15 min
染色条件:Glucose Uptake Probe-Green (500倍稀释) /DMEM (0 mmol/l Glucose, serum free), 37℃, 15 min
检测仪器:荧光显微镜; 滤光片:GFP (Ex: 470 /40 nm; Em: 525 /50 nm)
荧光酶标仪检测
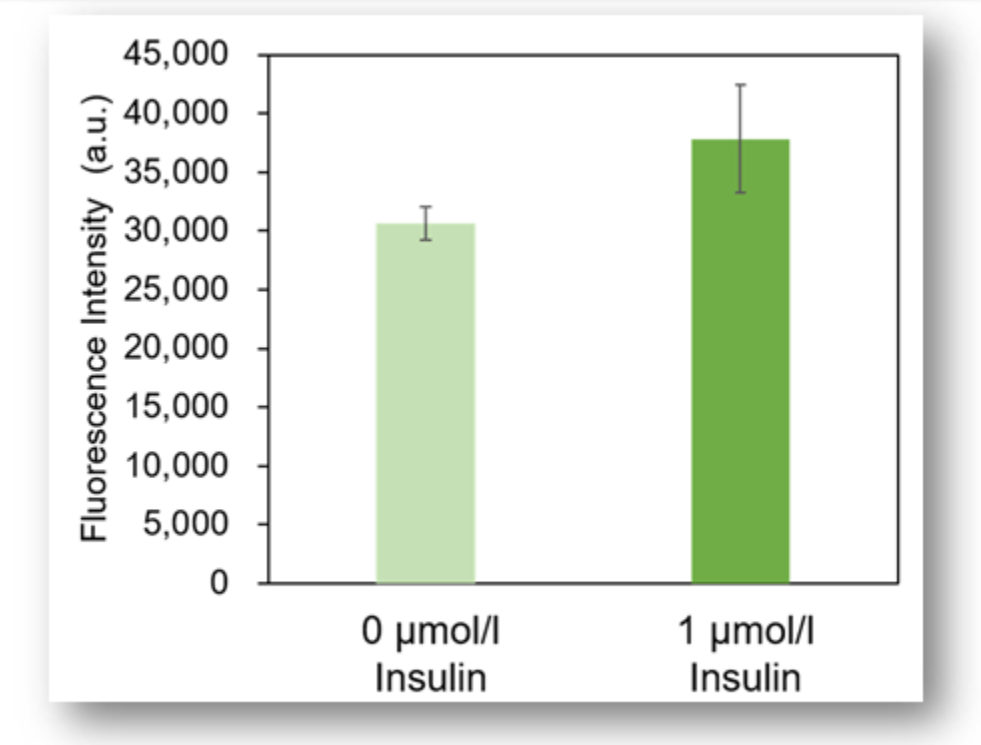
<检测条件>
Ex: 488 nm; Em: 520 nm
※由于脂肪细胞的特性,很难在孔板上均匀分布,所以实验数据会有一些孔间差。
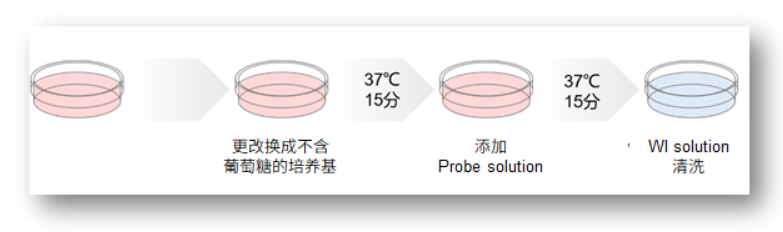
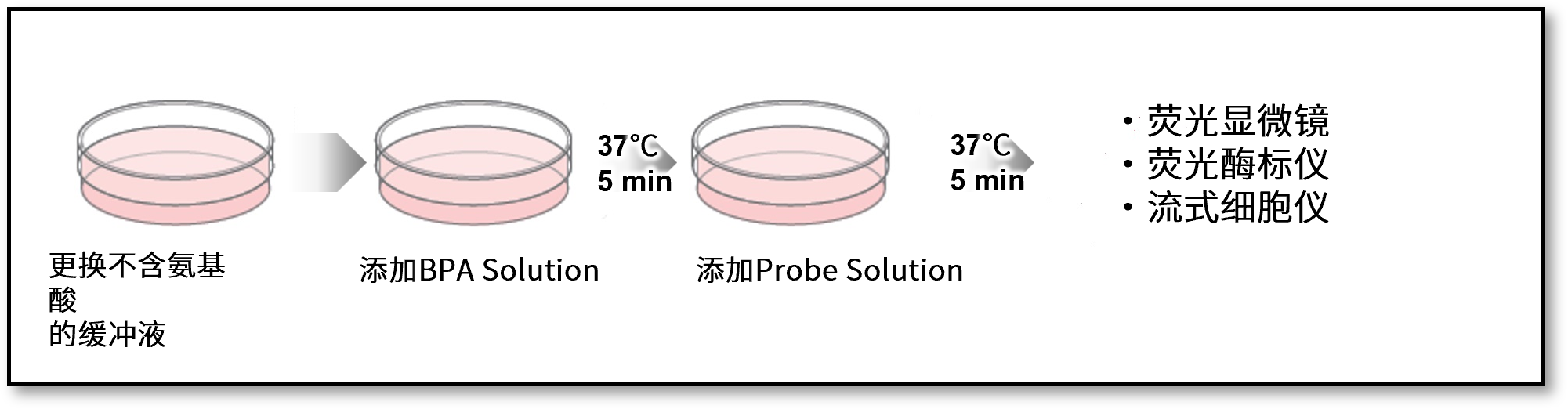
<实验操作>
1.脂肪细胞分别接种到不同的ibidi 96孔板中,过夜培养。
2.用不含葡萄糖的DMEM培养基清洗细胞2次后,加入不含葡萄糖的培养基(0 or 1 μmol/l Insulin)。
3.在37℃下培养15 min。
4.加入用不含葡萄糖的培养基500倍稀释的Probe solution, 37℃下培养15 min。
5.用预冷至4℃的WI Solution(1x)清洗3次后,再次添加WI Solution(4℃)。
6.分别用荧光显微镜和荧光酶标仪检测。
实验例3:前脂肪细胞和细胞脂肪细胞的葡萄糖摄取能力的比较
使用本试剂盒对前脂肪细胞(preadipocyte)和脂肪细胞(adipocyte)的葡萄糖摄取能力进行高灵敏度检测。
荧光显微镜观察

(Scale Bar: 50 μm)
<观测条件>
细胞:preadipocyte, adipocyte
使用培养基:DMEM (5.5 mmol/l Glucose, 10% FBS)
染色条件:Glucose Uptake Probe-Green (500倍稀释) /DMEM (0 mmol/l Glucose, serum free), 37℃, 15 min
检测仪器:荧光显微镜; 滤光片:GFP (Ex: 470 /40 nm; Em: 525 /50 nm)
荧光酶标仪检测
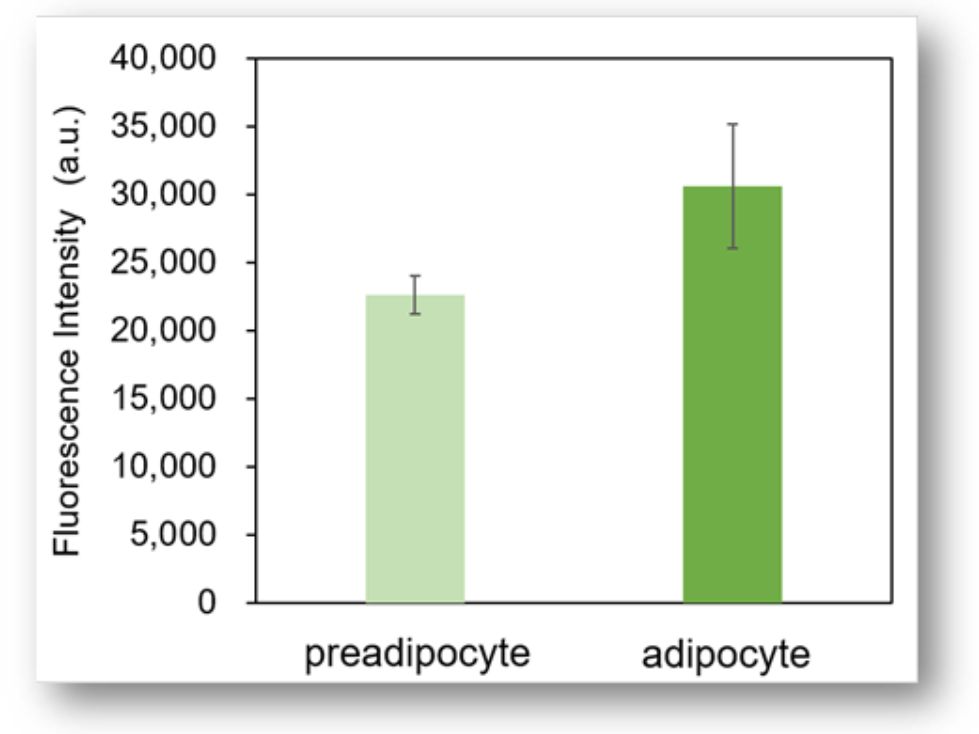
<检测条件>
Ex: 488 nm; Em: 520 nm
※由于脂肪细胞的特性,很难在孔板上均匀分布,所以实验数据会有一些孔间差。
<实验操作>
1.前脂肪细胞和脂肪细胞分别接种到不同的ibidi 96孔板中,过夜培养。
2.用不含葡萄糖的DMEM培养基清洗细胞2次后,加入不含葡萄糖的培养基。
3.在37℃下培养15 min。
4.加入用不含葡萄糖的培养基500倍稀释的Probe solution, 37℃下培养15 min。
5.用预冷至4℃的WI Solution(1x)清洗3次后,再次添加WI Solution(4℃)。
6.分别用荧光显微镜和荧光酶标仪检测。
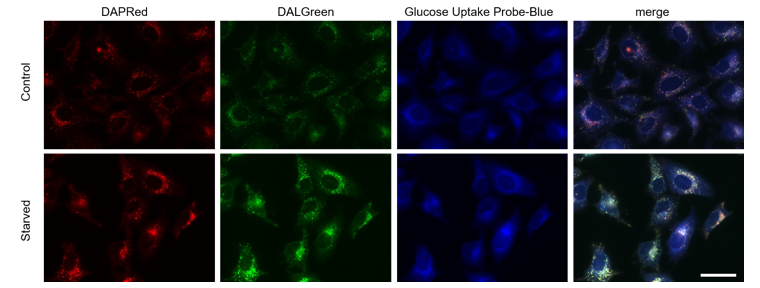
实验例4:饥饿培养引起的细胞自噬和葡萄糖摄取变化
用自噬体染料DAPRed和自噬溶酶体染料DALGreen染色HeLa细胞后,用不含氨基酸的培养基培养3小时诱导细胞自噬。通过DAPRed和DALGreen的荧光强度增高确认细胞发生了细胞自噬,另外通过使用Glucose Uptake Probe-Blue发现细胞摄取葡萄糖的能力上升。
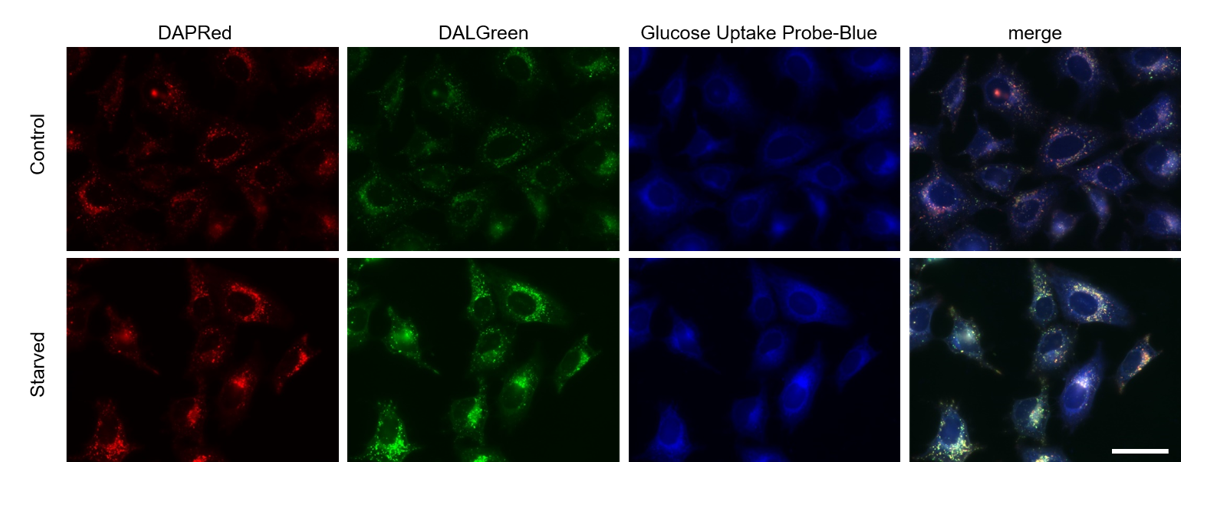
(Scale Bar: 50 μm)
<检测条件>
荧光显微镜
Blue: Ex = 340-380 nm, Em = 435-485 nm
Green: Ex = 450-490 nm, Em = 500-550 nm
Red: Ex = 533-557 nm, Em = 570-640 nm
常见问题Q&A
| Q1: Glucose Uptake Probe-Green具体是通过哪种葡萄糖转运蛋白进入细胞的? |
| A:对于具体的每一种葡萄糖转运蛋白的特异性目前还没有详细的数据。 |
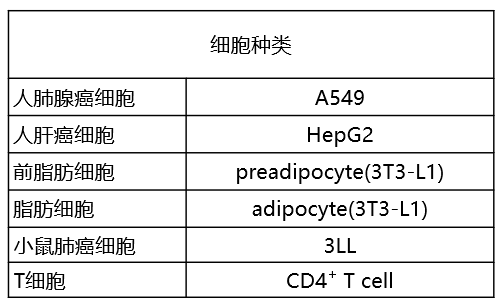
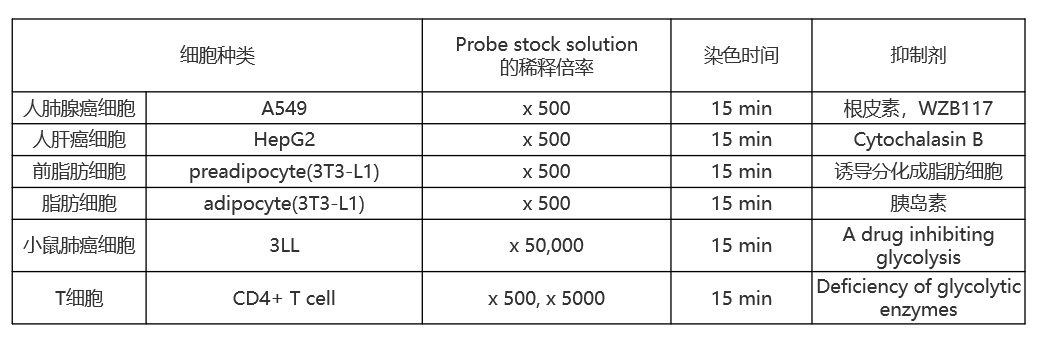
| Q2:目前有过检测实例的细胞有哪些? |
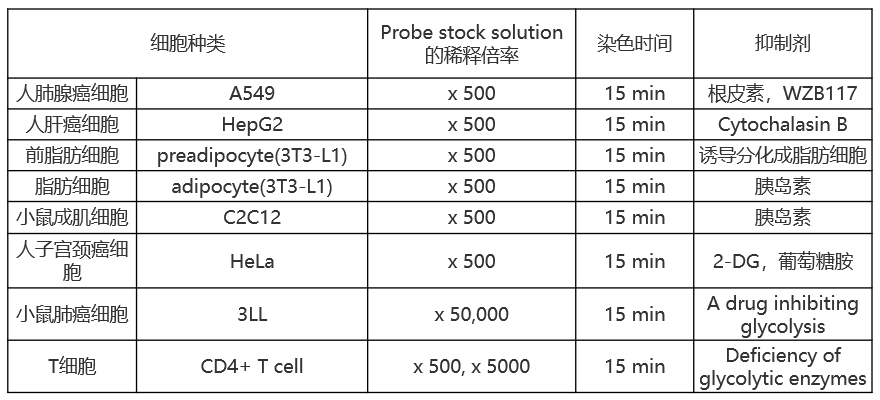
| A:目前的检测实例细胞系请参考下表: |
| 细胞种类 | Probe stock solution
的稀释倍率 |
染色时间 | |
| 人肺腺癌细胞 | A549 | x 500 | 15 min |
| 人肝癌细胞 | HepG2 | x 500 | 15 min |
| 前脂肪细胞 | preadipocyte(3T3-L1) | x 500 | 15 min |
| 脂肪细胞 | adipocyte(3T3-L1) | x 500 | 15 min |
| 恶性黑色肿瘤细胞 | MO5 | x 500 | 15 min |
| 小鼠成肌细胞 | C2C12 | x 500 | 5 min |
| 人星形胶质瘤细胞 | U-251 MG | x 500 | 15 min |
| 人子宫颈癌细胞 | HeLa | x 500 | 15 min |
| 小鼠肺癌细胞 | 3LL | x 50000 | 15 min |
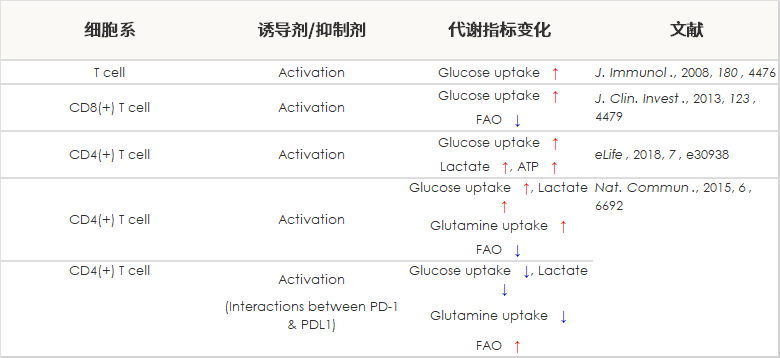
| T细胞 | CD4+ T cell | x 50, x500 | 15 min |
| 小鼠巨噬细胞 | J774.1 | x 500 | 15 min |
| 线虫 | N2 | x 500 | 90 min |
| Q3:Glucose Uptake Probe-Green被细胞摄入后,会被分解或代谢掉吗? |
| A:染料的荧光部分非常稳定,实验范围内的操作不会造成分解。另外,类葡萄糖的部位,从结构上考虑可能会被Hexokinase(己糖激酶)磷酸化,除此以外应该不会参加任何代谢反应。 |
| Q4:Glucose Uptake Probe-Green被活细胞摄入后,可以进行细胞固定的操作吗? |
| A:由于荧光探针会从细胞内漏出,染色后无法进行细胞固定。 |
| Q5:用荧光酶标仪检测时候,对孔板有什么特别要求吗? |
| A:需要使用荧光检测用的细胞培养板。 |
| Q6:Probe working solution可以长期保存吗? |
| A:Probe working solution无法长期保存,请现配现用。Probe stock solution冷冻可以保存一个月。 |
| Q7:无法观察到荧光信号变化的时候,应该怎么办? |
| A:预实验的时候可以先从稀释浓度(x250~x1,000)、染色时间(5 min~1 h)范围内进行摸索。 |
| Q8:荧光背景高的时候,应该怎么办? |
| A:可能是由于有未被细胞摄入的残留荧光染料。请用WI Solution再多进行一次清洗操作。 |
| Q9:Glucose Uptake Probe-Green对细胞有毒性吗? |
| A:使用同仁化学研究所的Cell Counting Kit-8(货号:CK04)对A549细胞的Glucose Uptake Probe-Green细胞毒性进行了检验,没有发现细胞毒性的产生。 |
| Q10:用WI solution清洗之后,荧光染料可以在细胞内停留多长时间? |
| A:一般在室温下可以保持在细胞内1 h左右,不同的细胞种类,时间可能会有一定差别。 |
| Q11:可以对葡萄糖进行定量检测吗? |
| A:本产品不能用于葡萄糖的定量检测。如果需要定量检测培养基中的葡萄糖的消耗量或者细胞内的葡萄糖量,可以使用同仁化学研究所的Glucose Assay Kit-WST(货号:G264)。 |
| Q12:可以对被细胞摄入的染料进行定量吗? |
| A:不可以对细胞摄入的染料进行定量。本试剂盒是葡萄糖摄取能力强弱或增减的检测试剂盒。 |
| Q13:如果无法通过葡萄糖的竞争性抑制细胞探针的摄取,该如何解决? |
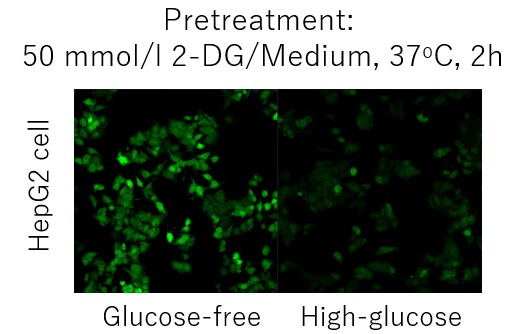
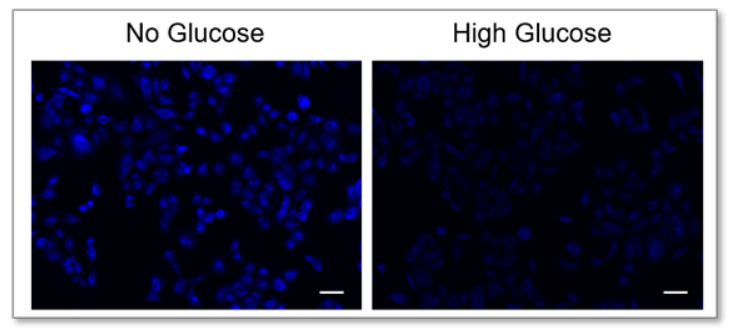
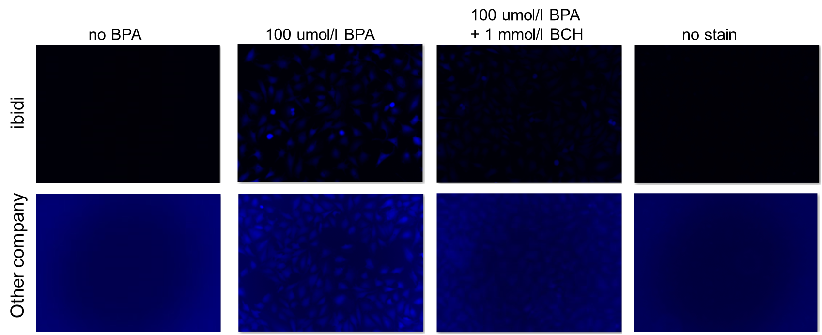
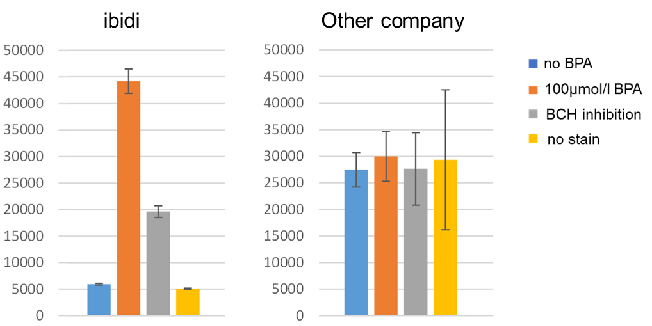
A:竞争性抑制是否发生取决于每个细胞中的葡萄糖转运蛋白的表达水平和类型。(例如:HepG2细胞)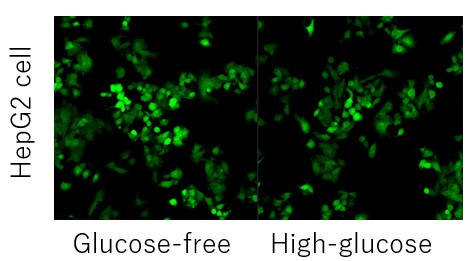
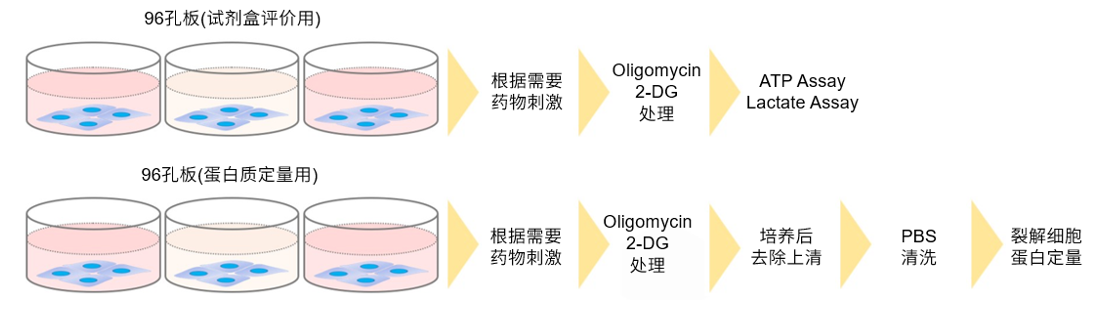
在这种情况下,使用2-脱氧葡萄糖(2-DG)进行预处理可能会在葡萄糖竞争抑制方面产生差异。 请参考Glucose Uptake Assay Kit-Green(产品代码:UP02)的使用示例。 2-DG预处理对探针摄取的抑制和葡萄糖竞争性抑制(HepG2细胞) 1.将细胞接种在培养皿或微孔板中,并在5% CO₂培养箱(37°C)中培养过夜。 2.除去培养基[DMEM (10% FBS,高葡萄糖)]后,加入50 mmol/l 2-DG/培养基,并 在5% CO₂培养箱(37℃)中培养细胞2小时。 3.清洗细胞两次。 4.加入预热的DMEM(无葡萄糖,无血清)并将细胞在5%CO₂中孵育 在培养箱(37°C)中培养15 min。 5.除去上清液后,加入预热的探针溶液并在5% CO₂中孵育 在培养箱(37°C)中培养15 min。 6.除去上清液后,用冷却的WI溶液(1x)洗涤细胞两次。 7.除去上清液后,加入冷却后的WI溶液(1x),并在室温下培养 5分钟。 8.除去上清液后,加入冷却的WI溶液(1x)。 9.荧光显微镜下观察细胞。
|
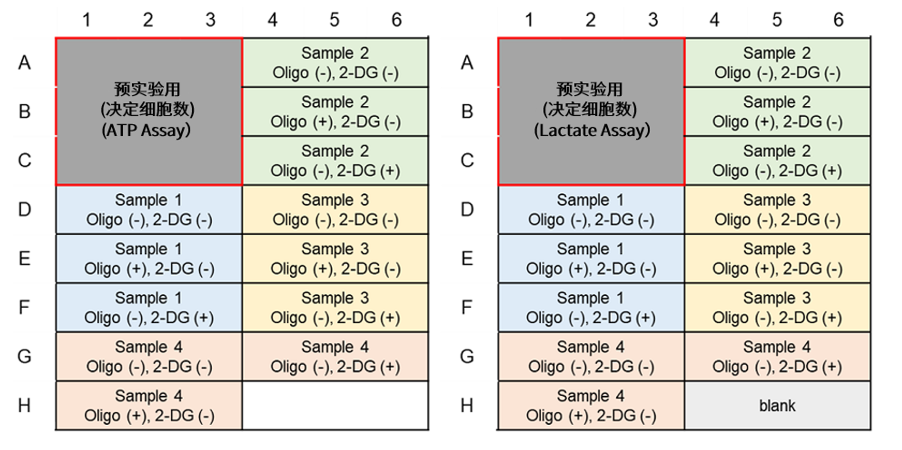
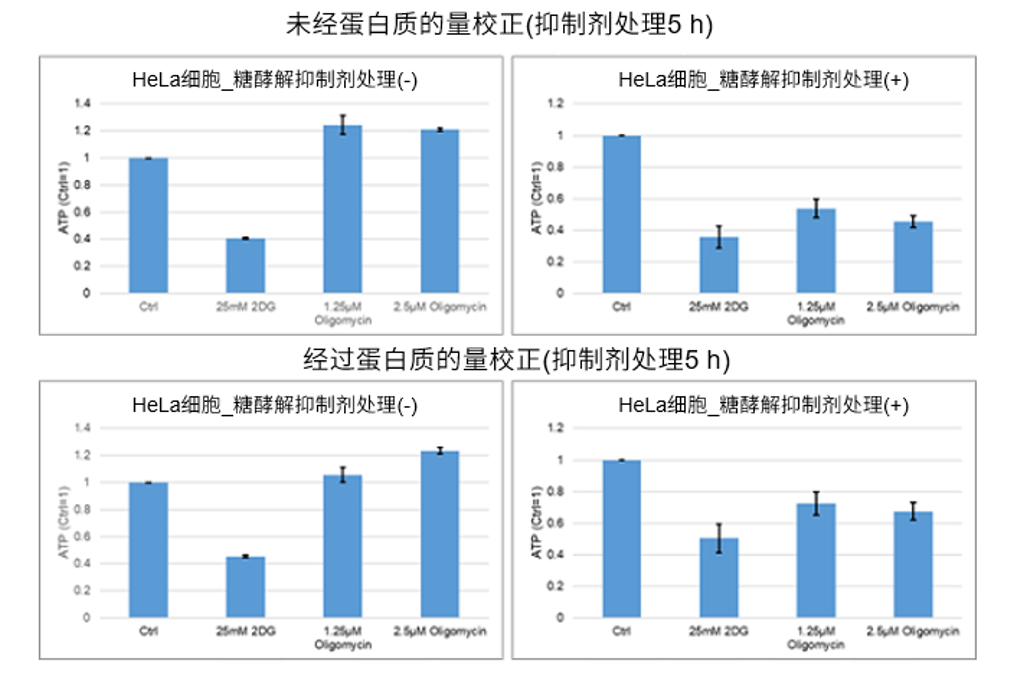
| Q14: 以下为不同细胞添加抑制剂后,葡萄糖摄取能力检测实验。 |
 |
规格性状
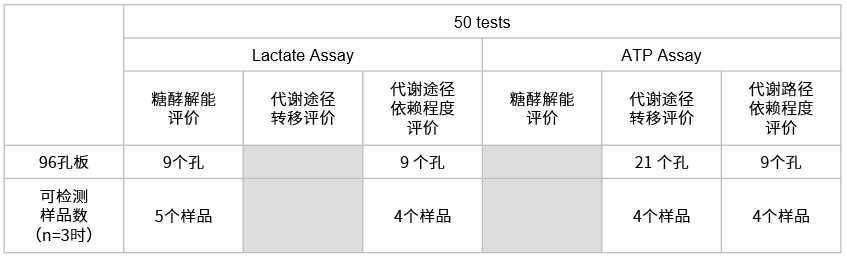
| Glucose Uptake Probe-Green ×1
WI Solution (50X) 5 ml ×1 供参考的可测次数 每个试剂盒大约可检测12枚35 mm dish或1枚96孔板 |
参考文献
| 编号 | 文献 | 年 | IF |
| 1 | Enhanced aerobic denitrification performance with Bacillus licheniformis via secreting lipopeptide biosurfactant lichenysin, Chemical Engineering Journal,2022,434:134686 | 2022 | 13.3 |
| 2 | Genetically engineered probiotics as catalytic glucose depriver for tumor starvation therapy | 2023 | 10.8 |
| 3 | Remodeling on adipocytic physiology of organophosphorus esters in mature adipocytes | 2022 | 9.9 |
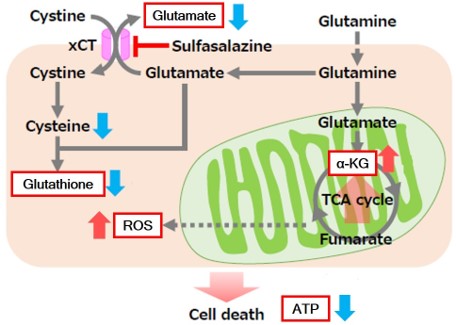
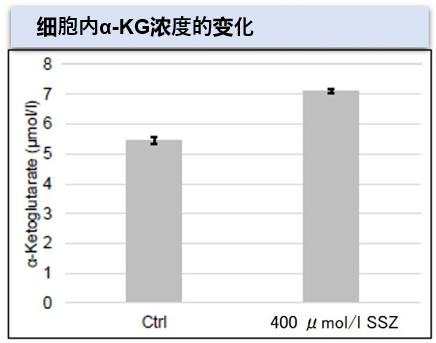
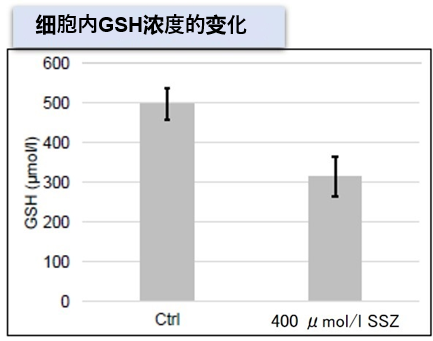
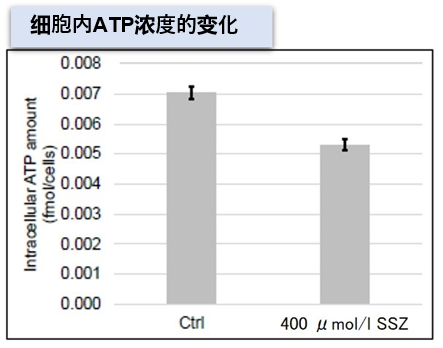
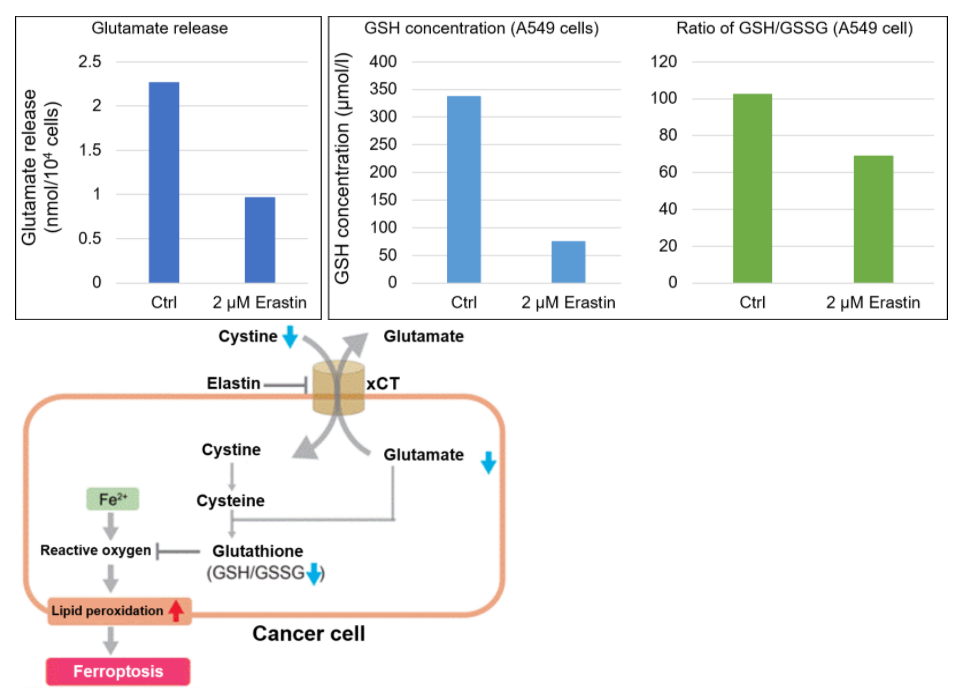
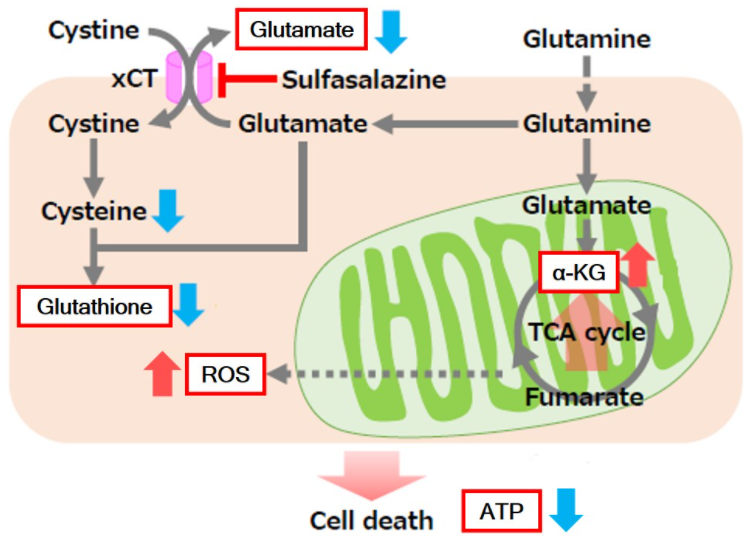
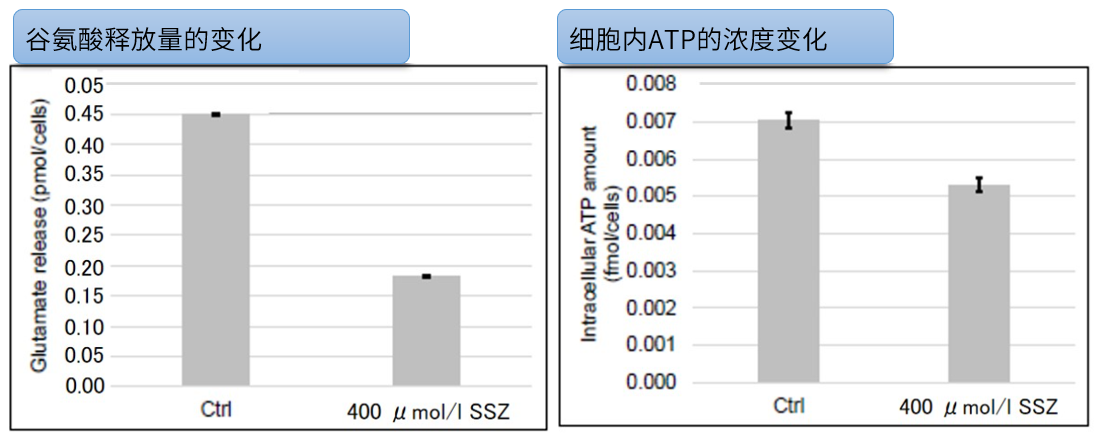
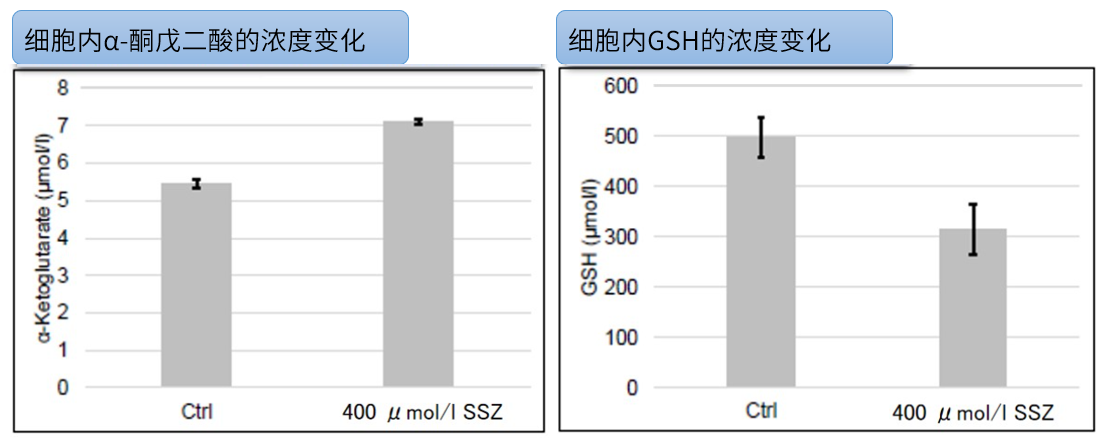
| 4 | Simple Fluorescence Assay for Cystine Uptake via the xCT in Cells Using Selenocystine and a Fluorescent Probe, ACS Sensors,2021, 6(6):2125-2128 | 2021 | 7.7 |
| 5 | N-Caffeoyltryptophan enhances adipogenic differentiation in preadipocytes and improves glucose tolerance in mice | 2023 | 3.7 |