产品特性
细胞膜起着分隔细胞内和细胞外的作用,并且与细胞的移动和生长、神经信号的传达等细胞功能密切相关。因此,细胞膜的异常与各种细胞状态异常所造成的疾病(如离子通道病Channelopathy)有很密切的关联,被认为是非常重要的生物标记物之一。
由于操作简便并且可用于活细胞染色,小分子荧光探针是最常用的细胞膜染色方法。但是小分子荧光探针普遍存在细胞内停留时间短、水溶性差的问题。而PlasMem Bright是一种克服了现有小分子荧光探针问题的产品。 用PlasMem Bright观察细胞膜时,可以在染色后的1天以上进行长时间的荧光观察。
与其他公司产品的比较
PlasMem Bright系列产品克服了现有市面上的细胞膜染色试剂的诸多缺点(细胞毒性高、停留时间短、不同实验系的兼容性差)。并且分别有Green/ Red两种产品,方便多重染色时自由选择。
| 产品名 | 细胞
毒性 |
染色后
的清洗 |
含血清
培养基 |
停留时间 | 染色后
的固定 |
| PlasMem Bright | 低 | 不需要 | 可使用 | 24 h | 可以(PFA) |
| S公司 产品P | – | 需要 | 不可使用 | – | 可以 |
| T公司 产品D | – | 需要 | 可使用 | – | 不可以 |
| T公司 产品C | – | 需要 | 可使用 | 1.5 h | 可以(PFA) |
细胞膜上的停留时间
使用各种细胞膜染色试剂进行染色HeLa细胞,经过24 h培养后对各染色试剂的荧光图像进行比较。结果发现,与其他公司的细胞膜染色试剂相比,PlasMem Bright系列产品的染色时间更长,膜上的停留时间也更长。

实验例
实验例:通过悬浮细胞观察内吞作用对温度依赖性的变化
本实验使用ECGreen内吞检测试剂(产品代码:E296)和PlasMem Bright Red染色,对Jurkat细胞内吞时对温度的依赖性变化
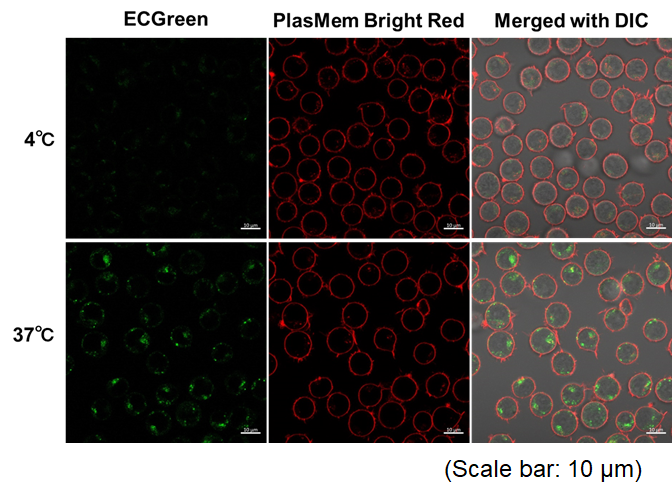
<检测条件>
内体检测(ECGreen, 绿色): Ex. 405 nm / Em. 500 – 560 nm
细胞膜检测 (PlasMem Bright Red,红色): Ex. 561 nm / Em. 560 – 700 nm
<实验步骤>
(1)在样品管中加入Jurkat细胞悬液(10%FBS,RPMI)并在4℃或37℃孵育30min。
(2) 使用步骤(1)配置的细胞悬浮液将ECGreen溶液稀释1000倍。
(3) 4℃或37℃孵育30min。
(4) 用HBSS清洗细胞两次。
(5) 加入含有PlasMem Bright Red(100倍稀释)的培养基,悬浮细胞。
(6) 将悬浮液转移到成像板上,并使用共聚焦显微镜观察细胞。
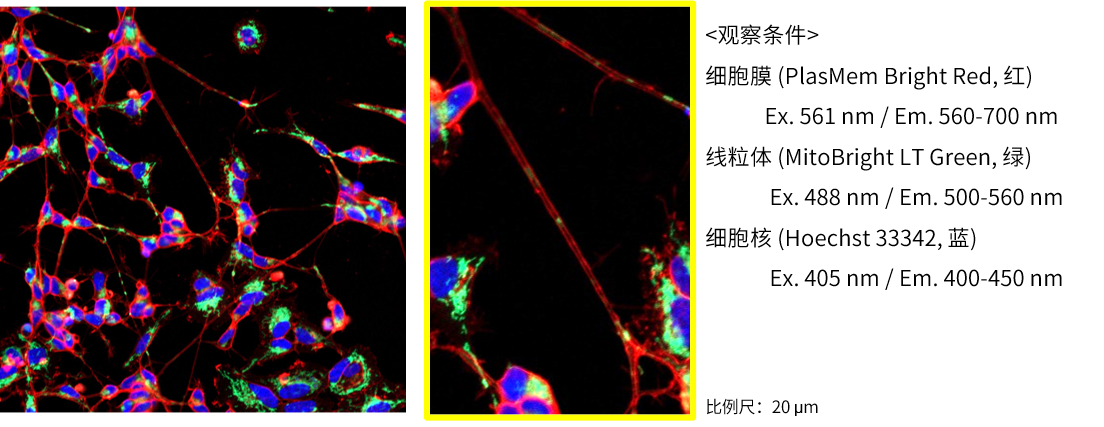
实验例:神经细胞的形态和轴突内线粒体局部观察
由神经母细胞瘤细胞SH-SY5Y分化诱导的神经细胞,分别用PlasMem Bright Red (红)、MitoBright LT Green (绿)、Hoechst 33342 (蓝) 进行染色。可以鲜明的观察到细胞的形状以及轴突内的线粒体。
实验例:观察巨噬细胞摄入外泌体
使用MagCapture™ Exosome Isolation Kit PS (Wako)提取人牙龈组织的间质干细胞(GMSC)产生的外泌体,并使用ExoSparkler Exosome Membrane Labeling Kit-Green (货号:EX01)进行染色。然后将其加入由人类外周血单核细胞(PBMC)分化的人类巨噬细胞中,用PlasMem Bright Red对巨噬细胞进行染色。
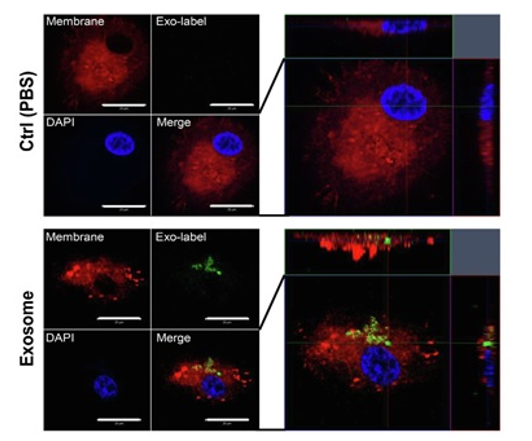
(数据由九州大学附属医院 口腔功能修复科 福田隆男老师友情提供)
<检测条件>
外泌体(Mem Dye – Green):Ex 488 nm / Em 490 – 540 nm
细胞膜(PlasMem Bright Red): Ex. 561 nm / Em. 560 – 700 nm
细胞核(DAPI):Ex. 345 nm / Em. 455 nm
<实验操作>
1. 将多聚赖氨酸包被载玻片(poly-L-lysine coated slides)放置在24 孔板中进行外周血单个核细胞(PBMC)的分化诱导(7 days)。
2. 根据ExoSparkler Exosome Membrane Labeling Kit-Green的操作说明书对10 µg的外泌体进行染色。
3. 将标记好的外泌体,按照1 µg/mL添加到24孔板中,培养3 h。
4. 用PBS清洗细胞1次。
5. 添加用培养基配置好的PlasMem Bright Red (1/100稀释),在CO2培养箱内静置15 min。
6. 用PBS清洗细胞3次。
7. 用4% PFA,室温下固定15 min。
8. 用PBS清洗细胞3次。
9. 用含DAPI的封片剂 (Invitrogen:ProLong™ Gold Antifade Mountant with DAPI)进行封片。
10. 激光共聚焦显微镜LSM 700 confocal microscope (Carl Zeiss) 观察。
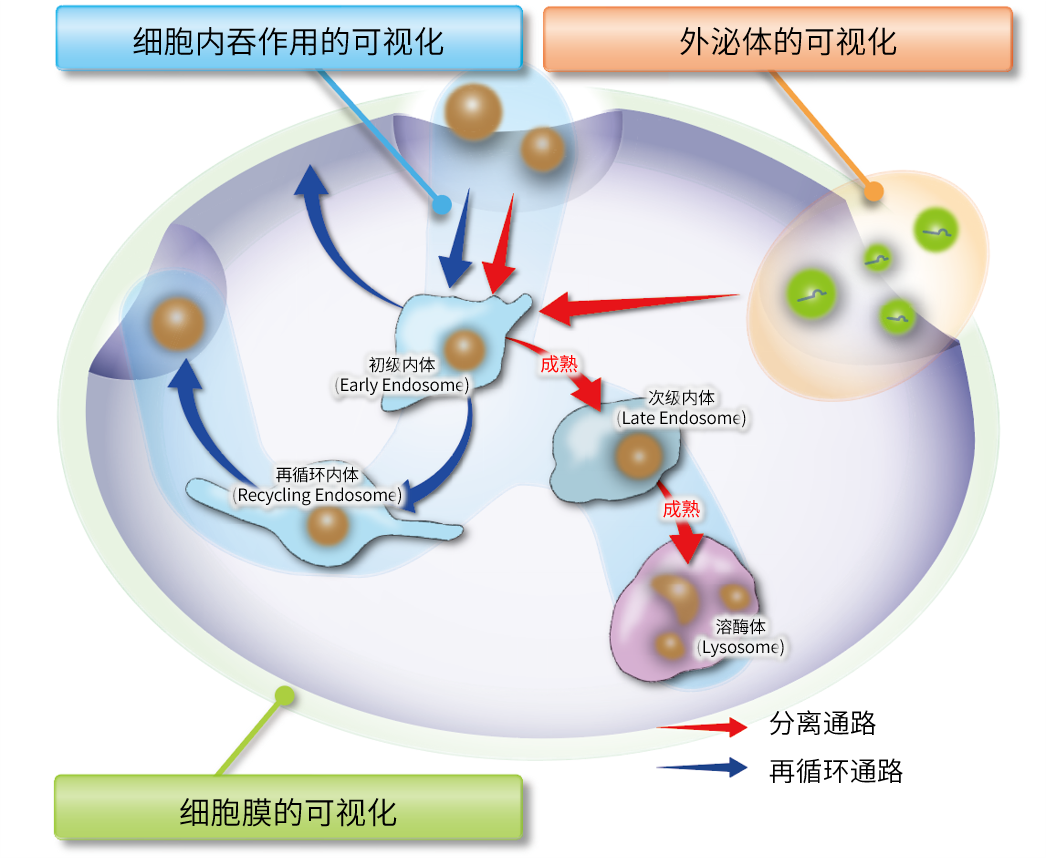
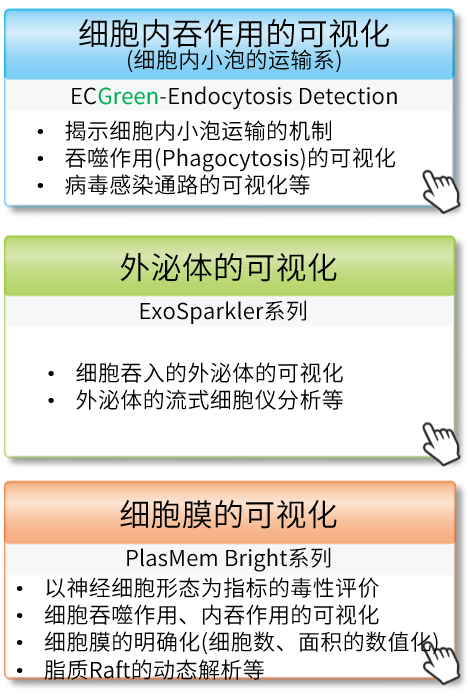
关联产品
常见问题Q&A
| Q1: 是否可以用固定化细胞? |
| A: 可以用4% 多聚甲醛(PFA)进行固定。
但是请注意不可以改变细胞膜的渗透性,否则会操造成没有荧光。 |
| Q2: 是否可以进行动态荧光成像? |
| A:可以。 但是请注意将激发光保持在最低水平并提高检测灵敏度。另外,长时间的激发光照射可能会对细胞造成伤害,也更容易使荧光染料分解,请考虑采用时间间隔等方法尽量避免。 |
| Q3: 在配制Working solution的时候是否可以用无血清培养基或Buffer进行稀释? |
| A: 可以。 |
| Q1: 染色后清洗细胞时建议使用什么? |
| A: 无血清培养基、PBS、HBSS等各种缓冲液均可以使用。 |
| Q4: 添加Working solution后,是否可以马上观察? |
| A:添加后马上观察也可以。操作手册上的步骤是加入试剂后培养5 min再观察。 |
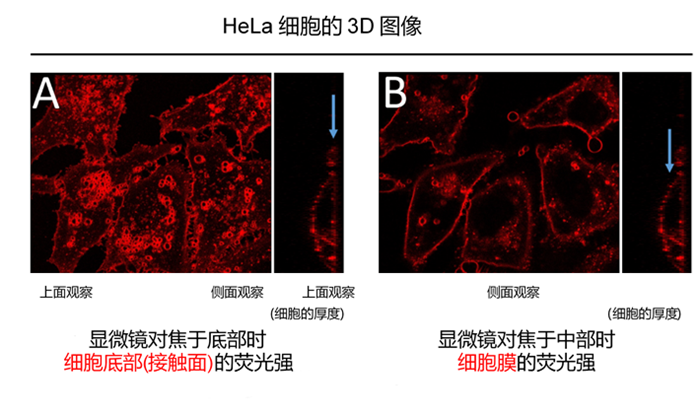
| Q5: 细胞膜以外的地方也有被染色的情况,请问是什么原因? |
| A: 感觉观察到细胞膜以外也被染色的情况,可能有如下两个原因
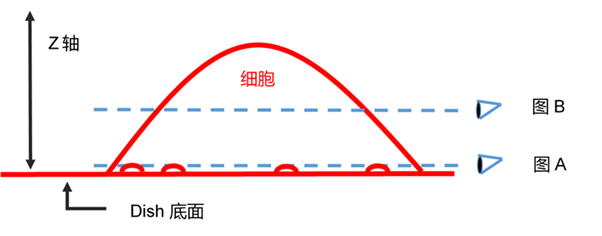
1) 细胞膜上的试剂,随着时间的推移,通过细胞内吞作用进入细胞内。 请参考本产品网页上“细胞膜上的停留时间”的部分,有染色后24 h的照片。 2)荧光成像时的焦点在底面(细胞底部的接触面)上,如下图A。 荧光成像时的焦点请尽量像下图B那样调整Z轴的高度。
|
关联产品



实验工具稀释计算器摩尔浓度计算器