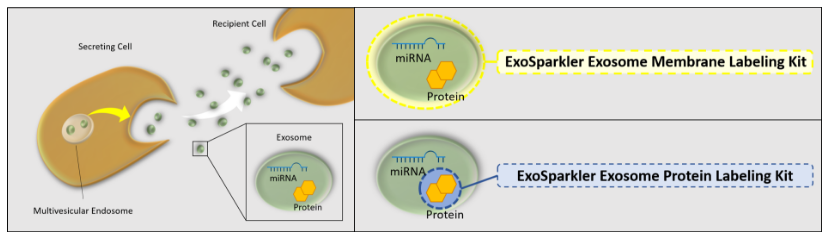
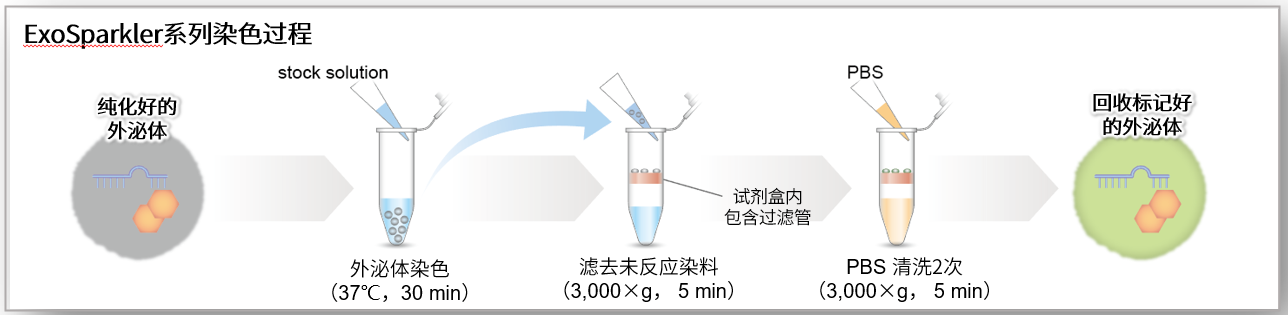
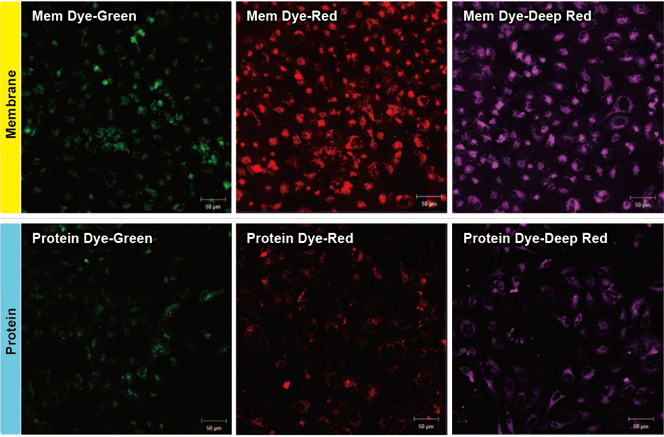
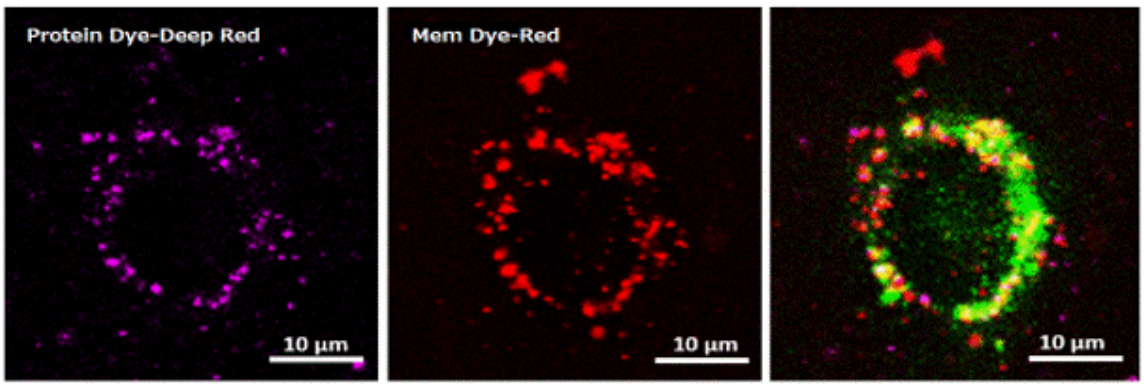
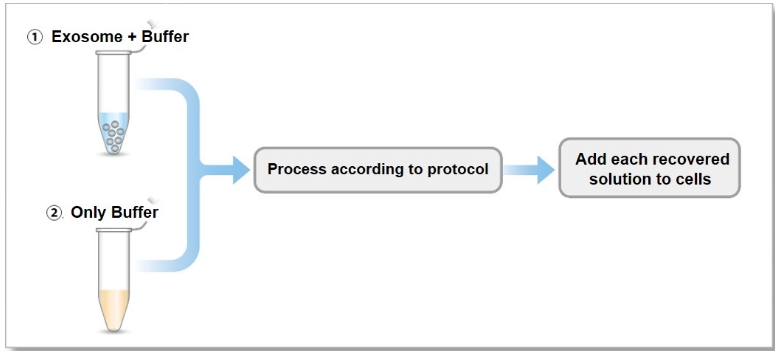
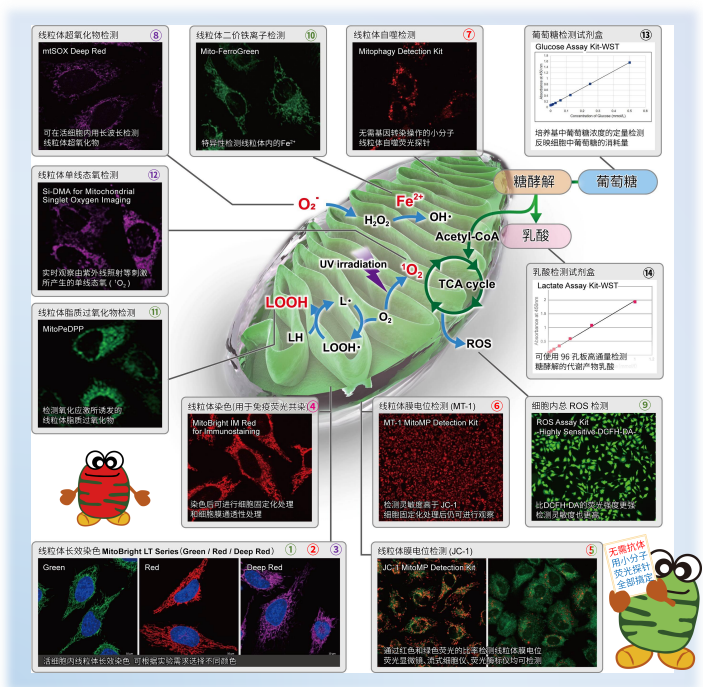
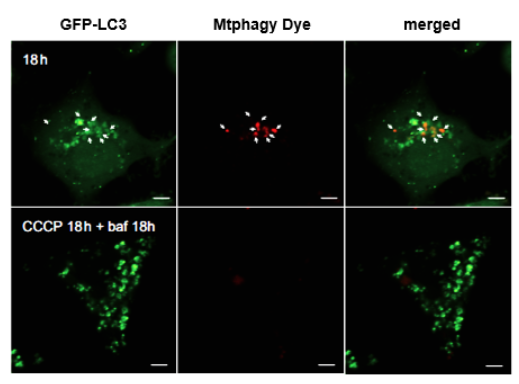
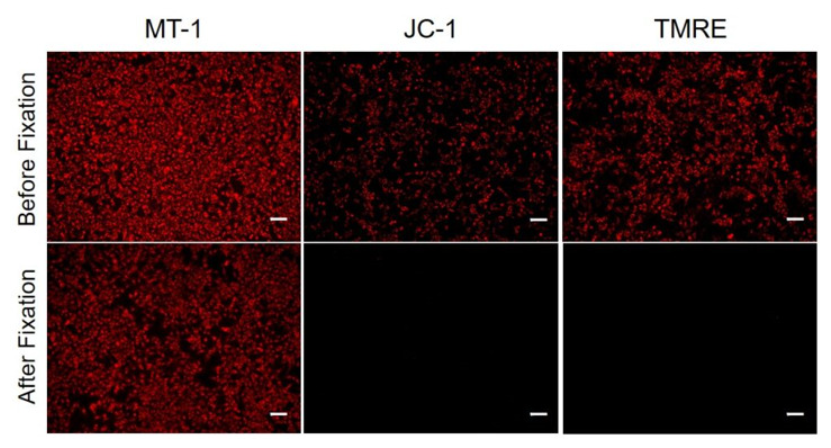
1. A novel photothermally controlled multifunctional scaffold for clinical treatment of osteosarcoma and tissue regeneration,
Materials Today, 2020, doi.org/10.1016/j.mattod.2019.12.005
2. Mitochondria-Targeted Artificial “Nano-RBCs” for Amplified Synergistic Cancer Phototherapy by a Single NIR Irradiation,
Advanced Science, 2018, 5, 1800049
3. 4D-Printed Biodegradable and Remotely Controllable Shape Memory Occlusion Devices,
Advanced Functional Materials, 2019, 29(51), 1906569
4. Magnetic Hyperthermia-Synergistic H2O2 Self-Sufficient Catalytic Suppression of Osteosarcoma with Enhanced Bone-Re
generation Bioactivity by 3D-Printing Composite, Advanced Functional Materials, 2019, 1907071
5. A Substitution-Dependent Light-Up Fluorescence Probe for Selectively Detecting Fe3+ Ions and Its Cell Imaging Application,
Advanced Functional Materials, 2018, 28(35), 1802833
6. An Extendable Star-Like Nanoplatform for Functional and Anatomical Imaging-Guided Photothermal Oncotherapy,
ACS Nano, 2019, 13(4), 4379-4391
7. Near-Infrared Light-Triggered Sulfur Dioxide Gas Therapy of Cancer, ACS Nano, 2019, 13(2), 2103-2113
8. Nanoenzyme-Augmented Cancer Sonodynamic Therapy by Catalytic Tumor Oxygenation,
ACS Nano, 2018, 12(4), 3780-3795
9. Terrylenediimide-Based Intrinsic Theranostic Nanomedicines with High Photothermal Conversion Efficiency for Photoacoustic
Imaging-Guided Cancer Therapy, ACS Nano, 2017, 11(4), 3797-3805
10. Two-Dimensional Graphene Augments Nanosonosensitized Sonocatalytic Tumor, ACS Nano, 2017, 11(9), 9467-9480
11. Multifunctional Bismuth Selenide Nanocomposites for Anti-Tumor Thermo-Chemotherapy and Imaging,
ACS Nano, 2016, 10(1), 984-97
12. Molecular Responses of Human Lung Epithelial Cells to the Toxicity of Copper Oxide Nanoparticles Inferred from Whole
Genome Expression Analysis, ACS Nano, 2011, 5(12), 9326–9338
13. Living functional hydrogels generated by bioorthogonal cross-linking reactions of azidemodified cells with alkyne-modified
polymers, Nature Communications, 2018, 9, 2195
14. A strongly adhesive hemostatic hydrogel for the repair of arterial and heart bleeds,
Nature Communications, 2019, 10(1), 2060
15. Magnetic-responsive and targeted cancer nanotheranostics by PA/MR bimodal imaging-guided photothermally triggered
immunotherapy, Biomaterials, 2019, 219, 119370
16. Oriented collagen fiber membranes formed through counter-rotating extrusion and their application in tendon regeneration,
Biomaterials, 2019, 207, 61-75
17. Triple-functional polyetheretherketone surface with enhanced bacteriostasis and anti-inflammatory and osseointegrative
properties for implant application, Biomaterials, 2019, 212, 98-114
18. Ultrasmall Cu2-xS nanodots as photothermal-enhanced Fenton nanocatalysts for synergistic tumor therapy at NIR-II
biowindow, Biomaterials, 2019, 206, 101-114
19. Theranostic 2D ultrathin MnO2 nanosheets with fast responsibility to endogenous tumor microenvironment and exogenous
NIR irradiation, Biomaterials, 2018, 155, 54-63
20. Cooption of heat shock regulatory system for anhydrobiosis in the sleeping chironomid Polypedilum vanderplanki,
Proc. Natl. Acad. Sci., 2018, 115(10), E2477-E2486
21. Wnt Inhibitor Dickkopf-1 as a Target for Passive Cancer Immunotherapy,
Cancer Research, 2010, 70(13), 5326-36
22. Gadolinium polytungstate nanoclusters: a new theranostic with ultrasmall size and versatile properties for dual-modal MR/CT
imaging and photothermal therapy/radiotherapy of cancer, NPG Asia Material, 2016, 8, e273
23. 2D Superparamagnetic Tantalum Carbide Composite MXenes for Efficient Breast-Cancer Theranostics,
Theranostics, 2018, 8(6), 1648-1664
24. Connexin43 Hemichannels Contribute to Cadmium-Induced Oxidative Stress and Cell Injury,
Antioxidants & Redox Signaling, 2011, 14(12), 2427-39
25. Synthesis and characterization of hierarchically macroporous and mesoporous CaO-MO-SiO2-P2O5(M=Mg,Zn,Sr) bioactive
glass scaffolds, Acta Biomaterialia, 2011, 7(10), 3638-3644