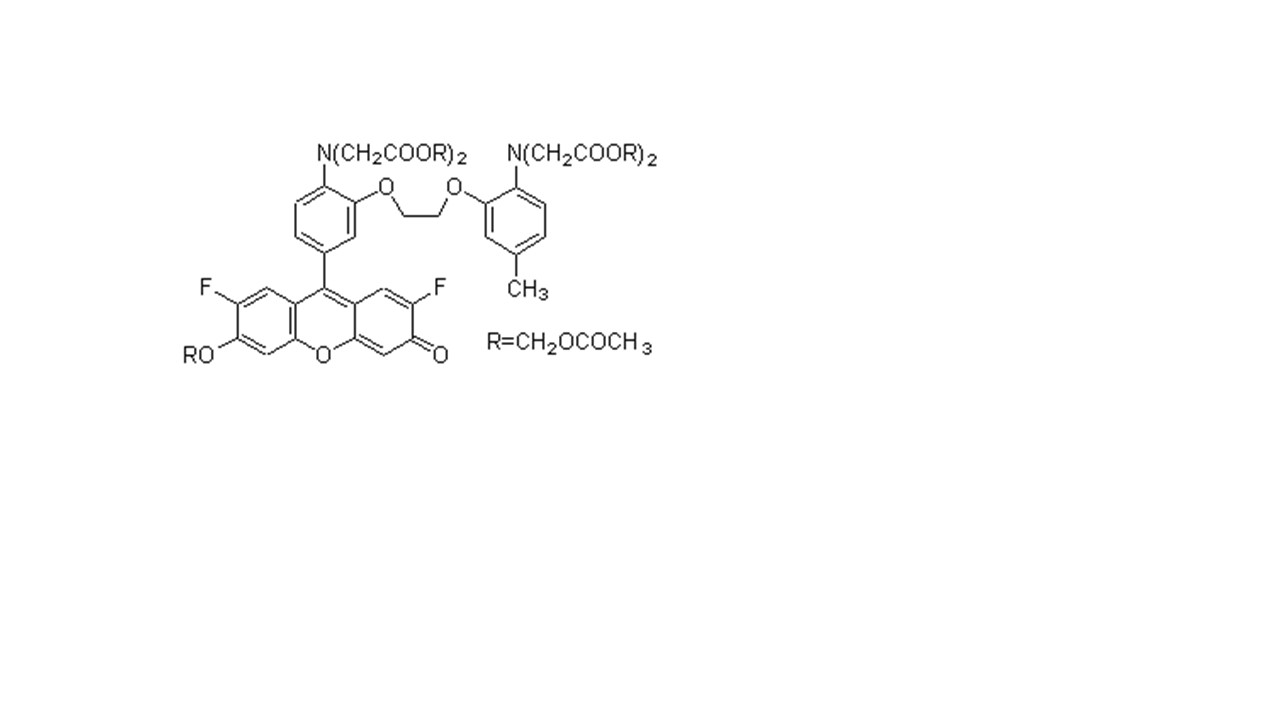
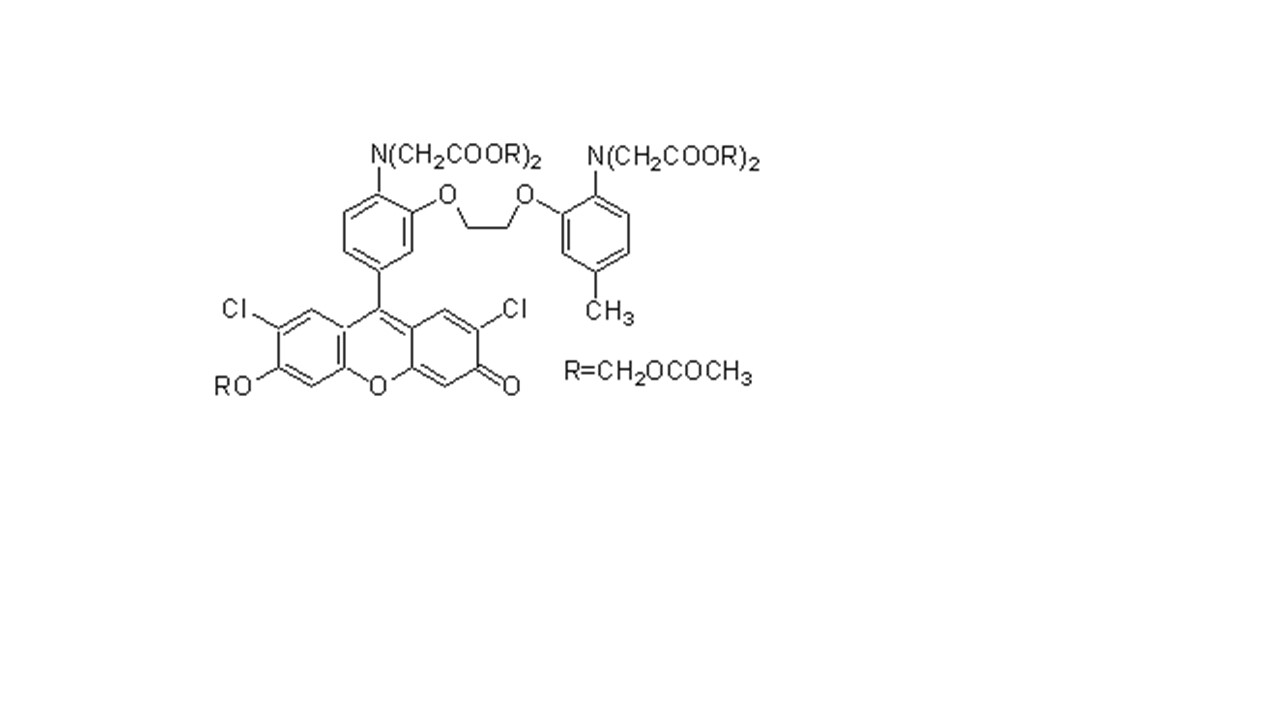
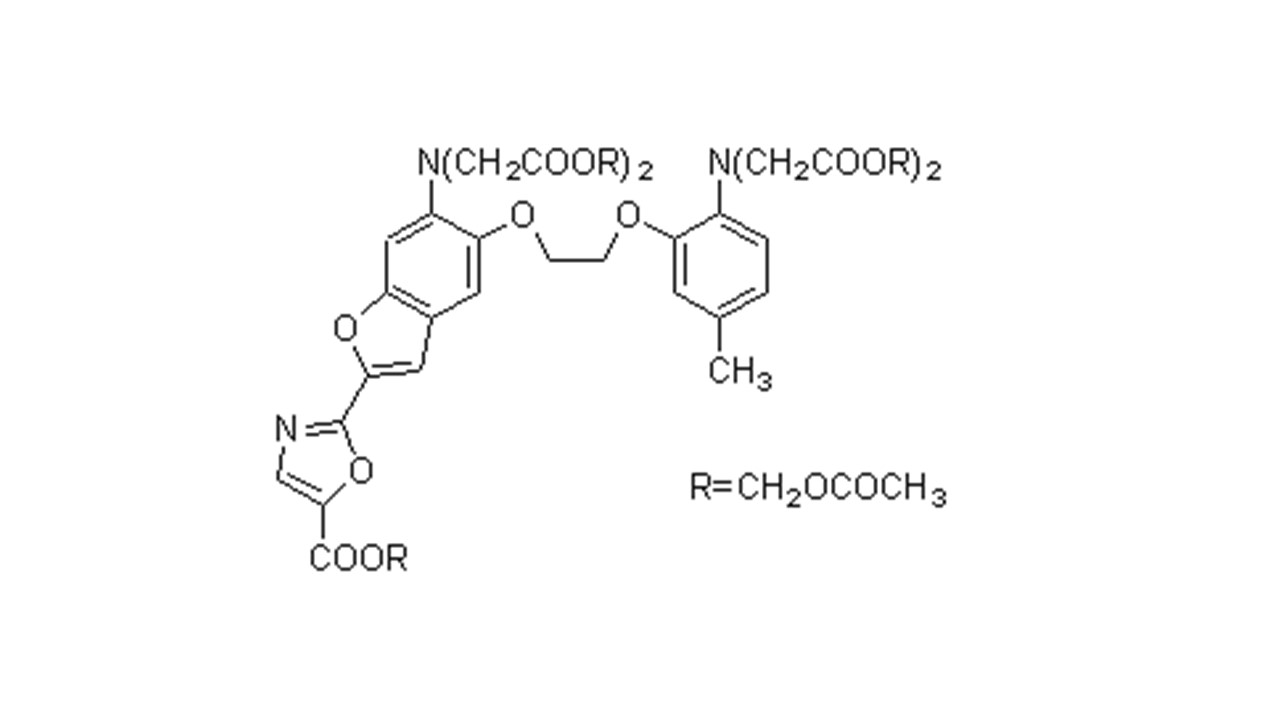
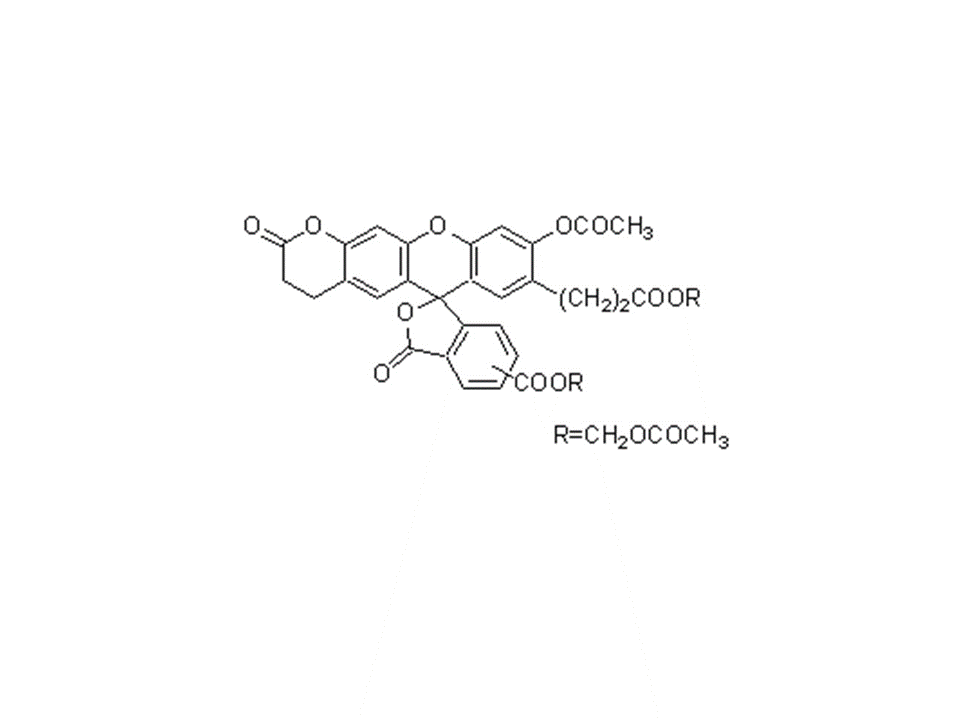
C52H59ClN4O19
1079.49
特点:
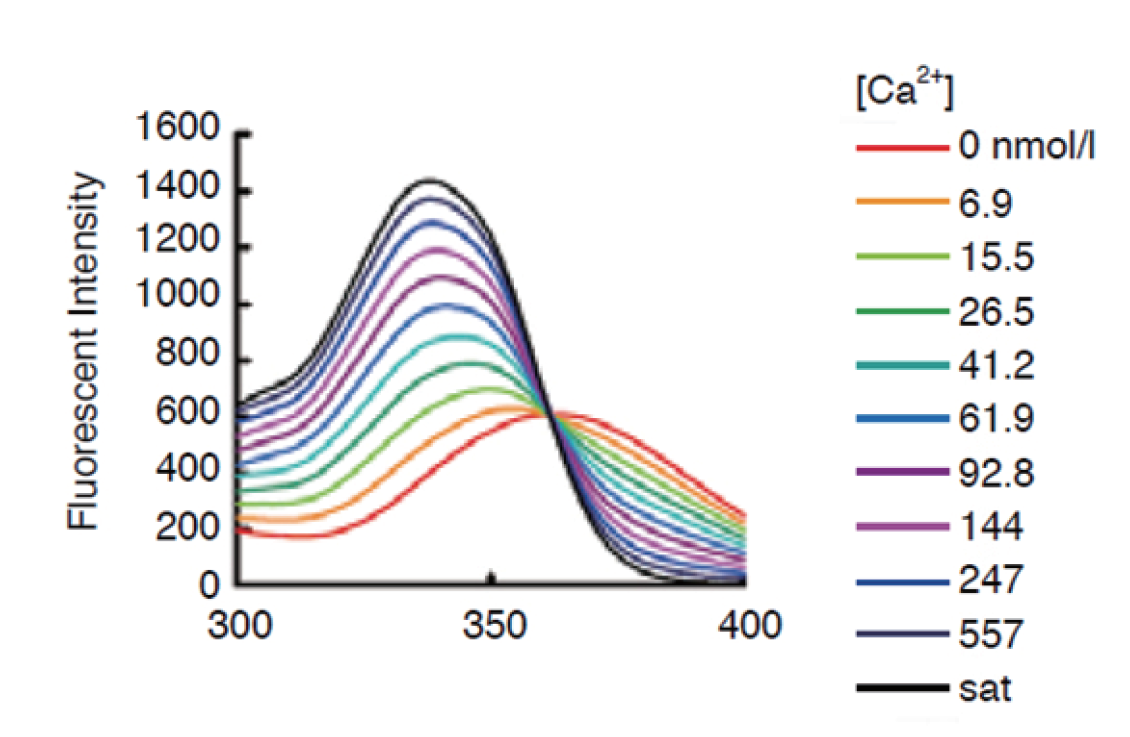
● 激发光557nm,发射光581nm
● 红色荧光与罗丹明相似
● 定位准确,信号强度高


产品性状
规格
性状 : 本产品为暗紫色固体,使用时将固体溶解于无水DMSO中
纯度(HPLC): 98%以上
荧光光谱图 : 符合实验要求
NMR光谱图 : 符合实验要求
处理条件
保存方法 : 避光冷冻
产品概述
在所有的钙离子指示剂中,Rhod 2荧光信号的波长最长。它具有和罗丹明类似的激发和发射波长,分别为557 nm和581 nm。这样的激发波长使得我们很容易就能找到氩和氪光源的激光。尽管有人认为Rhod 2的荧光信号仅仅将钙复合物的荧光增加了数倍,但是Dojindo的Rhod 2由于具有很高的纯度,能有效地将钙荧光信号增加80-100倍左右,使得它的信号强度在所有的钙离子探针里面是最强的。所以,我们强烈建议使用Rhod 2作为探针用激光显微镜来检测细胞内的钙离子情况。有报道称,特别是在神经组织切片培养方面Rhod 2具有定位点的轮廓线更加清晰的特点。Rhod 2和钙离子的解离常数为(Kd=1.0 mM),在所有的钙离子荧光探针中是最高的,为监测钙离子浓度提供了一个广阔的范围。Rhod 2-AM是一种Rhod 2的乙酰甲酯衍生物,能非常容易的通过AM法负载到细胞内。
原理
与其他探针一样,Rhod 2-AM是将四个羧基全部作为脂溶性乙基甲酯体的细胞膜透明性物质。可以很容易地被细胞吸收。通过细胞内的脂肪酶水解成为Rhod 2,可以检测细胞内Ca2+。
激发发射波长
E x :557 nm
Em: 581 nm
溶解比例
溶解比例:1mg/ml(DMSO),50mg/ml(三氯甲烷)
注意事项
1、试剂容易吸潮,从冰箱取出后,请确认在干燥的环境放至室温后再开封。由于试剂极其微量,
开封前,请轻弹管壁几次,以保证粉末落入管底。
2、第一次使用时, 建议母液即配即用。试剂溶解后尽可能在短时间内使用,以保证实验效果。
3、溶解液 DMSO 需要保证新鲜无水,否则将会导致 AM 体水解,荧光染料无法进入细胞影响实验效果。
4、母液遇水极易分解,如果不能一次用完,建议分装保存,例如分装成 5 μl/管,用封口膜封口,
并用铝箔纸包裹,放在一个密闭性能好的塑料袋中,并放入一包干燥剂,在≤-20℃密封避光保存。
5、建议您在正式实验前先摸索一下细胞量、钙离子荧光探针的终浓度、培养时间等,找到最佳实验条件
参考文献
1) R. Y. Tsien, “New Calcium Indicators and Buffers with High Selectivity against Magnesium and Protons: Design, Synthesis, and Properties of Prototype Structures”, Biochemistry, 1980, 19 (11), 2396.
2) R. Y. Tsien, T. Pozzan and T. J. Rink, “Calcium Homeostasis in Intact Lymphocytes: Cytoplasmic Free Calcium Monitored with a New, Intracellularly Trapped Fluorescent Indicator”, J. Cell Biol., 1982, 94, 325.
3) M. B. Feinstein, J. J. Egan, R. I. Sha’afi and J. White, “The Cytoplasmic Concentration of Free Calcium Inplatelets Is Controlled by Stimulators of Cyclic AMP Production (PGD2, PGE1, FORSKOLIN)”, Biochem. Biophys. Res. Commun., 1983, 113, 598.
4) N. Miyoshi, K. Hara, S. Kimura, K. Nakanishi and M. Fukuda, “A New Method of Determining Intracellular Free Ca2+ Concentration Using Quin 2-fluorescence”, Photochem. Photobiol., 1991, 53 (3), 415.
5)Hao Gu, Yuhui Zhu, Jiawei Yang, Ruixue Jiang, Yuwei Deng, Anshuo Li, Yingjing Fang, Qianju Wu, Honghuan Tu, Haishuang Chang, Jin Wen, Xinquan Jiang,”Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration.Advanced Science”,2023, Advanced Science, doi:10.1002/advs.202302136
Q&A
|
Q1: 细胞内检测钙离子的试剂种类都有什么,选择什么样的比较好呢? |
|
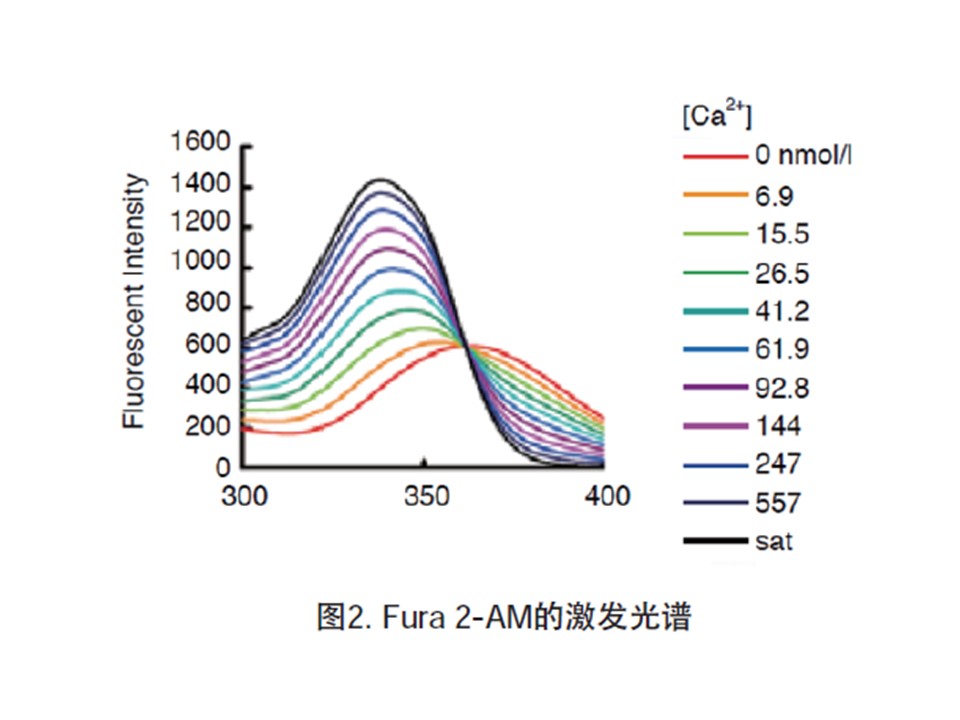
A1: 根据检测仪器和检测波长有很多的选择,产品后面标有AM的试剂是可以通过细胞膜的 有很多种相似的试剂,其特点如下: 【Fura 2】 •双波长激发 激发(λex= Ca:340 nm, Ca free:380 nm)、发射:λem=500 nm •解离常数:224 nmol/L •因为是荧光强度的比值、可以有效的减小误差 =>細胞内Ca浓度计算。 •该试剂被使用的最多 •必须要更换过滤片、会耽误一些时间。 【Fluo 3】 •单波长激发 激发:λex=508 nm、发射:λem=527 nm •解离常数:400 nmol/L •因为激发光在长波段,所以对细胞的损伤比较小 (不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •不适合切片中钙离子的检测 •【Fluo 4】 •单波长激发 •激发:λex=495 nm、发射:λem=518 nm •解离常数:360 nmol/L •与Fluo3相比对荧光强度更高。 •因为激发光在长波段,所以对细胞的损伤比较小 •(不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •与Fluo3相比对細胞的毒性低 •【Indo 1】 •单波长激发 •激发:λex= 330 nm、发射(λem= Ca:410 nm, Ca free:485 nm) •解离常数:250 nmol/L •由于不需要更换滤光片,可以很快地检测细胞内钙离子浓度变化以及像心肌细胞运动中钙离子的变化 •(需要两台检测仪器) •【Rhod 2】 •单波长激发 •激发:λex=553 nm、发射:λem=576 nm •解离常数:1.0 μmol/L •因为激发光在长波段,所以对细胞的损伤比较小 •(不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •【Quin 2】 •单波长激发 •激发:λex=339 nm、发射:λem=492 nm •解离常数:110 nmol/L •最早开发的产品 |