
试剂盒内含

产品概述
水溶性活性酯型生物素化试剂:使用生物素(AC5)2Sulfo-OSu用于生物素标记蛋白质游离氨基的试剂盒。它带有用于标记的LVDS3缓冲粉,用于凝胶过滤的柱和用于柱洗脱的PBS片剂,可以纯化标记的蛋白。由于是单次注射型(10毫克x4瓶),因此可以标记4种不同类型的蛋白质。可以通过改变添加的生物素-(AC5)2 Sulfo-OSu的量来控制标记率。
*标记蛋白的量为1-5 mg。
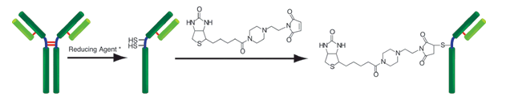
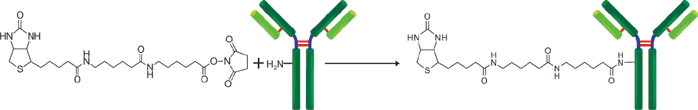
原理
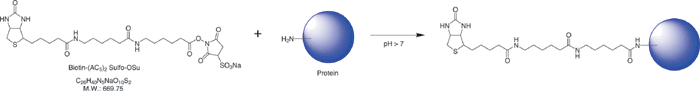
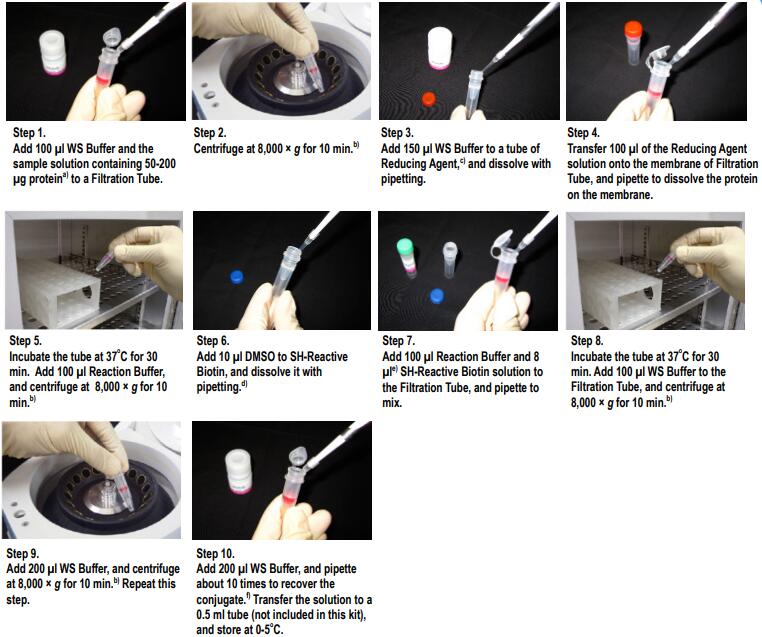
操作步骤
使用注意事项:
1. 本试剂盒请在0-5 ℃储存。
2. Biotin-(AC5)2Sulfo-OSu溶液需要现配现用 (由于Biotin-(AC5)2Sulfo-OSu易水解,尽量避免在水溶液的状态保存)。
3. 标记好的蛋白质请在0-5 ℃保存 (加入0.1%的叠氮钠等防腐剂)。
使用步骤:
1. 配制溶液
1) NaHCO3缓冲液
在含有NaHCO3粉末的容器中加入10ml超纯水溶解。
2) PBS缓冲液
在100ml容量瓶中加入1片PBS,先用少量超纯水溶解后,再用超纯水补充至100ml,制成10mmol/l的PBS缓冲液。
3) 蛋白质溶液
在样品管中精确称量1.0-5.0mg蛋白质并记录称量值后,用移液器加入500μl操作步骤1)中的NaHCO3缓冲液。盖上盖子后,用漩涡振荡器等搅拌溶解蛋白质。
4) Biotin-(AC5)2Sulfo-OSu溶液
在1支含有Biotin-(AC5)2Sulfo-OSu的管子中加入适量纯水溶解。为了控制标记率,根据不同的标记对象,请参考表1调整Biotin-(AC5)2Sulfo-OSu溶液的浓度及加入量。
*由于Biotin-(AC5)2Sulfo-OSu易水解,溶解后请尽快标记。
2. 生物素标记操作方法
1) 请参考表1在配制好的蛋白质溶液中加入合适浓度和用量的Biotin-(AC5)2Sulfo-OSu溶液。
2) 盖紧盖子充分混合后,在25 ℃水浴恒温摇床中培养2h。
表1 Biotin-(AC5)2Sulfo-OSu标记各种蛋白质的标记率
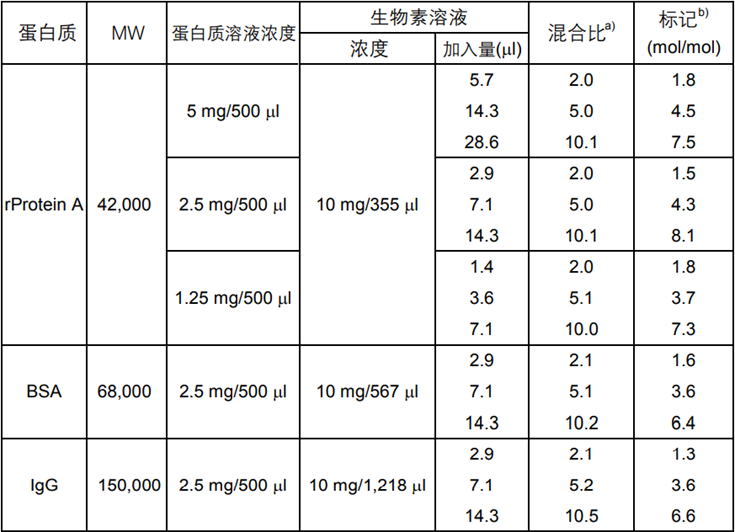
以上数据为本公司实际检测的结果,如实验条件变动,
结果有可能改变。标记率是根据HABA法测得。
a) 1mol蛋白质:生物素的摩尔数
b) 1mol蛋白质上所结合的生物素的摩尔数
3. 蛋白质标记后的凝胶过滤纯化
1) 打开层析柱上的盖子,弃去填充液。
2) 打开层析柱出口的盖子,用PBS分数次洗脱,每根层析柱收集大约10ml的洗脱液,使凝胶平衡。
3) 用移液器吸取500μl标记好的蛋白质溶液加入到层析柱中,弃去此时的流出液。
4) 在层析柱的出口处放置一个2ml的样品管,在层析柱中加入1ml PBS,收集流出的生物素标记蛋白质。
*经过层析,生物素标记蛋白质的最终浓度为标记时的1/2。
按照下列公式计算生物素标记蛋白质的最终浓度:
A (mol/l) = (X/MWprotein) × (1,000/Y) × 0.5
X:蛋白质的重量
MWprotein:蛋白质的分子量
Y:溶解蛋白质的NaHCO3缓冲液体积
常见问题Q&A
| Q1:如何存储标记的蛋白质? |
| A:将标记的蛋白质存放在冰箱中。另外,添加0.1%叠氮化钠作为防腐剂。 |
| Q2:生物素标记试剂在水溶液中稳定吗? |
| A:试剂盒中使用的生物素-(AC5)2 Slufo-OSu处于水溶液中时,由于它会水解,因此无法存储在水溶液中。使用前请做好准备。另外,即使在粉末状态下,也要注意由于吸湿引起的劣化。 |
参考文献
| 1) J. Wormmeester, F. Stiekema and C. Groot, “Immunoselective Cell Separation”, Methods Enzymol., 1990, 184, 314. |
| 2) J. J. Leary and D. J. Ward, “Rapid and Sensitive Colorimetric Method for Visualizing Biotin-labeled DNA Probes Hybridized to DNA or RNA Immoilized on Nitrocelulose: Bio-blots”, Proc. Natl. Acad. Sci. USA, 1983, 80, 4045. |
| 3) W. T. Lee and D. H. Conrad, “The Murine Lymphocyte Receptor for IgE II. Characterization of the Multvalent Nature of the B Lymphocyte Receptor for IgE”, J. Exp. Med., 1984, 159, 1790. |
| 4) D. R. Gretch, M. Suter and M. F. Stinski, “The Use of Biotinylated Monoclonal Antibodies and Streptavidin Affinity Chromatography to Isolate Herpesvirus Hydorophobic Proteins or Glycoproteins”, Anal. Biochem., 1987, 163, 270. |
| 5) M. Shimkus, J. Levy and T. Herman, “A Chemically Cleavable Biotinylated Nucleotide: Usefulness in the Recovery of Protein-DNA Complexes from Avidin Affinity Columns”, Proc. Natl. Acad. Sci. USA, 1985, 82, 2593. |
| 6) W. J. LaRochelle and S. C. Froehner, “Immunodhemical Detection of Proteins Biotinylated on Nitrocellulose Replicas”, J. Immunol. Methods, 1986, 92, 65. |
| 7) P. S. Anjaneyulu and J. V. Staros,”Reactions of N-hydroxysulfosuccinimide Active Esters”, Int. J. Pept. Protein Res., 1987, 30, 117. |
| 8) H. M. Ingalls, C. M. Goodloe-Holland and E. J. Luna,”Junctional Plasma Membrane Domains Isolated from Aggregating Dictyostelium Discoideum Amebae”, Proc. Natl. Acad. Sci. USA, 1986, 83, 4779. |
| 9) J. Guesdon, T. Ternyck and S. Avrameas,”The Use of Avidin-Biotin Interaction in Immunoenzymatic Techniques”, J. Histochem. Cytochem., 1979, 27, 1131. |