特点:
● 灵敏度高,操作简便
● 操作简单三步即可完成实验
● 无需清洗细胞

产品解说
试剂盒内含

产品概述
该试剂盒使用Fatty Acid Uptake Probe作为脂肪酸类似物,通过位于细胞膜表面的脂肪酸转运蛋白进入细胞,可以通过荧光显微镜、流式细胞仪和荧光酶标仪等荧光测量方法检测细胞的摄取能力。此外,该试剂盒配备了Quenching Buffer,可消除未进入细胞的Fatty Acid Uptake Probe的荧光,因此无需清洗细胞也可以检测。
检测产品优势
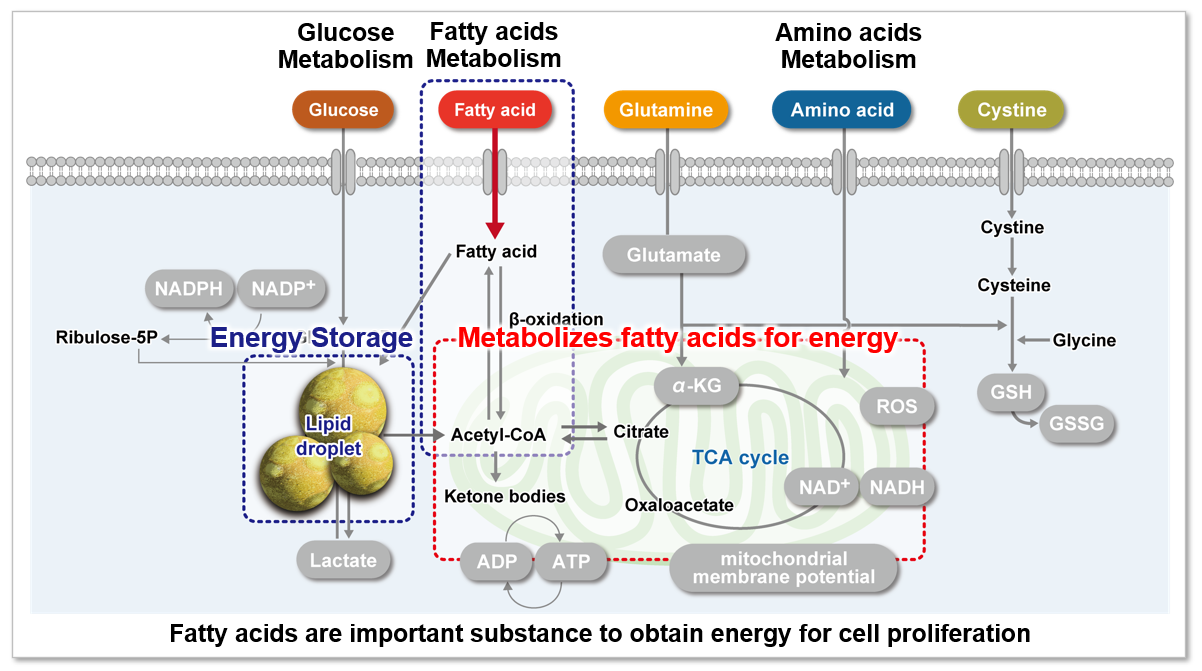
为什么脂肪酸摄取能力越来越受到关注?
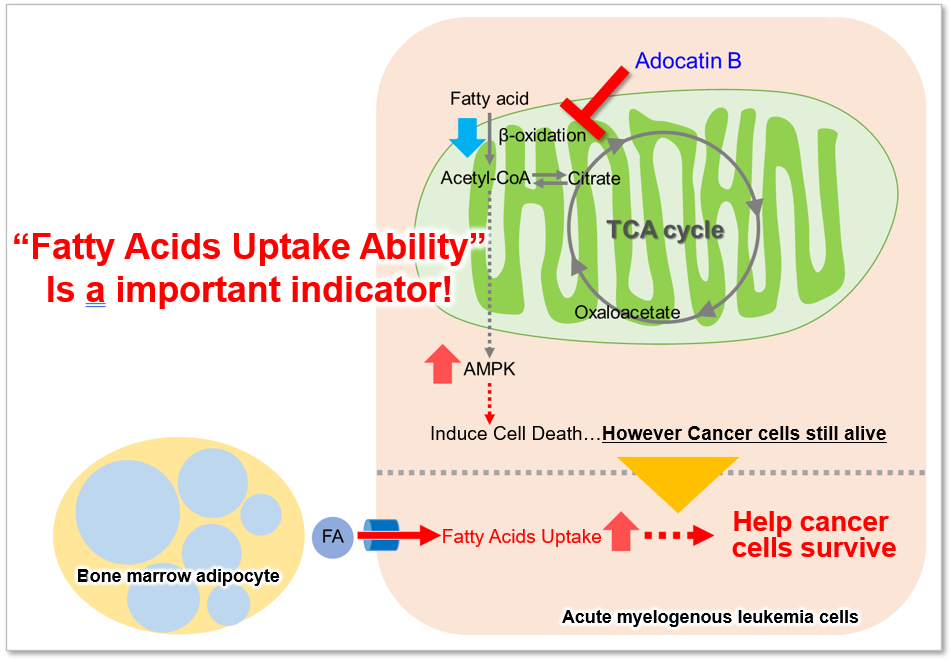
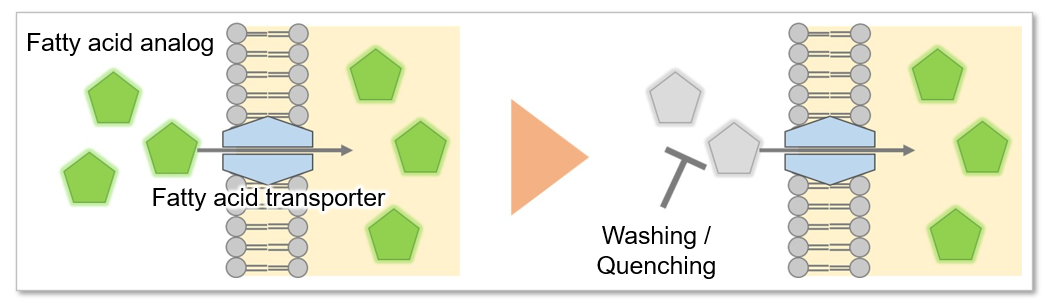
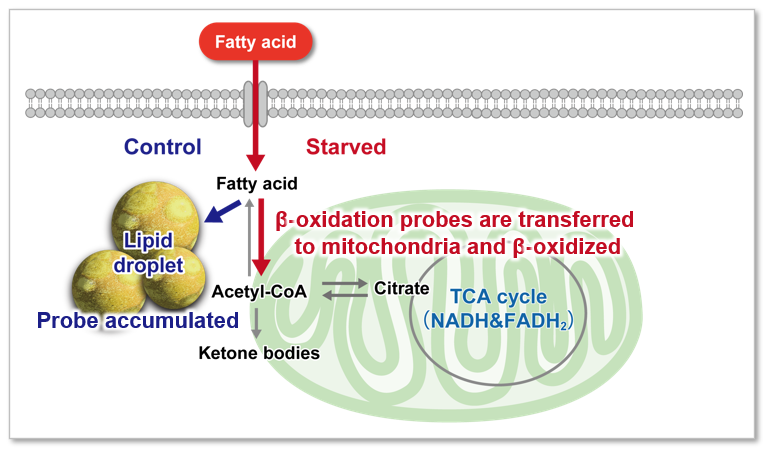
脂肪酸是为生物体供应能量的重要物质。脂肪酸摄取能力不仅与肥胖和糖尿病等疾病有关,也是癌细胞的代谢指标之一(左下图)。细胞增殖活跃的癌细胞往往需要很多脂质,所以细胞内的脂肪酸合成和细胞外的脂肪酸摄取很活跃(右下图)。因此,以癌细胞的脂肪酸代谢途径为目标,开发了很多药物。
用单个试剂盒即可解决整个脂肪酸摄取实验!
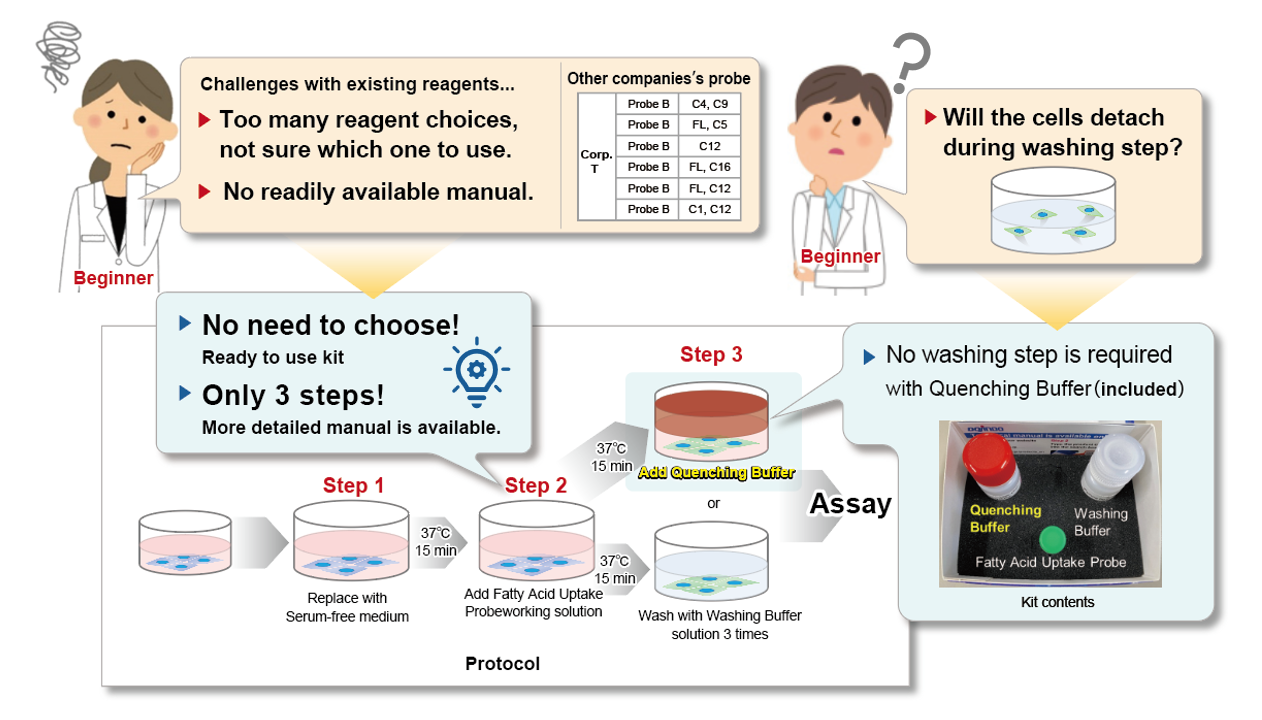
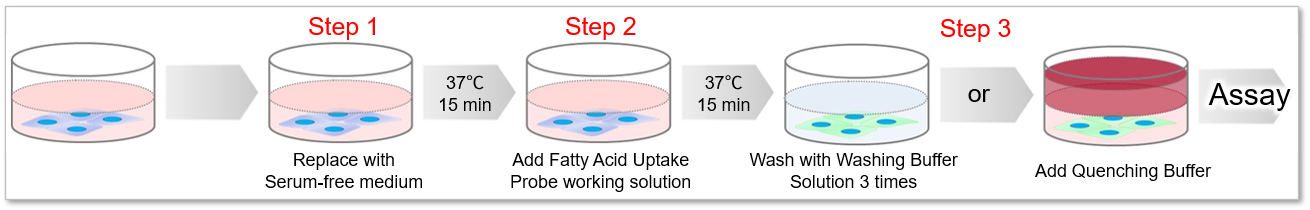
本试剂盒所内含的脂肪酸类似物通过脂肪酸转运体被转运至细胞内,再通过荧光探针(荧光法)检测该类似物的摄入量【检测原理】。Quenching buffer可以省去清洗操作的麻烦和时间成本,进行检测【操作步骤】。
检测原理
操作步骤
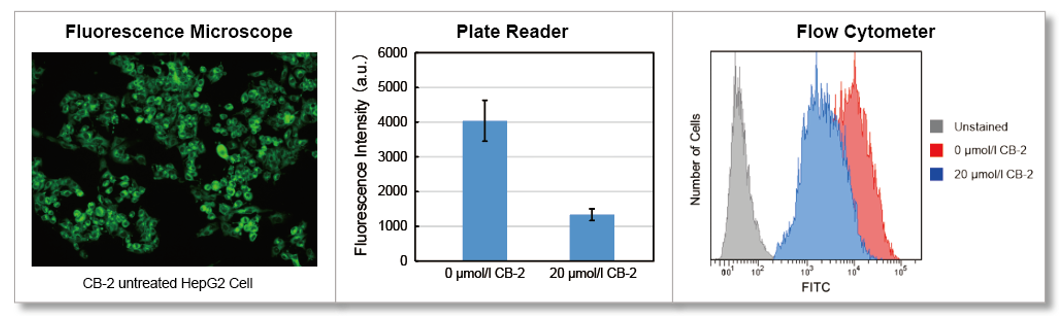
检测仪器
HepG2细胞通过添加脂肪酸转运蛋白抑制剂CB-2,在不同仪器中检测其脂肪酸摄取能力的变化。
选择指南
Washing Buffer或Quenching Buffer的选择指南
请参考下表,根据细胞种类和实验系统(操作和测量装置)选择Washing Buffer或Quenching Buffer。
〇:可测量、×:不可测量、△:参考注释
| Washing Buffer (10×) | Quenching Buffer | ||||
| 贴壁细胞 | 悬浮细胞 | 贴壁细胞 | 悬浮细胞 | ||
| 清洗操作 | 必要 | 不需要 | |||
| 荧光酶标仪 | 底部读数(透明底) | 〇 | 〇 | △※1 | |
| 顶部读数 | 〇 | × | |||
| 荧光显微镜 | 〇 | 〇 | |||
| 激光共聚焦显微镜 | 〇 | △※2 | |||
| 流式细胞仪 | 〇 | × | |||
※1接种的细胞需要覆盖板底(大约:3x105cells/well),使之静置一段时间,从而可检测在板底的贴壁细胞。
※2使用激光共聚焦显微镜时,请将Quenching Buffer用Washing Buffer稀释10倍后使用,如果不能使用ex:488nm,请使用ex:640nm进行检测。
实验例
确认细胞中脂肪酸代谢状态
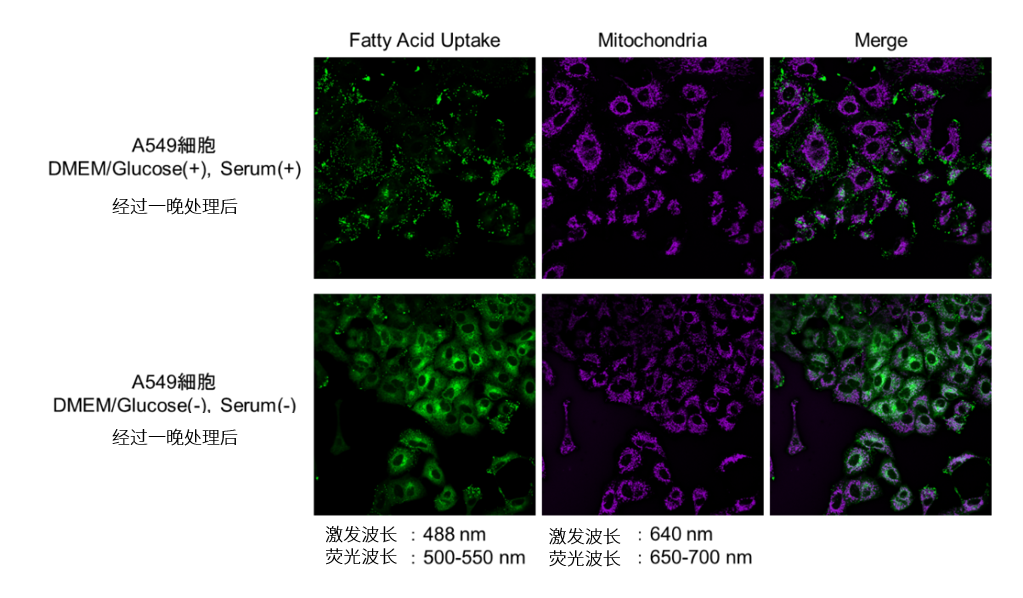
在A549细胞中添加不含葡萄糖或含有25mmol/l葡萄糖的DMEM培养基,制备了正常状态(control)和饥饿状态(Starved)的两组细胞。使用本试剂盒对两组细胞进行染色,并使用荧光显微镜观察。
结果显示,在对照组细胞中,荧光素大多聚集在脂肪滴中,而在饥饿状态的细胞中荧光素主要集中在线粒体和内质网上。由此可看出在饥饿状态下的细胞脂肪酸代谢的变化。
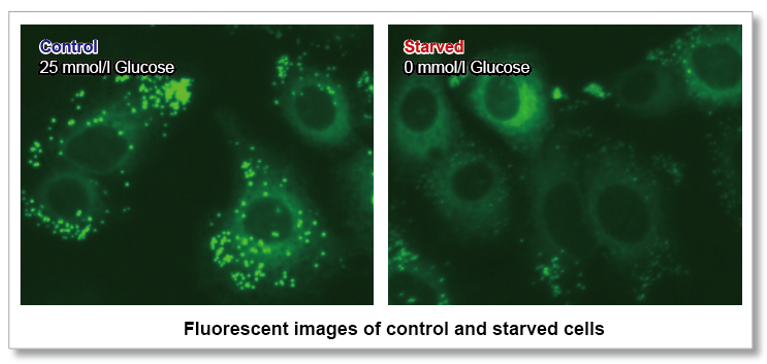
对照组细胞和饥饿组细胞的荧光图
*供参考的可检测数:35 mm dish 10块、 96孔板 1 块
产品Q&A
| Q: 可用于哪些种类的细胞 |
| A:在下述细胞中有使用实例。 |
| 细胞 | 由来 |
| A549 | 人肺泡基底上皮腺癌细胞 |
| HepG2 | 人肝癌细胞 |
| HeLa | 人宫颈癌细胞 |
| Jurkat | 人白血病T细胞 |
| MOLT-4 | 人急性淋巴白血病细胞 |
| 3T3-L1 (preadipocyte) | 前脂肪細胞 |
| 3T3-L1 (adipocyte) | 脂肪細胞 |
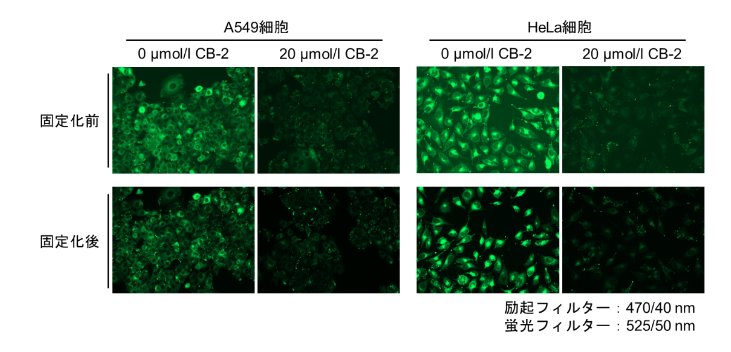
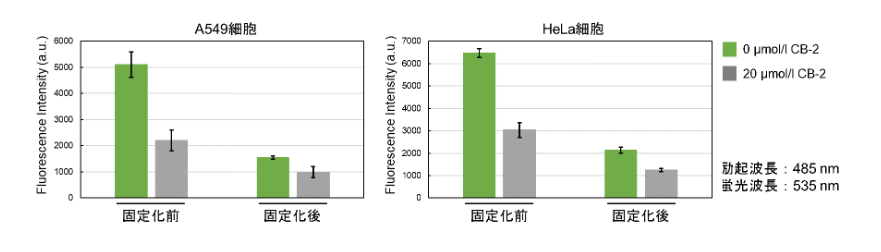
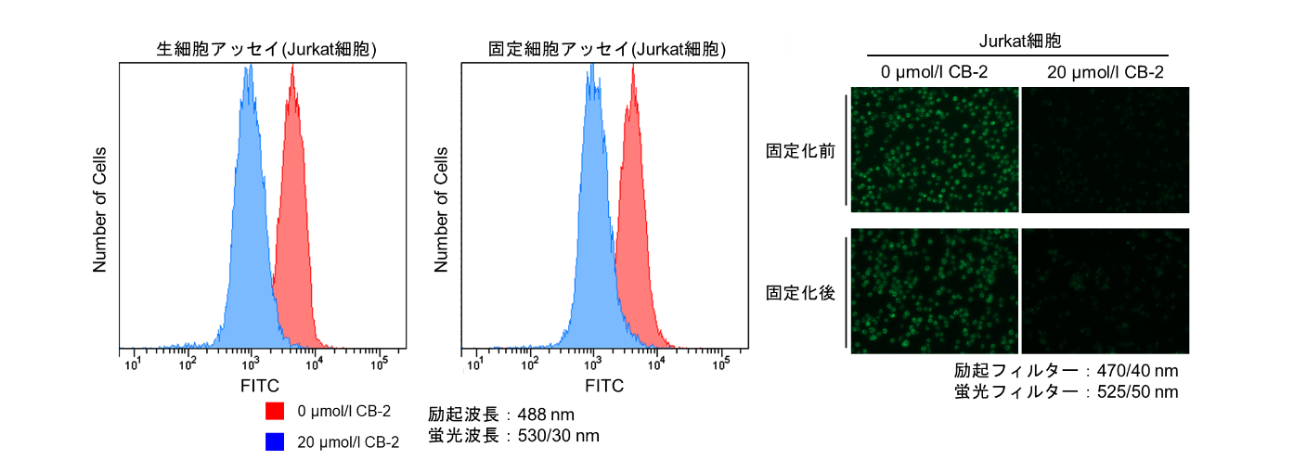
| Q: 将Fatty Acid Uptake Probe孵育进活细胞后,可以固定细胞吗? |
| A:<实验例>使用4%PFA固定染色后的细胞实验案例
Protocol:贴壁细胞 1. 将制备好的细胞接种在培养皿或96孔板上; 2. 用无血清培养基洗涤两次; 3. 加入无血清培养基,在培养箱(37℃,5%CO2存在下)中静置孵育15 min; 4. 去除上清液,添加Fatty Acid Uptake Probe working solution,在培养箱(37℃、5%CO2存在下)中静置15 min; 5. 去除上清液,用Washing Buffer solution清洗1次; 6. 向细胞中加入4%PFA/PBS并在室温下孵育5 min; 7. 用PBS洗涤细胞3次,用荧光显微镜检测,荧光酶标仪检测。
※固定会降低荧光强度 悬浮细胞 1. 取细胞样品至微管中; 2. 300×g离心5min,去除上清液; 3. 加入无血清培养基,300×g离心5min,去除上清液,重复两次; 4. 加入无血清培养基,混匀细胞,在培养箱(37℃,5%CO2)中静置15 min; 5. 300×g离心5 min,去除上清液; 6. 加入Fatty Acid Uptake Probe working solution,混匀细胞,在培养箱(37℃,5%CO2)中静置15 min ; 7. 300×g离心5min,去除上清液; 8. 用Washing Buffer solution清洗一次; 9. 加入4%PFA/PBS,混匀细胞,在室温下孵育5 min; 10. 300×g离心5 min,去除上清液; 11. 加入PBS,混匀细胞,300×g离心5 min,去除上清液;重复两次。 12. 用荧光显微镜或流式细胞仪检测。
|
| Q: 用荧光酶标仪检测时,应该用哪种板子? |
| A: 检测荧光,请使用细胞培养用的黑色孔板。 |
〇:可使用、×:不可使用、△:参考注释
| 贴壁细胞 | 悬浮细胞 | ||||
| 不透明底 | 透明底 | 不透明底 | 透明底 | ||
| Washing Buffer (10×) | Top Reading | 〇 | 〇 | ||
| Bottom Reading | × | 〇 | × | 〇 | |
| Quenching Buffer | Top Reading | × | × | ||
| Bottom Reading | × | 〇 | × | △※ | |
※接种的细胞需要覆盖板底,使之静置一段时间,从而可检测在板底的贴壁细胞。
〈使用Quenching Buffer时,悬浮细胞的数据〉
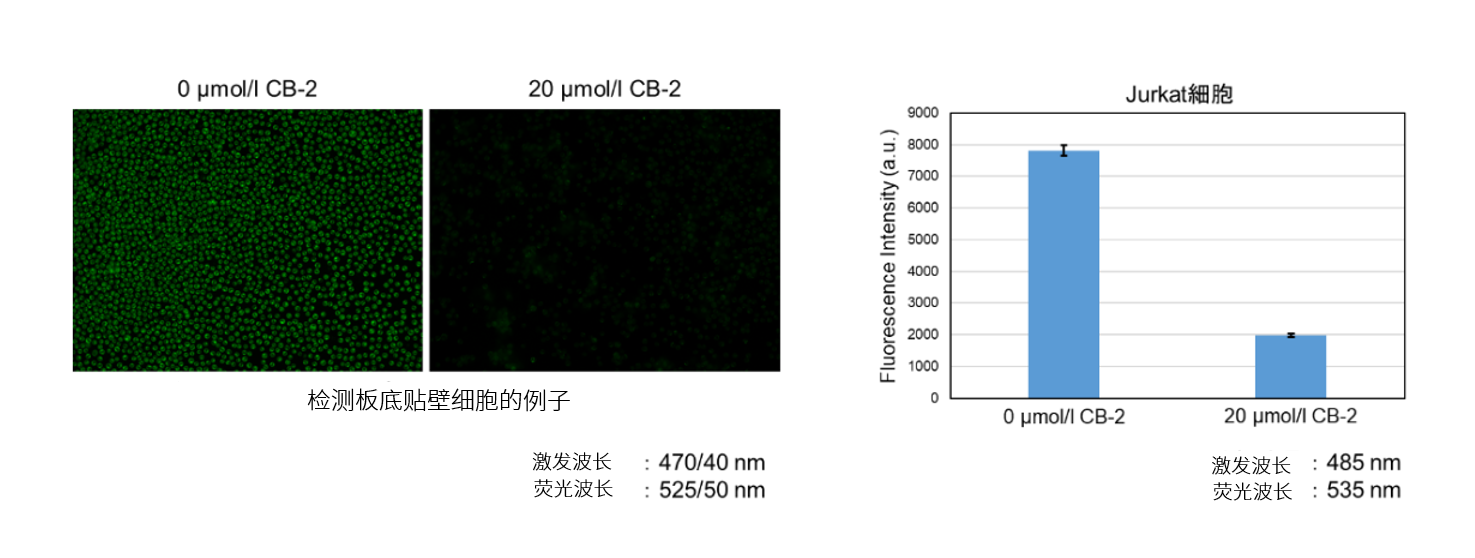
实验案例使用孔板:
| 厂家 | 产品名 | Cat No. |
| ibidi | µPlate 96 well ibiTreat black S 15 | ib89626 |
| Thermo Fisher | 96 Well Black/Clear Bottom Plate, TC Surface, Pack of 10 | 165305 |
| Q: Fatty Acid Uptake Probe working solution可以保存吗? |
| A:无法保存。 |
| Q:背景较高怎么办? |
| A:样品中可能存在未进入细胞的Fatty Acid Uptake Probe。可重复使用Washing Buffer solution清洗,或者考虑使用Quenching Buffer。 |
| Q:试剂盒可检测的样品数量是多少? |
| A:请参照下表。 |
| 贴壁细胞 | 悬浮细胞 | ||||
| 培养皿
(添加量) |
6 well
(1.5 ml/well) |
24-well
(0.3 ml/well)
|
96-well
(0.1 ml/well)
|
35-mm dish
(1.5 ml/well)
|
1.5-ml microtube
(0.5 ml/tube)
|
| 样本数 | 7 sample | 34 sample | 100 sample | 7 sample | 20 sample |
| Q:使用Quenching Buffer用激光共焦显微镜进行检测,应该怎么做? |
| A:使用Quenching Buffer用激光共焦显微镜进行检测时,请将Quenching Buffer用Washing Buffer solution稀释10倍后使用,或者使用640nm激发光检测。
<用用激光共焦显微镜进行透射光观察时所看到的现象>
|
| Q:可以进行脂肪酸定量吗? |
| A:不能使用本产品定量脂肪酸。 |
| Q:可以量化细胞内摄取的Fatty Acid Uptake Probe吗? |
| A:无法定量细胞内摄取的Fatty Acid Uptake Probe。该试剂是为了确认脂肪酸摄取能力的增减的配合用试剂。 |
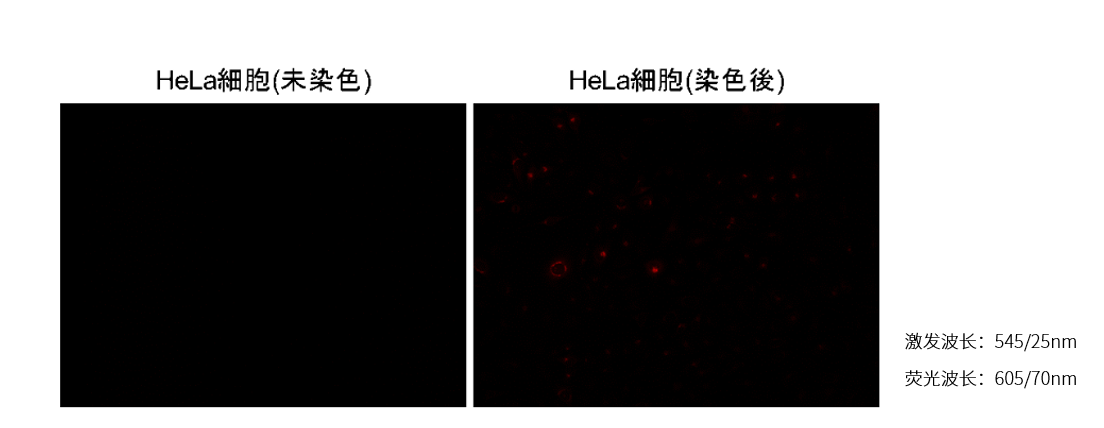
| Q:可以和其他荧光染料共染吗? |
| A:Fatty Acid Uptake Probe是使用红色荧光观察。因此,请使用绿色或者红色荧光检测以外的试剂进行共染色。
与本公司线粒体染色试剂MitoBright LT Deep Red(MT12)共染色的实绩。 〈进入红色荧光〉
〈与MitoBright LT Deep Red共染色〉 1. 制备细胞样品接种到培养皿或者孔板中; 2.去除培养基,用无血清培养基洗涤两次; 3.加入无血清培养基,在培养箱(37℃,5%CO2)中静置15 min; 4.去除上清液后,添加Fatty Acid Uptake Probe working solution,在培养箱(37℃,5%CO2)中静置15 min; 5. 去除上清液后,添加0.1µmol/l MitoBright LT working solution,在培养箱(37℃,5%CO2)中静置30 min; 6. 去除上清液后,用HBSS洗涤两次; 7.加入HBSS并用荧光显微镜观察。
|
| Q: 荧光显微镜观察时有什么注意事项吗? |
| A:荧光显微镜观察时,如果持续照射激发光,Fatty Acid Uptake Probe的荧光可能会淬灭。请控制连续的激发光的照射次数。
|