特点:
● 整个标记过程仅需3个小时
● 整个标记过程在1支过滤管中进行
● 荧光标记抗体回收率高
● 适用于50-200 μg的IgG


试剂盒内含

产品概述
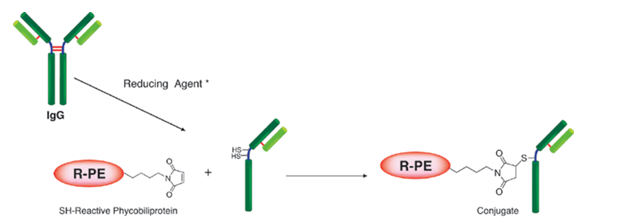
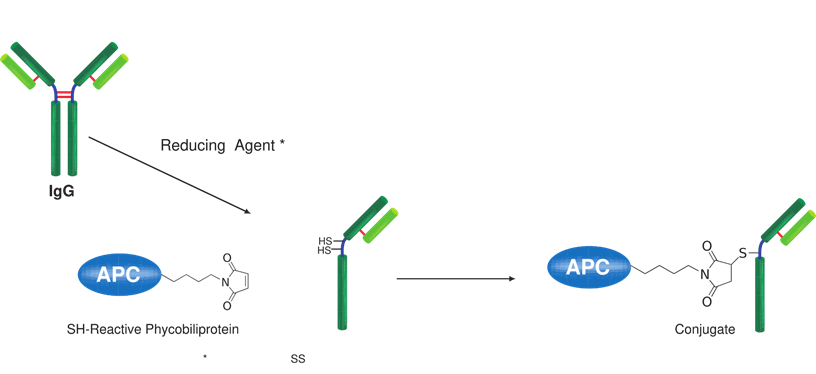
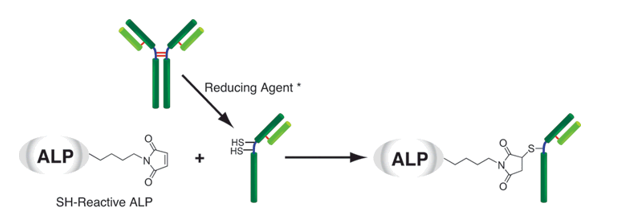
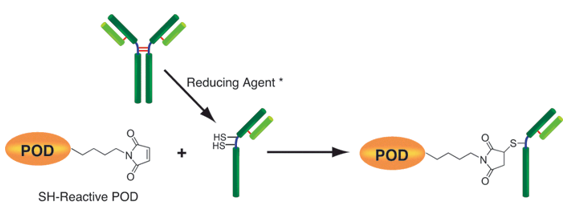
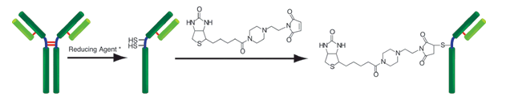
生物素标记试剂盒-SH是用于在具有SH基团的蛋白质(尤其是抗体)上标记生物素的试剂盒。由于试剂盒中包含的SH反应性生物素分子中具有马来酰亚胺基团,因此仅通过与具有SH基团的分子混合即可形成稳定的共价键。如果蛋白质具有S-S键,则可以使用连接的还原剂制备游离的SH基团。(但是,由于SS键的断裂,蛋白质的活性可能会丢失。)当用生物素标记高分子量蛋白质(例如免疫球蛋白G(IgG))时,可以使用所附的过滤管轻松进行预采样。如果可以进行处理并且将铰链区中的SH基团用于标记,则可以制备生物素标记的还原IgG,而不会损害抗体活性。另外,未反应的SH-反应性生物素可以在反应后通过使用滤管的纯化操作除去。
原理
操作步骤
使用注意事项:
1. 用该试剂盒标记的蛋白质的分子量要>50,000。
2. 在标记过程中,IgG或者Biotin-IgG标记物始终存在于过滤管的滤膜上。
3. 如果蛋白质溶液中含有分子量>10,000的其他蛋白质,如BSA或明胶时,在使用该试剂盒标记前,先要纯化IgG溶液。IgG溶液能够用IgG Purification Kits (不包含于本试剂盒中) 来纯化。
4. 如果蛋白质溶液含有小的不溶物,离心后取上清液来进行标记。
5. 1管SH-Reactive Biotin可以标记50-200ug蛋白质。
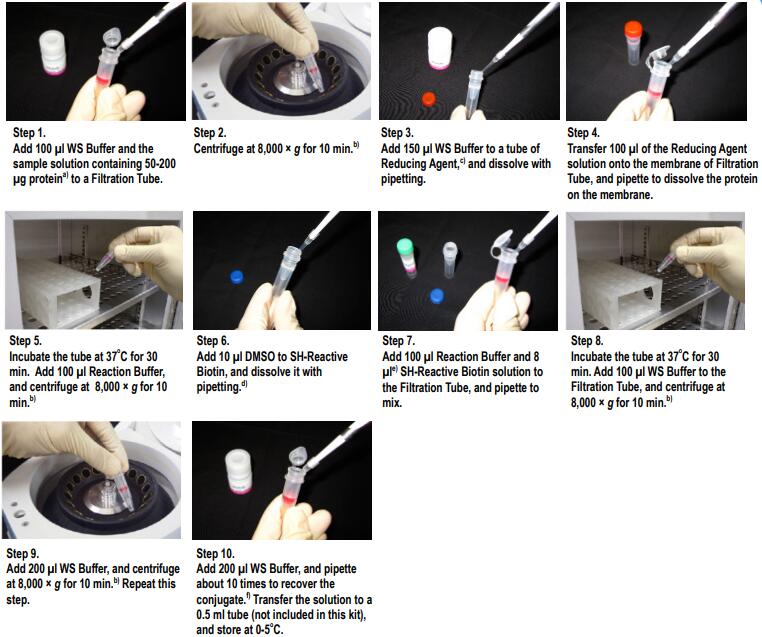
标记IgG操作步骤
(1)将100μl WS buffer以及含有100μg IgG的样品溶液加入到过滤管中。a)
(2)8,000-10,000g离心10分钟。b)
(3)将150μl WS buffer加入到Reducing agent管中,并用移液器吹打使其溶解。
(4)将100μl Reducing agent溶液转移到过滤管的滤膜上,吹打使IgG在膜上溶解。
(5)37℃培养30分钟。加入100μl Reaction buffer,8,000-10,000g离心10分钟。b)
(6)将10μl DMSO加入到SH-reactive biotin中,吹打使其溶解。c)
(7)将100μl Reaction buffer与8μl SH-reactive biotin溶液加入到过滤管中,吹打使其混合。d)
(8)37℃培养30分钟。将100μl WS buffer加入到过滤管中8,000-10,000g离心10分钟。 b)
(9)加入200μl WS buffer,8,000-10,000g离心10分钟。b)再重复该步骤一次。
(10)加入200μl WS buffer,吹打10-15次来回收标记产物。e)将该溶液转移到0.5ml试管中,在0-5℃下保存。
a) 样品溶液的体积不应超过100ul。如果蛋白质浓度<0.5mg/ml,重复操作步骤1和2直至总的IgG聚积量达到100ug。如果聚积过程中滤液的体积超过400 ul,则在进行后续的离心操作前应除去滤液。
b) 如果溶液在离心后仍然残留在膜上,可以再离心5min或者适当增加转速直至膜上没有残留液体。
c) NH2-Reactive Biotin/SH-Reactive Biotin在管子的底部,向管底加入10ul DMSO,吹打数次使其溶解。
d) 如果IgG的量为200ug,在步骤4时加入所有的NH2-ReactiveBiotin溶液。
e) 并不一定要使用WS Buffer来回收标记产物,可以选择任何适合于该实验的缓冲液来替代。
产品优势
1、整个标记过程仅需3个小时
2、整个标记过程在1支过滤管中进行
3、荧光标记抗体回收率高
4、适用于50-200 μg的IgG
常见问题Q&A
| Q1:样品溶液中的共存会影响反应吗? |
| A:它可能会受到共存类型的影响。确认溶液中包含哪种物质后,根据情况纯化用于标记的蛋白质,并将其用于标记反应。<聚合物:分子量10,000以上>它可能会影响。即使使用Filtration Tube,也无法去除具有氨基的高分子量化合物,例如BSA和明胶。因此,它被标记并充当荧光杂质。 在反应中使用之前,请执行单独的清除操作。另一方面,如果存在许多高分子杂质,即使没有氨基的化合物也可能导致过滤器堵塞。它可能会干扰标记/纯化操作。 *不仅对于生物素标记试剂盒-SH,而且对于其他标记试剂盒,都需要采取相同的预防措施。 |
| Q2:标记小分子蛋白质(分子量50,000或以下)的方法。 |
| A:由于该试剂盒中包含的过滤管是分子量截断值为30K的超滤过滤器,因此我们建议使用50,000或分子量更大的蛋白质,并留有余量。当标记分子量为50,000或更小的蛋白质时,可以通过更换为分子量分数较小的超滤过滤器来标记甚至很小的蛋白质,如下所示。
—————————————— PALL Nanocep 3K产品编号OD003C33 PALL Nanocep 10K产品编号OD010C33 —————————————— 离心所需的时间可能比试剂盒中随附的过滤器要长,因此请注意离心时间。 |
| Q3:标记后,离心过滤管,液体仍会留在膜上怎么处理? |
| A:(1)目视检查隔膜时,如果液体稍微残留在隔膜杯的边缘,请继续执行下面操作。如果倾斜和旋转膜杯时液体残留在膜上或滴下,请以8,000 g离心约15至30分钟。 (2)即使在1)中的离心操作之后,如果液体仍留在膜上,请检查标记物质是否聚集。
根据抗体或蛋白质本身的特性,用小分子标记剂进行标记可能会增加抗体或蛋白质的疏水性并使其聚集。如果在标记的物质上观察到团聚,将其转移到另一个微管中一次,离心并使用上清液。 (回收的抗体/蛋白质的量将减少。)如果上述方法没有帮助,请与公司技术支持联系。 *如果您怀疑过滤器堵塞,可以通过更换新的膜过滤器来解决。 替代品:PALL Nanocep 30K(制造商代码:OD030C33) |
| Q4:该试剂盒可以标记什么? |
| A:可以标记分子量为“50,000或更高”并且具有[S-S]或[SH]的任何化合物(抗体,蛋白质等)。量为“50-200μg”。 *由于试剂盒中包含的过滤管尺寸为30K,因此无法纯化低分子量化合物。 |
参考文献
1) E. Terasaka, K. Yamada, P.H. Wang, K. Hosokawa, R. Yamagiwa, K. Matsumoto, S. Ishii, T. Mori, K. Yagi, H. Sawai, H. Arai, H. Sugimoto, Y. Sugita, Y. Shiro and T. Tosha, “Dynamics of nitric oxide controlled by protein complex in bacterial system”, Proc. Natl. Acad. Sci. U.S.A.., 2017, 114, (37), 9888.
2) J. Hiruma, K. Harada, A. Motoyama, Y. Okubo, T. Maeda, M. Yamamoto, M. Miyai, T. Hibino and R. Tsuboi, “Key component of inflammasome, NLRC4, was identified in the lesional epidermis of psoriatic patients”, J. Dermatol.., 2018, 45, (8), 971.
3) K. Gonda, M. Watanabe, H. Tada, M. Miyashita, Y. Takahashi-Aoyama, T. Kamei, T. Ishida, S. Usami, H. Hirakawa, Y. Kakugawa, Y. Hamanaka, R. Yoshida, A. Furuta, H. Okada, H. Goda, H. Negishi, K. Takanashi, M. Takahashi, Y. Ozaki, Y. Yoshihara, Y. Nakano and N. Ohuchi, “Quantitative diagnostic imaging of cancer tissues by using phosphor-integrated dots with ultra-high brightness”, Sci. Rep.., 2017, 7, (1), 7509.
4) K. Saito, M. Sakaguchi, H. Iioka, M. Matsui, H. Nakanishi, N.H. Huh and E. Kondo, “Coxsackie and adenovirus receptor is a critical regulator for the survival and growth of oral squamous carcinoma cells”, Oncogene., 2014, 33, (10), 127401286.
5) K. Yamamoto, H. Murata, E.W. Putranto, K. Kataoka, A. Motoyama, T. Hibino, Y. Inoue, M. Sakaguchi and N.H. Huh, “DOCK7 is a critical regulator of the RAGE-Cdc42 signaling axis that induces formation of dendritic pseudopodia in human cancer cells”, Oncol. Rep.., 2013, 29, (3), 1073.
6) M. Sakaguchi, H. Murata, K. Yamamoto, T. Ono, Y. Sakaguchi, A. Motoyama, T. Hibino, K. Kataoka and N.H. Huh, “TIRAP, an Adaptor Protein for TLR2/4, Transduces a Signal from RAGE Phosphorylated upon Ligand Binding”, PLoS ONE., 2011, 6, (8), e23132.
7) M. Sakaguchi, H. Murata, Y. Aoyama, T. Hibino, E.W. Putranto, I.M. Ruma, Y. Inoue, Y. Sakaguchi, K. Yamamoto, R. Kinoshita, J. Futami, K. Kataoka, K. Iwatsuki and N.H. Huh, “DNAX-activating Protein 10 (DAP10) Membrane Adaptor Associates with Receptor for Advanced Glycation End Products (RAGE) and Modulates the RAGE-triggered Signaling Pathway in Human Keratinocytes”, J. Biol. Chem.., 2014, 289, (34), 23389.
8) N. Kobayashi, K. Odaka, T. Uehara, K. Imanaka-Yoshida, Y. Kato, H. Oyama, H. Tadokoro, H. Akizawa, S. Tanada, M. Hiroe, T. Fukumura, I. Komuro, Y. Arano, T. Yoshida and T. Irie, “Toward in Vivo Imaging of Heart Disease Using a Radiolabeled Single-Chain Fv Fragment Targeting Tenascin-C”, Anal. Chem.., 2011, 83, (23), 9123.
9) T. Ikeda, R. Shinohata, M. Murakami, K. Hina, S. Kamikawa, S. Hirohata, S. Kusachi, A. Tamura and S. Usui, “A rapid and precise method for measuring plasma apoE-rich HDL using polyethylene glycol and cation-exchange chromatography: a pilot study on the clinical significance of apoE-rich HDL measurements”, Clin. Chim. Acta.,2017, 465, 112.
10) T. Into, M. Inomata, M. Nakashima, K. Shibata, H. Hacker and K. Matsushita, “Regulation of MyD88-Dependent Signaling Events by S Nitrosylation Retards Toll-Like Receptor Signal Transduction and Initiation of Acute-Phase Immune Responses”, Mol. Cell. Biol.., 2008, 28, (4), 1338.
11) W. Nakai, T. Yoshida, D. Diez, Y. Miyatake, T. Nishibu, N. Imawaka, K. Naruse, Y. Sadamura and R. Hanayama, “A novel affinity-based method for the isolation of highly purified extracellular vesicles”, Sci. Rep.., 2016, 6, 33935.
12) Y. Terasaki, T. Akuta, M. Terasaki, T. Sawa, T. Mori, T. Okamoto, M. Ozaki, M. Takeya and T. Akaike, “Guanine Nitration in Idiopathic Pulmonary Fibrosis and Its Implication for Carcinogenesis”, Am. J. Respir. Crit. Care Med.., 2006, 174, (6), 665.
13) I. W. Sumardika, C. Youyi, E. Kondo, Y. Inoue, I. M. W. Ruma, H. Murata, R. Kinoshita, K. Yamamoto, S. Tomida, K. Shien, H. Sato, A. Yamauchi, J. Futami, E. W. Putranto, T. Hibino, S. Toyooka , M. Nishibori and M. Sakaguchi, “β-1,3-Galactosyl-O-Glycosyl-Glycoprotein β-1,6-N-Acetylglucosaminyltransferase 3 Increases MCAM Stability, Which Enhances S100A8/A9-Mediated Cancer Motility.”, Oncol. Res., 2018, 26, (3), 431.
14) J. Iwano, D. Shinmi, K. Masuda, T. Murakami and J. Enokizono, “Impact of Different Selectivity between Soluble and Membrane-bound Forms of Carcinoembryonic Antigen (CEA) on the Target-mediated Disposition of Anti-CEA Monoclonal Antibodies.”, Drug Metab. Dispos., 2019, 47, (1), 1240.
15) D. S. On, P. Chertchinnapa, Y. Shinkai, T. Kojima and H. Nakano, “Development of a dual monoclonal antibody sandwich enzyme-linked immunosorbent assay for the detection of swine influenza virus using rabbit monoclonal antibody by Ecobody technology.”, J. Biosci. Bioeng., 2020, DOI:10.1016/j.jbiosc.2020.03.003.