特点:
● 活细胞和固定细胞均可染色
● 可用共聚焦显微镜或流式细胞仪检测
● 可固定后与抗体共染色


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Mitophagy Detection Kit 线粒体自噬
NO.3. Cell Cycle Assay Kit 细胞周期检测
NO.4. Caspase-3 Assay Kit -Colorimetric 细胞凋亡检测
NO.5. Cellstain- Hoechst 33342 solution 细胞核染色检测
试剂盒内含
产品概述
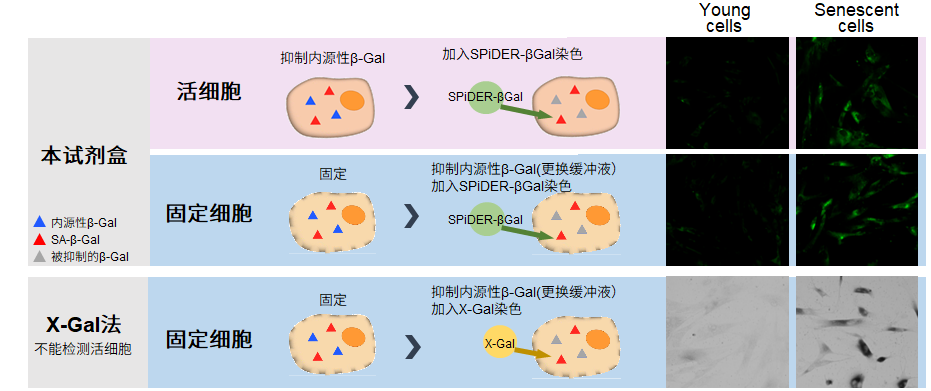
正常细胞的DNA损伤是由细胞的不断分裂和氧化应激引起。在没有修复DNA损伤的情况下,为了抑制细胞的癌化,需要不可逆地终止DNA损伤细胞的分裂。细胞衰老是一种可以不可逆地终止DNA损伤细胞分裂的状态,它可以抑制DNA受损细胞的生长。SA-β-gal (细胞衰老β-半乳糖苷酶)在衰老细胞中过表达,被广泛作为细胞衰老的标识之一。用X-gal染色检测SA-β-gal是一种常用的方法,但此方法存在几个缺点:
1)由于细胞透膜性差,需要固定细胞。
2)由于很难区分染色细胞和未染色细胞,所以定量困难。
3)染色时间长。
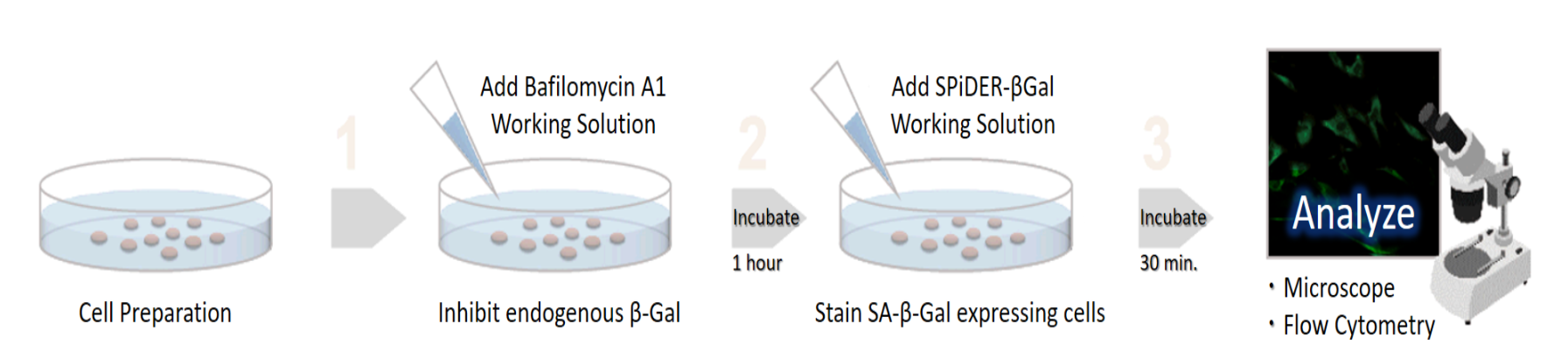
本试剂盒检测SA-β-gal灵敏度高,方法简便。SPiDER-βGal是一种检测β-gal的新型试剂,具有细胞透膜性高,胞内荧光维持时间长的特点。本试剂盒不仅可以特异性地检测到活细胞中的SA-β-gal(用Bafilomycin A1抑制内源性β-galactosidase的活性),也可以检测到固定细胞中的SA-β-gal(用McIlvaine缓冲液 (pH 6.0)。由于SPiDER-βGal和SA-β-gal反应后会产生很强且持续的荧光,因此SPiDER-βGal可被用于流式细胞仪来进行定量分析。
原理
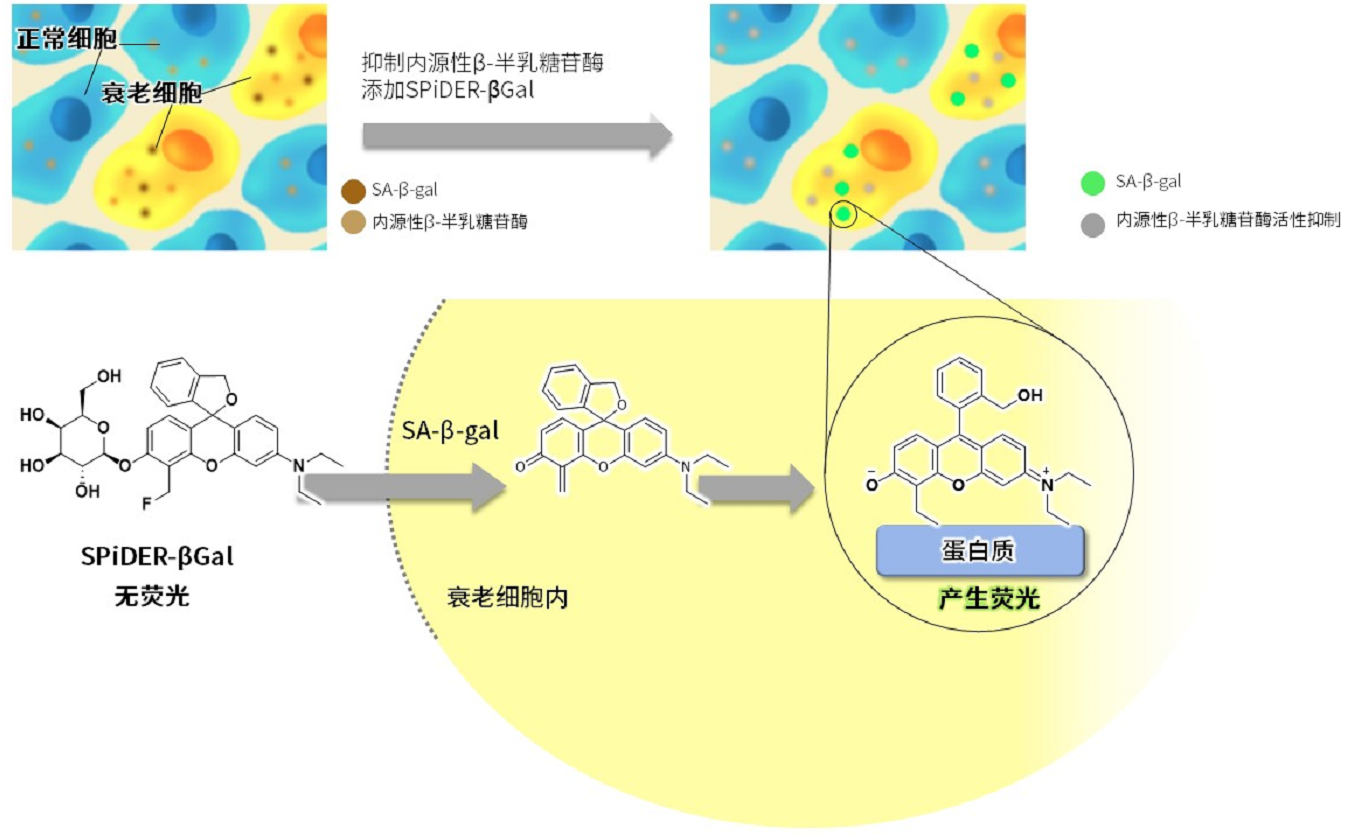
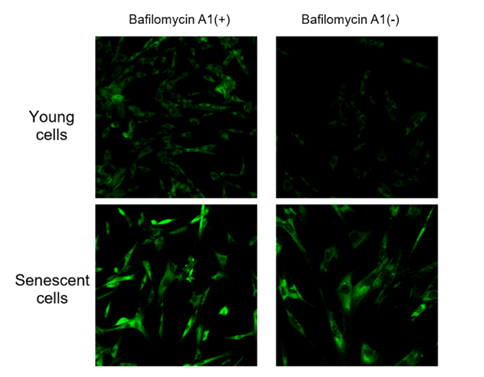
由于该试剂盒中的β-半乳糖苷酶检测试剂SPiDER-βGal具有细胞膜通透性,因此无需特别的细胞膜通透性处理或固定细胞,即可直接检测活细胞。穿透细胞膜的SPiDER-βGal通过与SA-β-gal反应发出荧光,并会与附近的蛋白质共价结合。另外,通过在加SPiDER-βGal之前,添加试剂盒内含的Bafilomycin A1,可抑制活细胞中内源性β-半乳糖苷酶的活性,并且抑制背景的状态下检测到SA-β-gal的荧光。
荧光特性
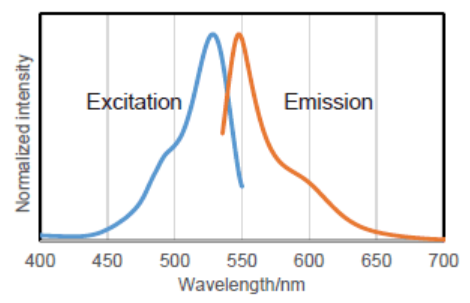
SPiDER-βGal和β-半乳糖苷酶反应的激发和发射光谱图
<推荐波长>
Ex:500~540 nm
Em:530~570 nm
用共聚焦显微镜或流式细胞仪(请选择488 nm激发波长)
操作步骤
产品优势
特点1:适用于活细胞和固定细胞
检测固定化细胞时,不需要添加Bafilomycin A1,按照说明书记载的操作流程检测SA-βgal。
*活细胞添加Bafilomycin A1的原因:请参阅常见问题“为什么添加Bafilomycin A1?”。
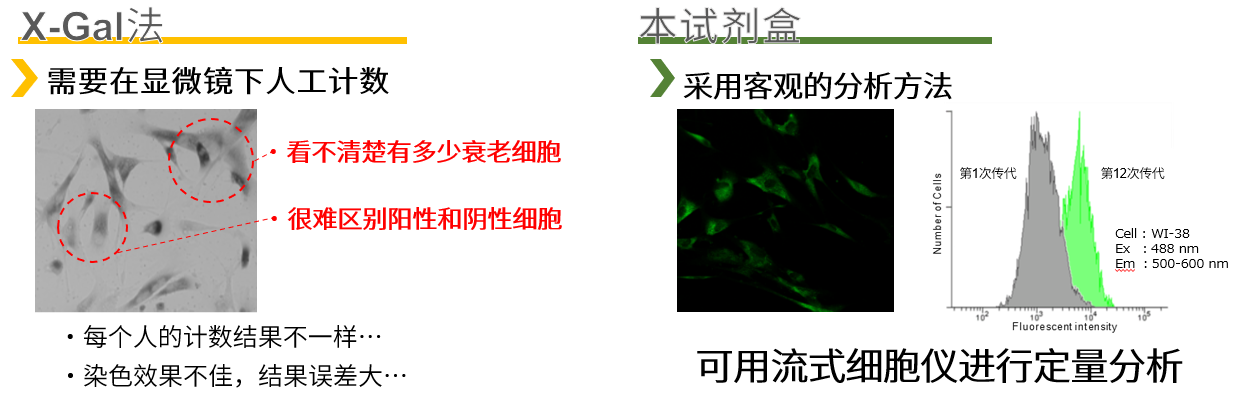
特点2:可定量检测
细胞衰老与细胞周期
细胞衰老与细胞周期之间的关系
阿霉素(DOX)会作用于细胞周期的G2/M期,抑制细胞增殖,并诱导细胞衰老。将DOX加入A549细胞后,G2/M期的峰值升高 (Cell Cycle Assay Solution Blue and Deep Red)衰老指标SA-β-gal增强(细胞衰老检测试剂盒-SPiDER-βGal)以及细胞线粒体膜电位降低(JC-1 MitoMP Detection Kit)。
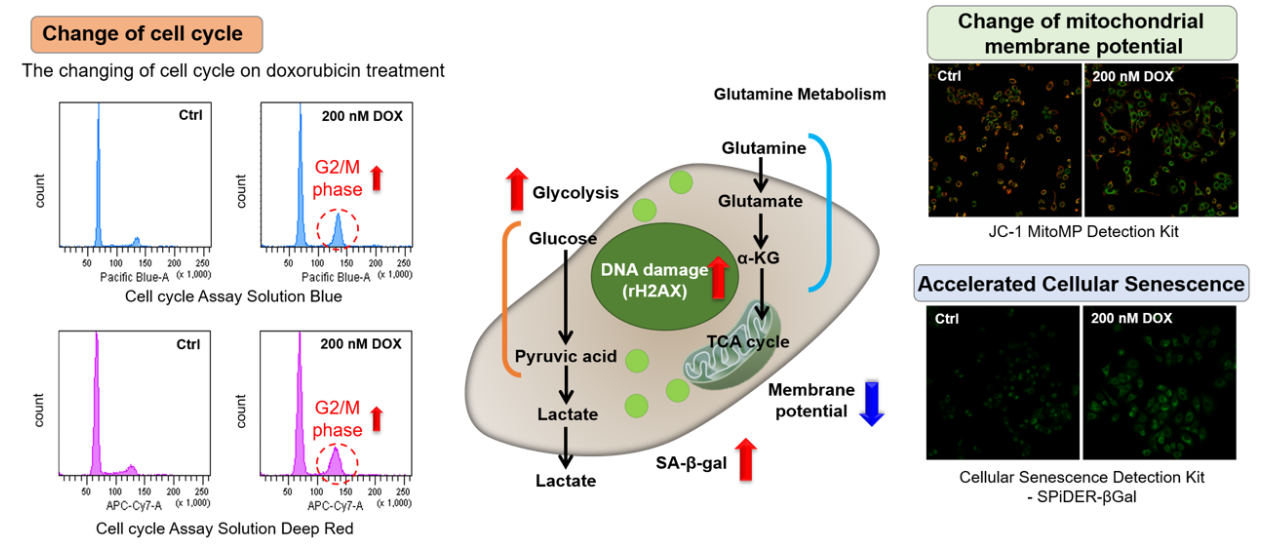
实验例
与其他细胞衰老标记物的共染色
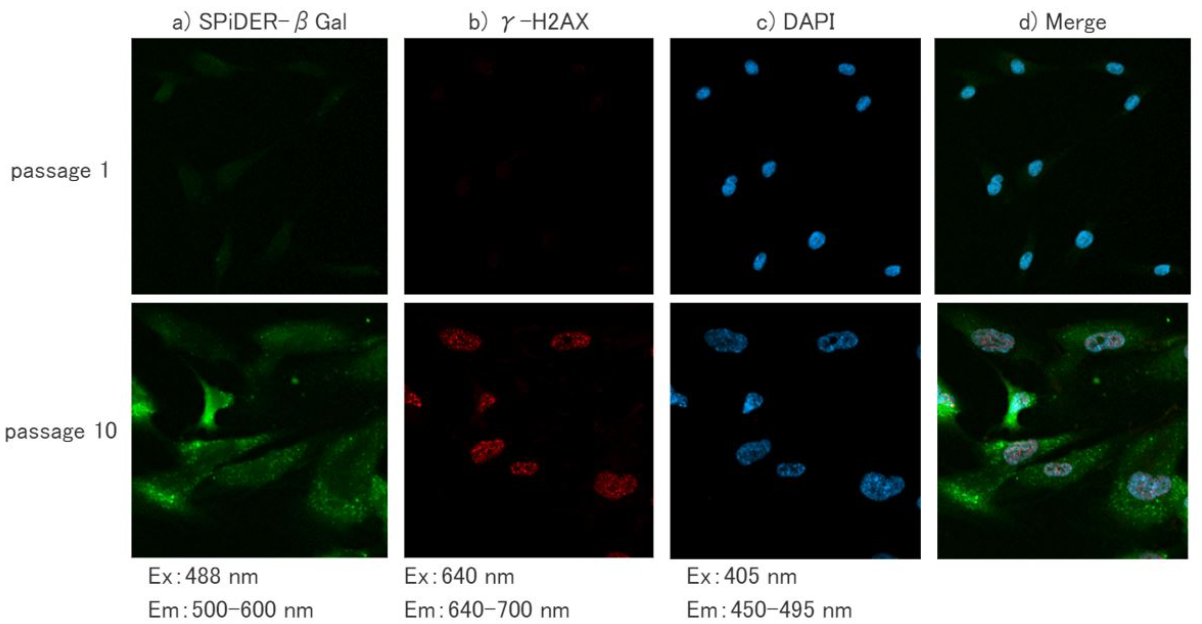
本实验是使用本试剂盒对细胞衰老的常用模型多次传代的Wl38细胞 (Passage 的 SA-βgal 进行检测的实例a)。与其他的细胞衰老标记物γH2AX DNA损伤标记物)的免疫染色b),以及全细胞的核染色(DAPI)c)。SA-βgal和γH2AX两种细胞衰老标记物的实验结果相关性得到了验证。d)
1)将传代1次和10次的Wl 38细胞按照本试剂盒的说明书的“活细胞检测”步骤进行SA-βgal染色。
2)添加4% PFA/PBS,室温培养15 min。
3)PBS清洗细胞3次。
4)加入0.1% Triton X 100/PBS,室温培养30 min。
5)PBS清洗细胞3次。
6)添加1% BSA/PBS,室温培养1 h。
7)用1% BAS/PBS稀释过的抗γH2AX抗体(兔源)加入至细胞后,过夜培养。
8)PBS清洗细胞3次。
9)用1% BAS/PBS稀释过的抗兔二抗(Alexa Fluor 647)加入至细胞后,室温培养2 h。
10)PBS清洗细胞3次。
11)用PBS稀释至 2μg/ ml 的 DAPI 溶液 同仁货号: D523]加入到细胞中,室温培养10 min 。
12)PBS 清洗细胞3 次,用激光共聚焦显微镜观察。
固定WI-38细胞中SA- β-gal与DNA损伤标记物共染
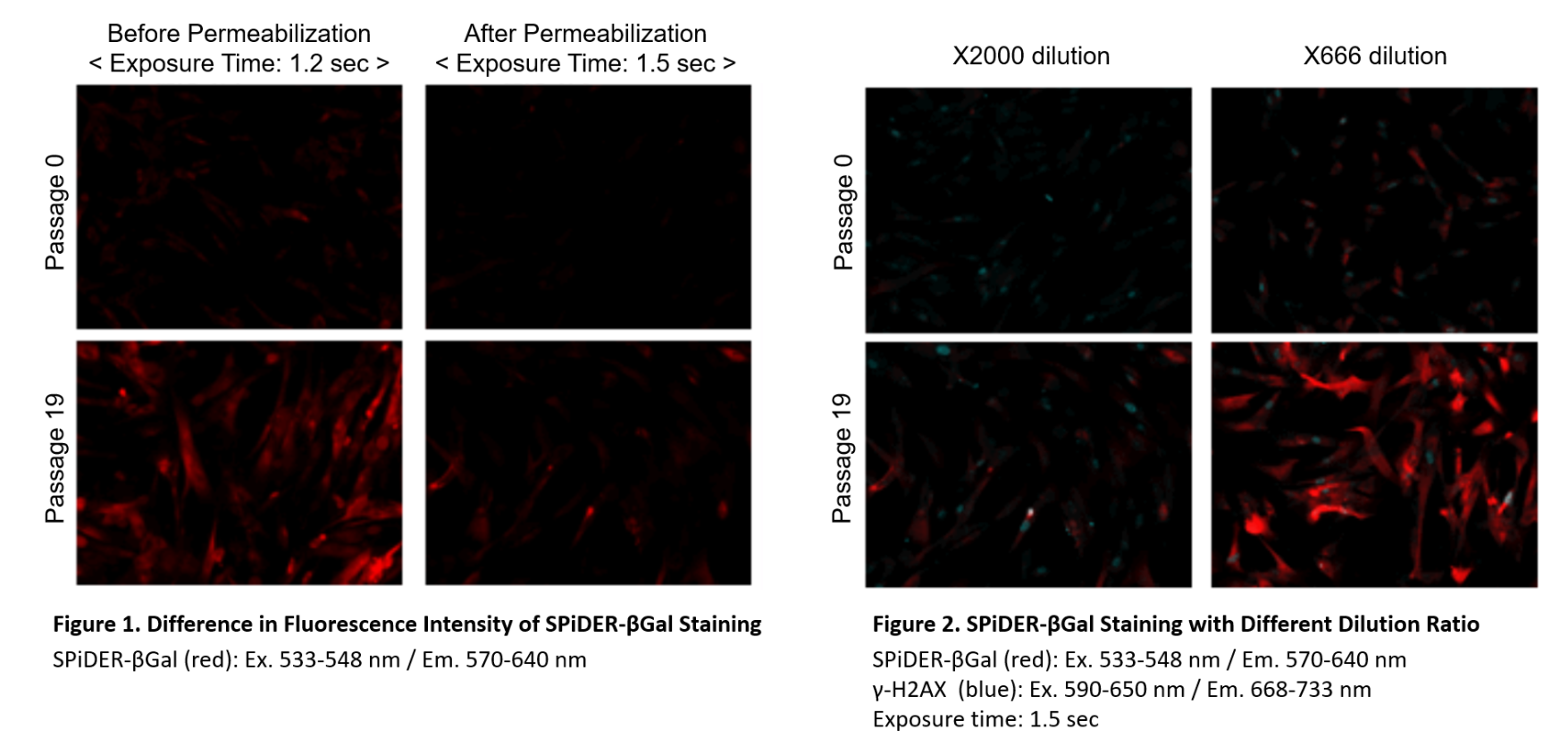
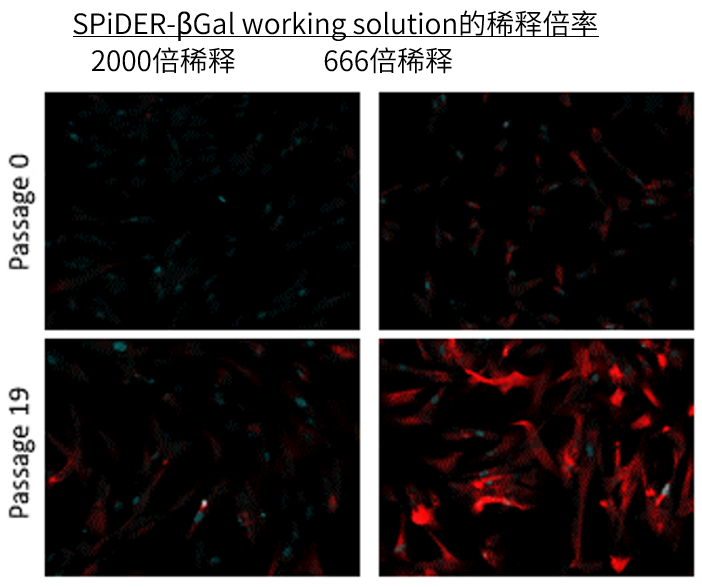
SPiDER-βGal工作液配制
用pH 6.0的McIlvaine 缓冲液稀释SPiDER-βGal DMSO储存液2,000倍。
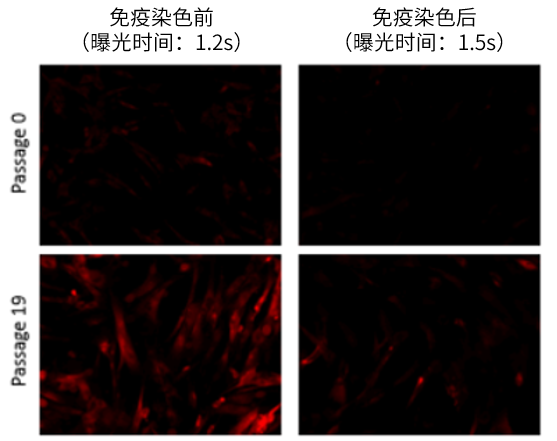
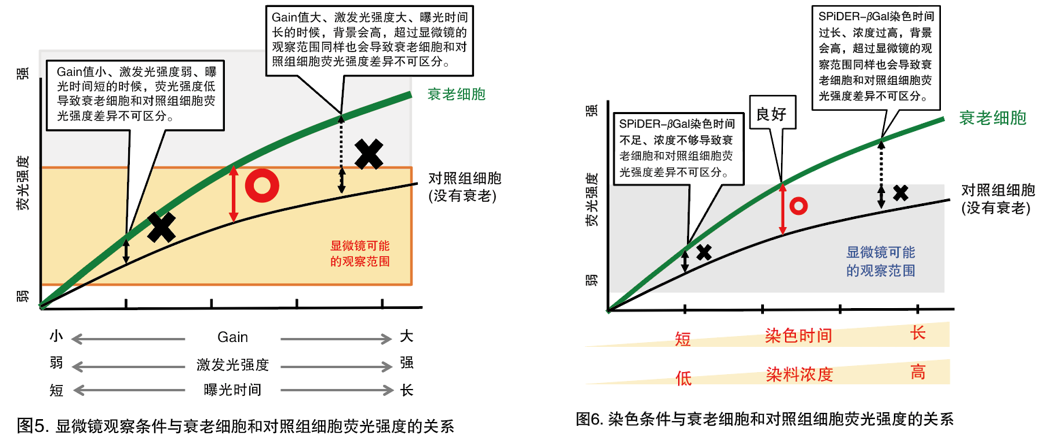
*固定操作和细胞膜通透性可能会导致灵敏度降低(图1),如果您需要更高的信号,可以将McIlvaine buffer稀释SPiDER-βGal DMSO储存液的倍数调整为500-1000倍(图2)。
McIlvaine buffer(pH6.0)的制备
将3.7ml 0.1 mol/l的柠檬酸溶液和6.3ml 0.2 mol/l的磷酸钠溶液混合。确认pH为6.0,如pH不是6.0,则可通过添加柠檬酸溶液或磷酸钠溶液来调价pH。使用超纯水将该缓冲液稀释5倍。
染色步骤(35 mm 培养皿)
1. 在35 mm 培养皿中接种细胞后,在37℃,5% CO2培养箱中过夜培养。
2. 去除培养基,用2 ml PBS洗涤1次后,加入2 ml 4%的多聚甲醛(PFA)/PBS溶液,在室温固定3 min。
*避免延长培养时间,否则容易导致SA-β-gal活性降低
3. 去除上清液,用2 ml HBSS洗涤3次。
4. 加入2 ml SPiDER-βGal工作液后,在37℃培养30 min。
*用固定细胞检测SA-β-gal时,请不要使用5% CO2培养箱。如果使用5% CO2培养箱,SPiDER-βGal工作液会变成酸性,与内源性β-galactosidase发生反应,背景会上升,很难区分正常细胞和衰老细胞。
5. 去除上清液,用2 ml PBS洗涤2次。
6.在细胞中加入0.1% Triton X-100/PBS,并在室温下培养30分钟。
7.用PBS洗涤细胞2次。
8.向细胞中加入1% BSA/PBS,并在室温中培养1小时。
9.向细胞中加入1% BSA/PBS稀释的抗γ-H2AX抗体(小鼠),并在4℃孵育过夜。
10.用PBS洗涤细胞3次。
11.向细胞中加入1%BSA/PBS稀释的抗小鼠二抗(Cy5),并在室温下孵育1小时。
12.用PBS洗涤细胞两次,并在荧光显微镜下观察。
SA-β-gal检测T细胞(悬浮细胞)
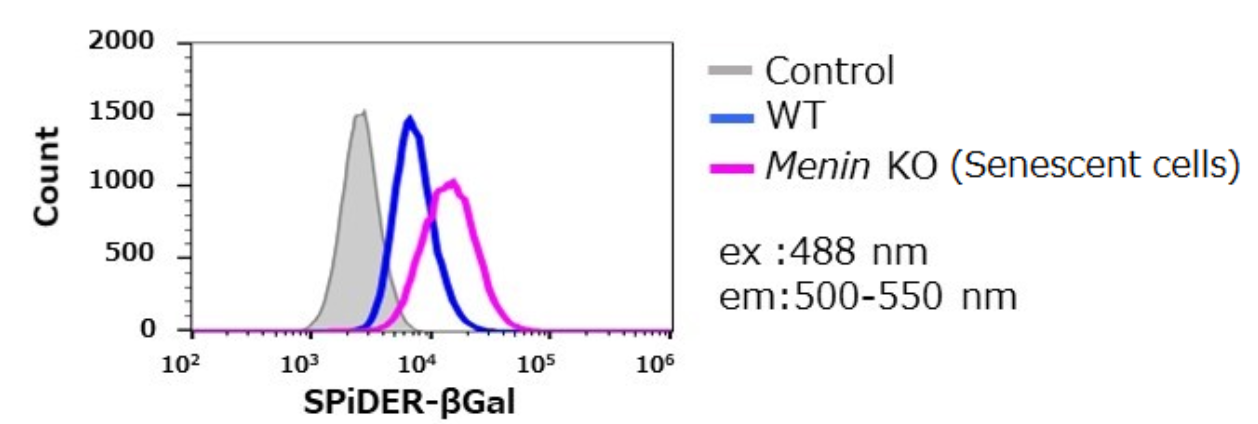
爱媛大学医学院Masakatsu Yamashita教授的研究小组表明,一种叫做menin的蛋白质可以控制T细胞的衰竭和衰老,并维持其正常的免疫功能。
这次通过使用的SPiDER-βGal染色结果确认,我们证实了在白细胞介素2(IL-2)的存在下,对敲除Menin蛋白的CD8阳性细胞通过刺激TCR(T细胞受体),会发生细胞衰老。
染色条件:
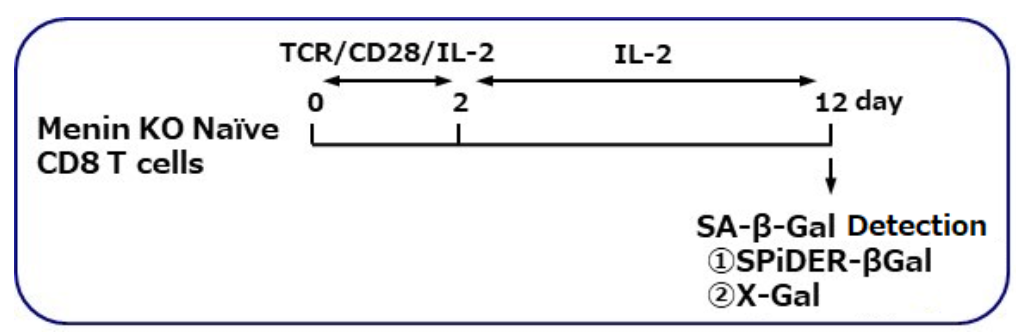
① SPiDER-βGal 方法
② X-gal 方法
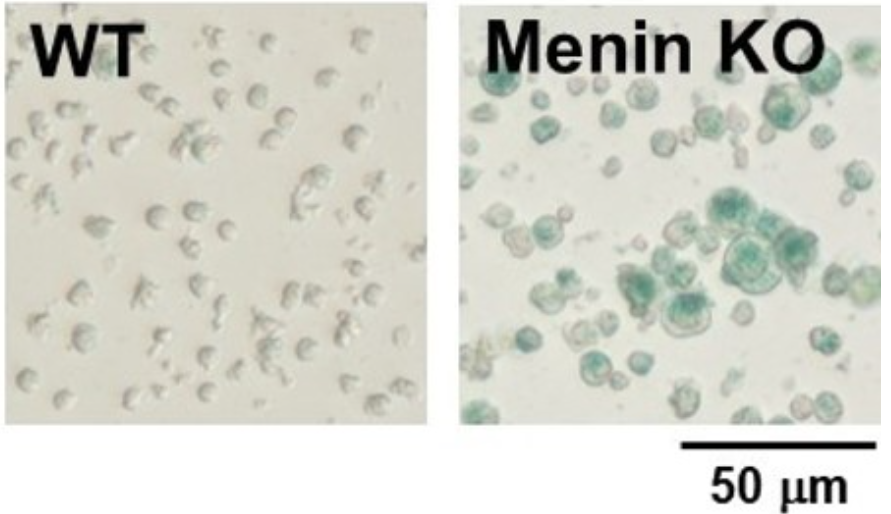
*数据由爱媛大学医学系Masakatsu Yamashita教授提供
用共聚焦成像细胞仪进行定量用
用共聚焦成像细胞仪(横河电机株式会社CQ1 )进行衰老细胞定量分析。
■与其他细胞衰老标记物共染色用
SPiDER-βGal 对 SA-β-gal 进行活细胞染色并进行细胞固定和膜透过处理后,对DNA损伤标志物γH2AX进行免疫荧光染色的 WI-38 细胞,通过共聚焦定量成像细胞仪进行定量和分析。

定量解析
散点图(Scatter Plot)
使用SPiDER-βGal对SA-β-gal 进行染色,其荧光强度作为 Y 轴,以 γ H2AX 的面积与每个细胞核的面积的比值作为 X 轴做成散点图的定量分析。
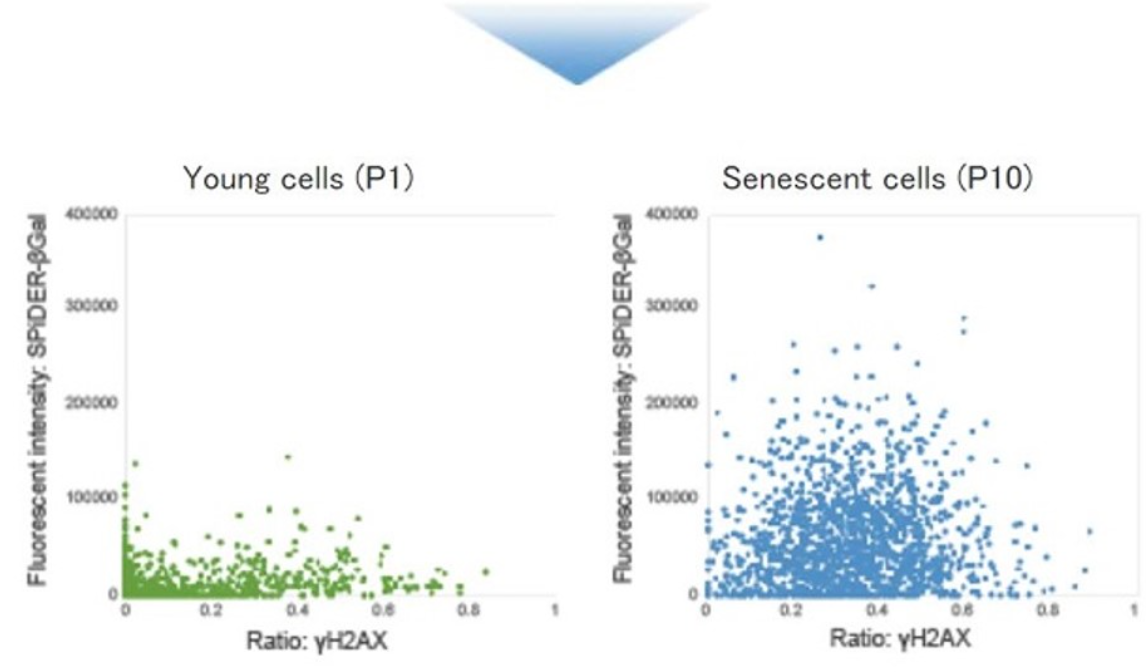
活细胞荧光染色的分析
X-gal法需要用目视观察总细胞数和衰老细胞的个数,并人工计算衰老细胞的阳性比率。
而使用共聚焦定量成像细胞仪时,用核染色剂(Hoechst 33342)来计数总细胞数 SPiDER-βGal对 SA-β-gal 进行染色来计算衰老细胞数,即可获得衰老细胞的阳性比率。
 横河电机
横河电机
CQ01 拍摄条件
使用孔板:96 孔板
物镜:10 倍
拍摄波长:405 nm Hoechst 33342 Cyan
488 nm (SPiDER-βGal Green)
视野:8视野
*SA-β-gal阳性Wl-38细胞(红色轮廓)
WI-38细胞中的SA-β-gal阳性细胞比例的差异取决于传代次数。与使用X-gal染色方法的手动计数操作相比,使用共聚焦可以快速分析数据。
SA-β-gal的荧光成像
1. 在35 mm μ-Dish(ibidi公司) 中分别接种传代数为0代和12代的Wl-38细胞 (5×10^4 个/dish、 10% FBS、1%青霉素-链霉素的MEM培养基) 后,在37℃、5% CO2培养箱中过夜培养。
2. 去除培养基,用2 ml HBSS洗涤1次。
3. 加入1 ml Bafilomycin A1工作液后,在37℃,5% CO2培养箱中培养1 h。
4. 将1 ml SPiDER-βGal 工作液和1 μl浓度为1 mg/ml 的Hoechst 33342溶液混合后加入培养皿中,在37℃、5% CO2培养箱中培养30 min。
5. 去除上清液,用2 ml HBSS洗涤2次.
6. 加入2 ml HBSS后,用共聚焦荧光显微镜观察(激发波长:488 nm,发射波长:500-600 nm)。

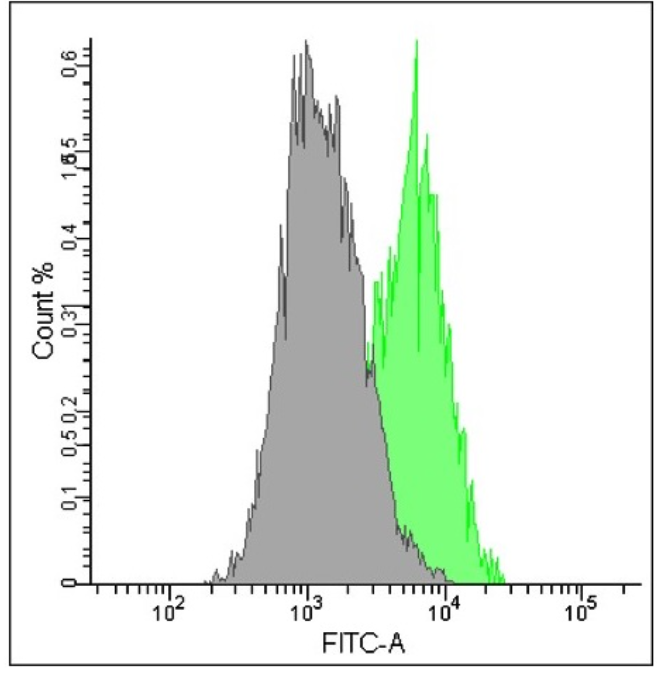
用流式细胞仪定量分析SA-β-gal阳性细胞
1. 在35 mm μ-Dish (ibidi公司) 中分别接种传代数为1代和12代的Wl-38细胞(1×105 个/dish,含有10% FBS,1%青霉素-链霉素的MEM培养基)后,在37℃、5% CO2培养箱中过夜培养。
2. 去除培养基,用2 ml HBSS洗涤1次。
3. 加入1 ml Bafilomycin A1工作液后,在37℃、5% CO2培养箱中培养1 h。
4. 加入1 ml SPiDER-βGal工作液后,在37℃,5% CO2培养箱中培养30 min。
5. 去除上清液,用2 ml HBSS洗涤2次。
6. 用胰蛋白酶消化细胞,将细胞用MEM培养基 (含有10%的FBS、1%的青霉素-链霉素)重悬。
7. 用流式细胞仪检测 (激发波长:488 nm,发射波长:515-545 nm)。
常见问题Q&A
| Q1: 本试剂盒的大概可以检测多少次? |
| A1:大概的检测次数,请参考下表中不同的使用容器: |
| 35mm dish | Micro Plate | Chamber Slide | |
| 使用次数 | 5 dishes | 2 plates | 7 slides |
| *使用次数会随着每孔添加的染色溶液量的变化而变化。使用前请先确认每孔的必要的染色溶液量。 |
| Q2: 为什么要添加Bafilomycin A1? |
| A2:很多细胞内部都存在内源性β-半乳糖苷酶 (β-galactosidase),由于SPiDER-βGal与内源性β-半乳糖苷酶和细胞衰老的标记物SA-β-Gal都会发生反应。即使在没有衰老的细胞中,背景也较高,妨碍了SA-β-Gal的检测。
Bafilomycin A1可以抑制溶酶体中的ATPase活性,并将溶酶体中的pH从酸性变为接近中性,从而降低了内源性β-半乳糖苷酶的活性。因此,在添加SPiDER-βGal之前先用Bafilomycin A1处理细胞,使得SPiDER-βGal可以与SA-β-gal反应,并对衰老细胞进行荧光染色。 下图显示了添加和不添加Bafilomycin A1时检测SA-β-gal的差异。 由于Bafilomycin A1也被用作自噬的抑制剂。使用时,请考虑是否会对实验体系有影响,如果有影响,建议固定细胞。细胞固定时,缓冲液会控制细胞内的pH,所以不需要使用Bafilomycin A1。可以参照操作说明书中的步骤进行染色。
|
| Q3: DMSO stock solution 可以稳定保存多久? |
| A3: SPiDER-βGal DMSO stock solution和Bafilomycin A1 DMSO stock solution配制后,-20℃可以稳定保存1个月。 |
| Q4: Working solution可以稳定保存多久? |
| A4: SPiDER-βGal working solution和Bafilomycin A1 working solution无法长期保存,请现配现用。 |
| Q5: 做细胞衰老的荧光观察时有哪些注意事项? |
| A5: 随着细胞的衰老,被称为脂褐素(Lipofuscin)的不溶性物质会在细胞中积聚。 脂褐素自身会产生荧光,进而增加荧光背景。 在这种情况下,我们建议您准备不含SPiDER-βGal的样品,以准确评估衰老细胞中的SA-β-gal活性。 流式细胞仪检测 ・测定“衰老细胞”和“正常细胞”的平均荧光强度(MFI) ①添加了SPiDER-βGal的细胞 ②未添加SPiDER-βGal的细胞 (背景) ・“①的平均荧光强度”减去“②的平均荧光强度” 用扣除背景后的SA-β-gal的荧光来表征SA-β-gal的活性。 a:SA-β-gal活性(衰老细胞):=①的平均荧光强度 – ②的平均荧光强度 b:SA-β-gal活性(正常细胞):=①的平均荧光强度 – ②的平均荧光强度 ・通过比较上述a和b的值来评价SA-β-gal的活性。 另外,通过a减去b的差值可以确定细胞衰老所引起的SA-β-gal活性的变化。 荧光显微镜检测 ・首先,使用未添加SPiDER-βGal的衰老细胞进行荧光观察。 ・调整灵敏度(Gain等),直至来生自脂褐素的荧光(背景)不影响荧光图像为止。 ・在相同的成像条件下,再对添加了SPiDER-βGal的细胞或正常细胞进行荧光观察。 |
| Q6: 细胞固定后还可以对SA-β-gal进行染色吗? |
| A6: 可以。如果固定细胞,则不需要用Bafilomycin A1预处理细胞,但是需要制备pH调节至6的Mcllvain Buffer。详细的操作请参考操作说明书。 |
| Q7: 请问是否有细胞固定后进行流式细胞仪操作的具体步骤? |
| A7: 可以。但是请注意细胞固定可能会影响SA-β-gal(请参考下面的*2) 以下的实验例供作参考。 WI-38细胞固定后,进行SA-β-gal检测和γ-H2AX (DNA损伤标志物)的免疫染色。 <实验操作> (1) 将WI-38细胞播种至35 mm dish,37℃,5% CO2培养箱中过夜培养。 (2) 去除上清,加入2 ml 4% Paraformaldehyde/PBS溶液,室温培养3 min*1。 (3) 用2 ml PBS清洗细胞3次。 (4) 添加2 ml SPiDER-βGal working solution *2, 37℃培养30 min*3。 (5) 用2 ml PBS清洗细胞2次。 (6) 加入2 ml 0.1% Tritox X-100/PBS, 室温培养30 min。 (7) 用2 ml PBS清洗细胞2次。 (8) 加入 2ml 1% BSA/PBS溶液,室温培养1 h。 (9) 用1% BSA/PBS溶液稀释过的抗γ-H2AX IgG(小鼠来源),加入至细胞后室温培养1 h (10) 用2 ml PBS清洗细胞3次。(11) 用1% BSA/PBS溶液稀释过的抗小鼠IgG(Cy5标记),加入至细胞后室温培养1 h。 (12)去除上清,用2 ml PBS清洗细胞2次后进行荧光显微镜观察。 *1 细胞固定时间越长,对SA-β-gal活性的影响越高。 图1. 免疫染色前后SPiDER-βGal染色的荧光强度变化 图2. 不同稀释倍率的SPiDER-βGal染色结果 (免疫染色后) 红色:SPiDER-βGal 蓝色:γ-H2AX <曝光时间: 1.5 s> |
| Q8: 染色操作后发现荧光很弱,无法观察,请问是否有改善的方法? |
| A8: 请确认如下三个注意事项。 ①使用的滤光片是否与染色试剂匹配。 <推荐的滤光片> · 荧光显微镜:激发(500-540 nm),荧光(530-570 nm) · 流式细胞仪:激发(488 nm), 荧光(500-540 nm) ②各working solution是否为现配现用。 ③延长染色时间 添加SPiDER-βGal working solution后,培养30 min后无法观察到荧光的话,考虑延长至45-60 min再进行荧光观察。 |
| Q9: 确认含有SA-β-Gal的细胞染色后,是否可以进行细胞固定? |
| A9: 可以。建议使用4%的多聚甲醛进行细胞固定。 |
| Q10: 培养基中的血清和酚红是否会影响检测? |
| A10: 培养基中的血清和酚红对SA-β-gal的检测没有影响。 |
| Q11:衰老细胞和正常细胞没有差异时,应该怎么确认? |
| A11: STEP1:优化显微镜的观察条件。
STEP2:如果优化观察条件仍无法解决,请对染色条件进行优化。
|
| Q12.如何准备药物阳性对照组 |
| A12:参考如下案例
衰老诱导(阿霉素处理的WI-38细胞) 1.将第3代的WI-38细胞(1×10^6细胞/皿,MEM,10%胎牛血清,1%青霉素-链霉素)接种在10 cm培养皿中,并在5%CO2中于37℃培养箱中培养过夜。 |
| 固定细胞成像 1.在8孔ibidi中准备细胞进行测定,并在5%CO2恒温箱中于37℃过夜培养细胞。 2.除去培养基。 用PBS洗涤细胞一次。 向细胞中加入4%多聚甲醛(PFA)/ PBS溶液,并在室温下孵育3分钟。 3.除去上清液。 用PBS洗涤细胞两次。 4.混合SPiDER-βGal工作溶液(2 mL)和1mg / mL Hoehst 33342(2μl)。 将混合溶液(200μl)加入孔中,并在37℃孵育30分钟。 *我们建议不要在固定细胞实验中使用5%CO2培养箱。如果在5%CO2培养箱中进行培养,则缓冲液的pH值可能会呈酸性。 酸性pH导致内源性β-半乳糖苷酶活性的背景升高,因此很难区分正常细胞和衰老细胞。 5.除去上清液。 用PBS洗涤细胞两次。 6.在荧光显微镜下观察细胞。 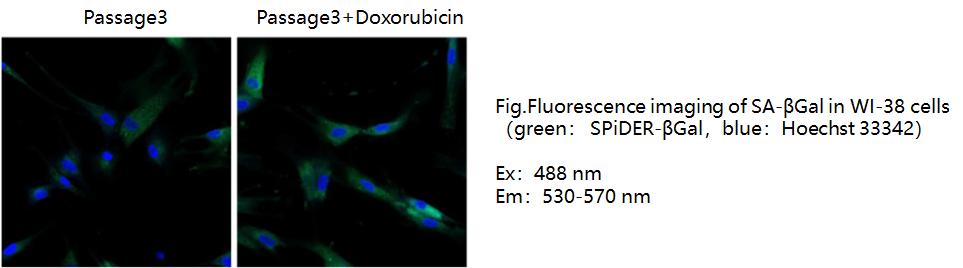 |
文献
| 细胞种类 | 标题及链接 | 仪器 | IF
因子 |
| Cancer cells | The chemistry of senescence | 荧光 | 30 |
| Vascular Cells | b-Hydroxybutyrate Prevents Vascular Senescence through hnRNP A1-Mediated Upregulation of Oct4 | 荧光 | 14 |
| RAW 264.7
(小鼠单核巨噬细胞白血病细胞) |
The CD153 vaccine is a senotherapeutic option for preventing the accumulation of senescent T cells in mice | 荧光 | 11.8 |
| HT-1080
(人纤维肉瘤细胞) |
Typhoid toxin exhausts the RPA response to DNA replication stress driving senescence and Salmonella infection | 荧光 | 11.8 |
| OVCAR-3 Cell:人卵巢腺癌细胞系 | Author Manuscript Published OnlineFirst on December 19, 2019; | 流式 | 8.3 |
| neck tumor cells | Interference with the bromodomain epigenome readers drives p21 expression and tumor senescence | 荧光 | 6.5 |
| VZ/SVZ cells | Ecrg4 deficiency extends the replicative capacity of neural stem cells in a Foxg1-dependent manner | 荧光 | 5.7 |
| 骨髓源性间充质干细胞(BMSCs) | Bone marrow-derived mesenchymal stem cells in three-dimensional co-culture attenuate degeneration of nucleus pulposus cells Bone marrow-derived mesenchymal stem cells in three-dimensional co-culture attenuate de | 荧光 | 5.5 |
| 肾组织石蜡切片 | Mitochondrial Protection Partly Mitigates Kidney Cellular Senescence in Swine Atherosclerotic Renal Artery Stenosis,Cellular Physiology and Biochemistry,2019,52,617-632 | 荧光 | 5.1 |
| A549细胞
PC-9人肺癌细胞 |
Novel drug-resistance mechanisms of pemetrexed-treated non-small cell lung cancer,Oncotarget,2018,9(24),16807-1682 | 荧光 | 5.1 |
| 人乳腺癌细胞 | Different sensitivities of senescent breast cancer cells to immune cell-mediated cytotoxicity,Cancer Science, 2019,110,2690–2699 | 流式/荧光 | 4.7 |
| HaCaT细胞系 | Particulate matter-induced senescence of skin keratinocytes involves oxidative stress-dependent epigenetic modifications,Experimental & Molecular Medicine,2019,51, Article number:108 | 荧光 | 4.7 |
| 脂肪来源干细胞
(ADSC) |
Antioxidants inhibit cell senescence and preserve stemness of adipose tissue-derived stem cells by reducing ROS generation during long-term in vitro expansion,Stem Cell Research & Therapy, 2019,10(1),306 | 荧光 | 4.6 |
| HaCaT细胞系 | Effect of Fermented Fish Oil on Fine Particulate Matter-Induced Skin Aging | 流式/荧光 | 4.3 |
| HCT 116
(人结肠癌细胞) |
Heat shock protein 27 promotes cell cycle progression by down-regulating E2F transcription factor 4 and retinoblastoma family protein p130 | 荧光 | 4.1 |
| immortalized cells | Improved Isolation of Mesenchymal Stem Cells Based on Interactions between N-Acetylglucosamine-Bearing Polymers and Cell-Surface Vimentin | 荧光 | 3.9 |
| PC12 cells | b-Asarone Inhibits Amyloid-b by Promoting Autophagy in a Cell Model of Alzheimer’s Disease | 荧光 | 3.8 |
| 卵母细胞和卵子 | Activity and intracellular localization of senescence-associated β-galactosidase in aging Xenopus oocytes and eggs | 荧光 | 3 |
| 胶原酶法分离小鼠角膜基质 | Anti-inflammatory activities of Ophiopogonis Radix on hydrogen peroxide-induced cellular senescence of normal human dermal fibroblasts,Journal of Natural Medicines,2018,72(4):905-914 | 流式 | 2.3 |
| 成纤维细胞
(NHDF) |
Anti‑inflammatory activities of Ophiopogonis Radix on hydrogen peroxide‑induced cellular senescence of normal human dermal fibroblast | 荧光 | 1.92 |
| WI-38
(人肺成纤维细胞) |
Changes in MCM2–7 proteins at senescence | 荧光 | 0.8 |
| 骨髓间充质干细胞 | Obesity is associated with senescence of mesenchymal stromal cells derived from bone marrow, subcutaneous and visceral fat of young mice | 流式 |
关联产品