特点:
· 检测时间短
· 固定和不固定都可以
· 悬浮细胞和贴壁细胞都可以

关联产品




实验工具稀释计算器摩尔浓度计算器

特点:
· 检测时间短
· 固定和不固定都可以
· 悬浮细胞和贴壁细胞都可以


关联产品




实验工具稀释计算器摩尔浓度计算器
特点:
● 高特异性脂滴定位
● 可进行组织脂滴成像
● 多种颜色可供选择


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. FerroOrange 细胞亚铁离子检测
NO.3. Glucose Assay Kit-WST 葡萄糖检测
NO.4. Liperfluo 细胞脂质过氧化物检测
NO.5. MitoPeDPP 线粒体内脂质过氧化物检测
概述
Lipi系列探针是高脂肪亲脂性小分子探针,其在疏水环境例如脂滴中发出强荧光。活细胞和固定细胞中的脂滴都可以使用本试剂清楚地观察。
原理
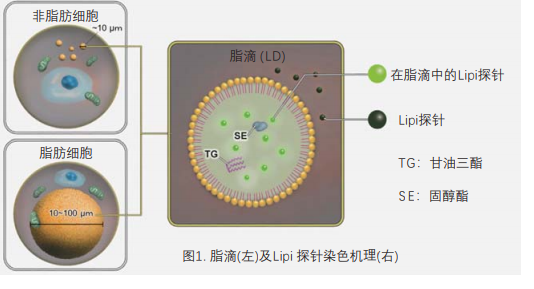
脂滴(脂肪滴,Lipid droplets, LDs)由中性脂肪组成,主要包括甘油三酯和胆固醇酯,其外层被一层单层磷脂分子包裹。而且脂滴不仅在脂肪细胞中存在,在真核生物中也普遍存在。最新的研究表明,以前认为脂滴仅是一个简单的脂质储存器,但最近的研究表明其在调节脂质代谢1),自噬2)和细胞衰老3)等方面都起着重要作用,因此需要进一步详细地研究脂滴形成·成长·融合·分解的机制。Lipi系列探针是高脂肪亲油性小分子探针,可在疏水环境例如脂滴中发出强荧光。Lipi探针染色后,无须洗涤即可观察到脂滴。
1) T. Fujimoto et al., “Lipid droplets: a classic organelle with new outfits.” Histochem Cell Biol., 2008, 130(2), 263.
2) R. Singh et al., “Autophagy regulates lipid metabolism.” Nature, 2009, 458(7242), 1131.
3) M. Yokoyama et al., “Inhibition of endothelial p53 improves metabolic abnormalities related to dietary obesity.” Cell Reports, 2014, 7(5), 1691.
脂滴的染色例
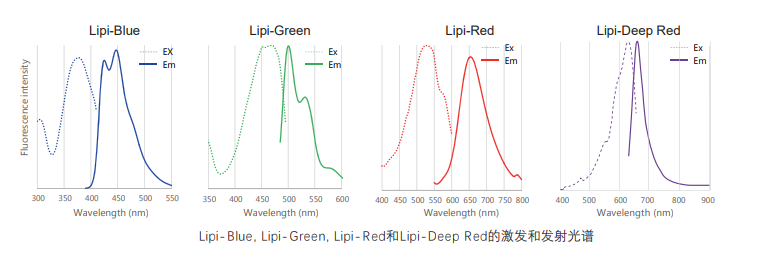
在活细胞状态下,用油酸诱导HeLa细胞后,用不同颜色的Lipi系列荧光探针检测
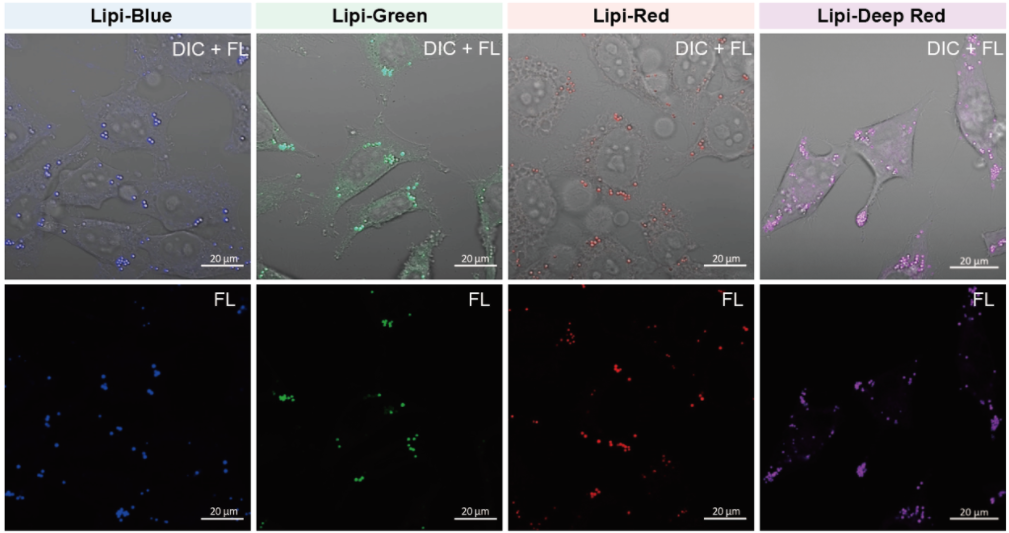
检测条件:
* Lipi-Blue :Ex:405 nm, Em:450–500 nm
* Lipi-Green:Ex:488 nm, Em:500–550 nm
* Lipi-Red:Ex:561 nm, Em:565–650 nm
* Lipi-Deep Red:Ex:640 nm, Em:650–700 nm
染色条件:
在HeLa细胞培养基中加入200 μmol/l油酸,过夜培养后,用PBS清洗细胞,并分别加入不同颜色的Lipi探针(Lipi-Blue/Green/Deep Red:0.1 μmol/l、Lipi-Red: 1 μmol/l) 染色15 min后观察。
如何制备油酸溶液
请参考Q&A“油酸溶液的制备和加入细胞的方法”。
与竞争品比较
Lipi系列荧光探针大幅度地改善了现有脂滴染色试剂存在的问题 (如选择性,滤波器的适应性,荧光滞留性)。而且 Lipi系列荧光探针也适用于多重染色实验,可选颜色更多。
| 同仁化学试剂 | 其他品牌(T公司) | ||||||
| Lipi-Blue | Lipi-Green | Lipi-Red | Lipi-Deep Red | Oil Red O
(比色) |
Nile Red | 试剂B | |
| 活细胞染色 | 〇 | 〇 | 〇 | 〇 | × | 〇 | 〇 |
| 固定细胞染色 | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 |
| 对脂肪滴的选择性 (低背景) |
〇 | 〇 | 〇 | 〇 | × | × | △ |
| 与其他试剂的共染色*1 | 〇 | 〇 | 〇*2 | 〇 | n.d. | ×*3 | 〇 |
| 活细胞内的滞留性(24h) | 〇 | 〇 | × | × | n.d. | × | × |
*1. 关于共染色时推荐的荧光滤光片,您可以参考网页下方Q&A“共染时推荐的荧光滤光片”。
*2. 与绿色荧光共染色时,推荐使用550 nm以下的绿色荧光滤光片。
*3. 用GFP的滤光片(500~540 nm)时会串色。
产品特点
特点1:与抗体检测方法高度相关
用4%PFA固定HepG2细胞后,用1 μmol/l Lipi-Red 染色。 然后在脂滴膜上用抗ADFP抗体荧光标记,免疫染色,该抗体可以特异性标记脂滴膜上的蛋白质 (Adipophilin; ADFP)。实验证明Lipi-Red 与脂滴上蛋白质ADFP的定位高度相关。
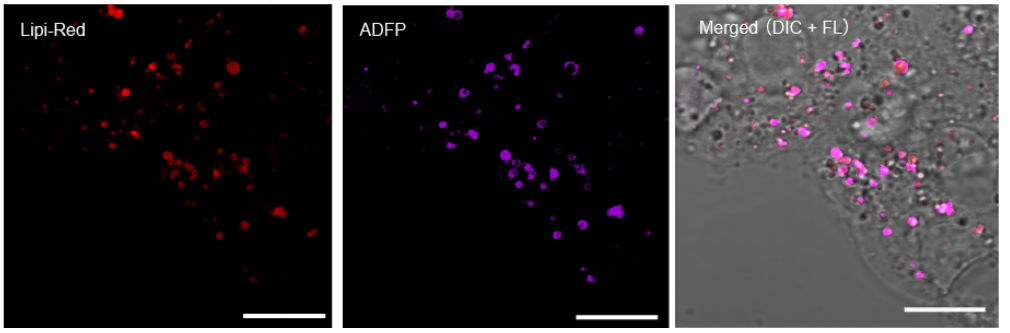
<检测条件>
Lipi-Red:Ex: 405 nm / Em: 450-500 nm,
抗ADFP抗体(Alexa Fluor 647):Ex: 640 nm / Em: 650-700 nm
特点2:高特异性定位脂滴
在HeLa活细胞中加入油酸,并用1μmol/L Lipi-Red和100 nmol/l Nile Red(T公司)染色。该结果显示Nile Red会染上脂滴以外的其它细胞质。
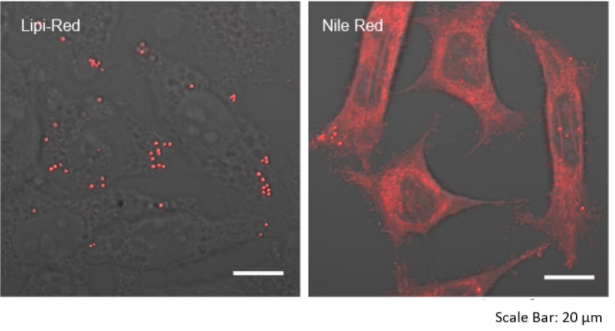
<检测条件>
Lipi-Red: Ex: 561 nm / Em: 565 – 650 nm
Nile Red:Ex: 561 nm / Em: 565-650 nm
特点3:光谱范围更窄,不易串色(Lipi-Red vs Nile Red)
在单通道情况下,Lipi Red和Nile Red(T公司)染色HepG2会用G激发观察红色荧光。而在多重染色情况下,可能会用B激发观察绿色荧光,此时Nile Red会出现串色现象。
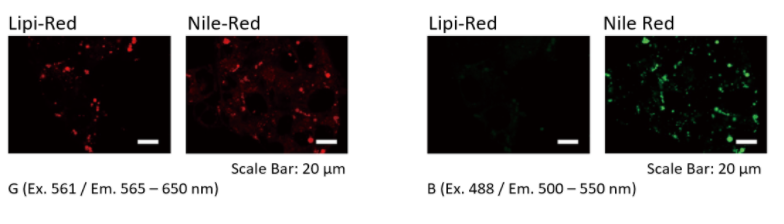
在用Lipi-Red染色的细胞中,确认了由于G激发引起的红色荧光,并且没有确认由于B激发引起的绿色荧光泄漏。 另一方面,在用尼罗红染色的细胞中,观察到由于G激发引起的红色荧光,但是由于B激发而观察到绿色荧光的泄漏。
特点4:荧光在细胞中的滞留时间长
分别用Lipi系列、Nile Red和市售的试剂B染色HepG2细胞,观察在培养30 min和24 h的荧光图像。

实验例
用Lipi系列染色3T3-L1前脂肪细胞,可以清楚地检测出脂肪细胞中的脂质。
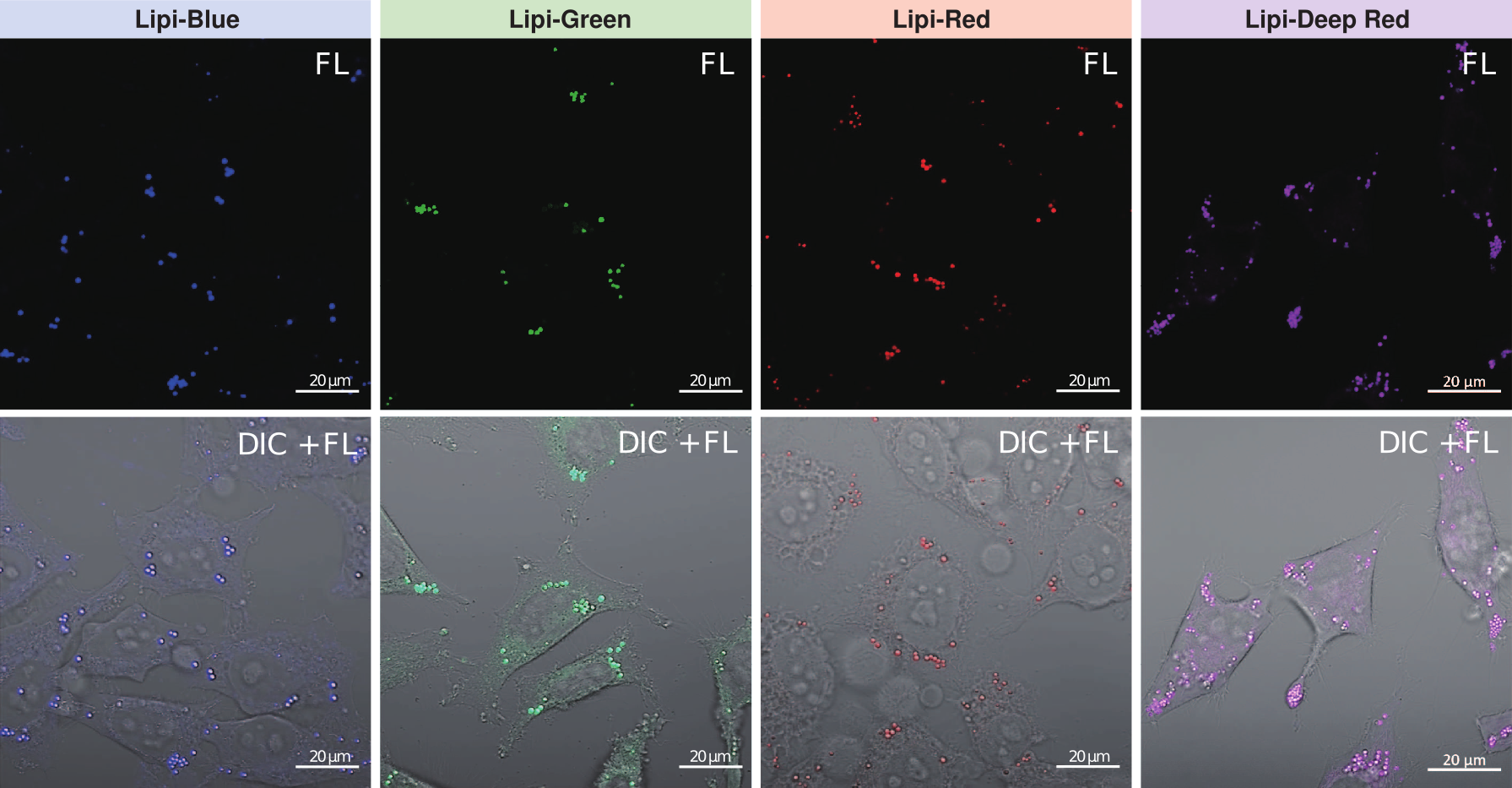
<脂肪细胞染色实验例>
(1)将3T3-L1细胞(1.5×104cells/孔)接种在µ-Plate 96孔板(ibidi)的各孔中,并在37℃ 5% CO2培养箱内培养。
(2)按照常规方法诱导分化为脂肪细胞。
(3) 去除上清液,用DMEM(25 mmol/l葡萄糖, 10% FBS, 无酚红)洗涤两次。
(4)加入用DMEM(25 mmol/l葡萄糖,10%FBS,无酚红)制备的每种染料的工作溶液,并在37℃下培养24 h。
(5)用荧光显微镜观察。
※试剂浓度:各2.5 µmol/l
实验例2:脂肪组织的脂滴成像
用4%PFA固定小鼠肝脏脂肪组织(冰冻切片)后用Lipi系列染色,比较幼鼠(6周龄)和老年小鼠(31周龄)的脂滴成像图像,发现肝脏脂肪组织中的脂滴量有很大差异。

<组织样品的染色实验例>
(1)向小鼠肝脏脂肪组织(冰冻切片)中加入4%PFA(PBS),在室温下静置5 min。
(2)用PBS清洗后,加入各浓度的Lipi系列working solution(PBS),在4℃下静置24 h。
(3)用PBS清洗后,用落射型荧光显微镜进行荧光观察。
※工作液浓度:2.5 µmol/l(Lipi-Blue、Lipi-Green、Lipi-Deep Red)、25 µmol/l(Lipi-Red)
实验例3:使用细胞成像仪进行定量分析
将油酸或Triacsin C(acyl-CoA synthetase抑制剂)分别加入到HepG2细胞中,并比较脂滴的变化。在分析中,我们使用共聚焦定量细胞成像仪(横河电机株式会社 CQ1)获得每个细胞脂滴数量和面积的数据。
脂肪滴和细胞核的成像
使用共聚焦定量细胞成像仪在617/73 nm处拍摄脂滴图像,在447/60 nm处拍摄细胞核图像,在分析软体CellPathfinder中识别单个脂滴和细胞核,并计算其数量和面积。
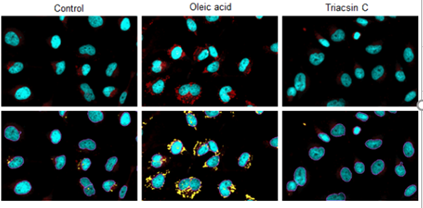
横河电机CQ1拍摄条件
使用板:96 well plate,物镜:20倍
激发波长 :405 nm (DAPI):):蓝色、561 nm (Lipi-Red): 红色
紫框线:细胞核、黄框线:脂滴
脂滴数量及面积的分析
根据细胞核和脂滴的检测数据,每个细胞的脂滴的数量和面积如图所示。结果,加入油酸的脂滴增加了7-13倍,而加入Triacsin C抑制了脂滴的形成,脂滴数量减少到Control组的60%。
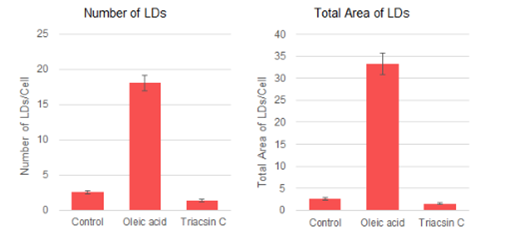
细胞处理及脂滴染色条件
将HepG2细胞(1×103cells)接种到96孔板中过夜培养。除去培养上清液后,加入未处理(仅含FBS的DMEM培养基)、油酸(含200 μmol/l油酸和FBS的DMEM培养基)或Triacsin C(含5 μmol/l Triacsin C和FBS的DMEM培养基)过夜培养。之后用PBS 清洗2次,用4%的PFA在室温下固定5 min后,用PBS 清洗2次。最后,加入1 μmol/l Lipi-Red working solution 在室温、避光下染色2 h后,用共聚焦定量细胞成像仪进行定量分析。
Lipi系列荧光图谱
脂肪滴产品种类的检测方法
| 产品名称 | 规格 | 货号 | |||
| 成像(成像)
脂滴荧光探针 |
Lipi-Blue | 10 nmol | LD01 | ||
| Lipi-Green | 10 nmol | LD02 | |||
| Lipi-Red | 100 nmol | LD03 | |||
| Lipi-Deep Red | 10 nmol | LD04 | |||
| 定量(荧光酶标仪,FCM) 脂滴荧光检测试剂盒 |
Lipid Droplet Assay Kit – Blue | 1 set | LD05 | ||
| Lipid Droplet Assay Kit – Deep Red | 1 set | LD06 | |||
常见问题Q&A
| Q1:油酸溶液的制备和加入细胞的方法 |
| A1:我们按照以下步骤制备和使用油酸溶液。 <油酸储存溶液> 必要的试剂 ·BSA(牛血清白蛋白) ·油酸 ·0.1 mol/l Tris-HCl(pH8.0) 制备步骤 1)在0.1 mol/l Tris-HCl(pH8.0)中加入BSA并溶解(BSA:浓度0.14 g/ml)。 2)在容器(一次性的离心管)中加入油酸后,加入步骤1)得到的BSA溶液,使用涡旋振荡器进行混合(油酸浓度:4 mmol/l)。*1 3)用孔径为0.22 µm的注射式过滤器(PTFE)过滤步骤2)的混合溶液。 4)每次使用后冷藏保存。*2 * 1 油酸和BSA溶液混合可能导致液体混浊,继续摇动让油酸和BSA形成复合物使混浊会消失。 * 2 将所需量的油酸储备溶液加入到实验使用的培养基中,用于将油酸加入到细胞中。 <加入细胞的方法> 1)将细胞在37℃ 5%CO2培养箱内培养24 h。 2)用加入了油酸储备溶液的培养基(油酸的终浓度200 µmol/L)替换,再培养24 h。 3)然后按照说明书对脂滴进行荧光染色观察。 |
| Q2:共染时推荐的荧光滤光片。 |
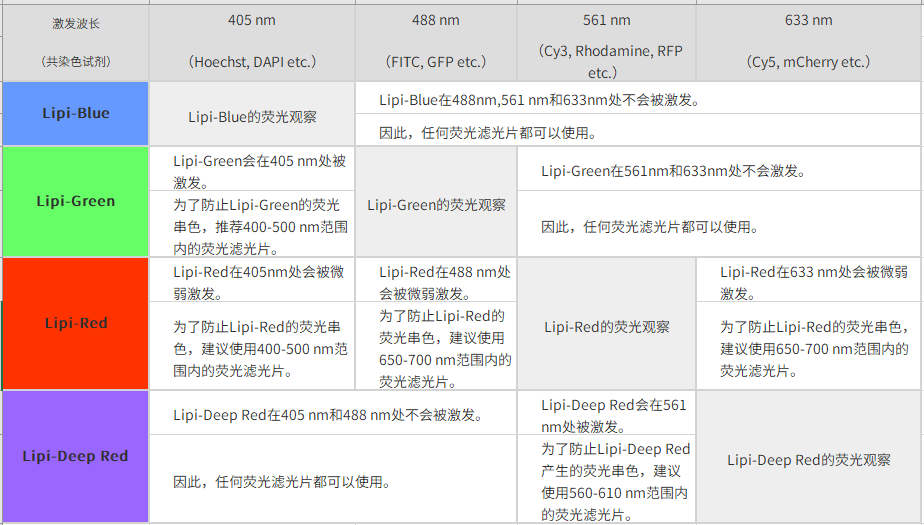
|
| Q3:检测不到荧光信号的应对方法是什么? |
| Q4如果没有检测到荧光信号,可能会有几个因素。 请确认以下内容,并根据情况考虑优化条件。 1.激发·发射波长与染料的荧光特性不一致。 确认说明书上的荧光图谱和您仪器的激发和发射波长是否匹配。 2.染色条件不是最合适的。 [试剂浓度] 确认工作液的浓度是否在以下范围内。 Lipi-Blue,Lipi-Green:0.1-0.5μmol/l Lipi-Red:1-5μmol/l *如果在上述条件下仍未检测到荧光信号,请提高染色浓度。 Lipi-Blue,Lipi-Green:1-2μmol/l Lipi-Red:10-20μmol/l [染色时间] -一般是30min,如没有荧光信号可以延长染色时间至1-2 h。 3.固定条件不适合。 根据细胞种类不同,染色前后的固定操作可能会导致无法染色或灵敏度减弱。 在这种情况下,“请参考Q&A:是否可以对固定细胞进行染色?。 4.脂滴小,难以确认。 根据细胞的不同,可能会有脂滴很小难以确认的情况。 这种情况下,我们建议在高倍率的显微镜下确认,或用油酸处理细胞作为阳性对照进行评估。 |
| Q4:是否可以对固定细胞进行染色? |
| A4:可以染色,固定细胞的染色步骤有以下注意事项: ※请用多聚甲醛 (PFA) 固定细胞,不建议用甲醇等醇类固定细胞,因为可能会影响脂滴的结构。 ※部分细胞种类染色后,如果在固定细胞过程中出现无染色或染色强度不够的情况,需要摸索最佳固定条件。 ○细胞染色后固定实验例 (以HepG2细胞为例) 1. 将HepG2细胞接种在µ-Slide 8孔板上,并在37℃ 5% CO2培养箱中过夜培养。 2. 去除培养基,用PBS清洗2次。 3. 在细胞中加入用PBS配制的Lipi工作液,在37℃培养箱中培养15 min。 4. 去除上清液,用PBS清洗2次。 5. 加入4% PFA (在PBS中),在室温固定5 min。 6. 去除上清液,用PBS清洗后,在荧光显微镜下观察。 ○细胞染色前固定实验例 (以HeLa细胞为例) 1. 将HeLa细胞接种在µ-Slide 8孔板上,并在37℃ 5% CO2培养箱中过夜培养。 2. 去除培养基,用PBS清洗2次。 3. 加入4% PFA (在PBS中),在室温固定5 min。 4. 去除上清液,用PBS清洗2次。 5. 在细胞中加入用PBS配制的Lipi工作液,在37℃培养箱中培养30 min。 6. 去除上清液,用PBS清洗后,在荧光显微镜下观察。 |
| Q5:绿色滤光片会有荧光泄露吗。 |
| A5:与市场上的Nile Red相比,Lipi-Red的泄漏较少,但根据滤光片的种类和激发光的强度,荧光又可能会泄漏到绿色滤光片中。在观察带有不同染料的绿色滤光片时,请注意以下几点。
·选择550 nm以下绿色荧光滤光片。 ·一边调整激发光的强度,一边检测荧光。 |
参考文献
1) Y. Tatenaka, H. Kato, M. Ishiyama, K. Sasamoto, M. Shiga, H. Nishitoh and Y. Ueno, “Monitoring Lipid Droplet Dynamics in Living Cells by Using Fluorescent Probes”, Biochemistry., 2019, DOI: 10.1021/acs.biochem.8b01071 .
2) M. Oka, N. Kobayashi, K. Matsumura, M. Nishio and K. Saeki, “Exogenous Cytokine-Free Differentiation of Human Pluripotent Stem Cells into Classical Brown Adipocytes”, Cells., 2019, 8, (4), 373.
关联产品
特点:
● 对超氧化物的选择性高
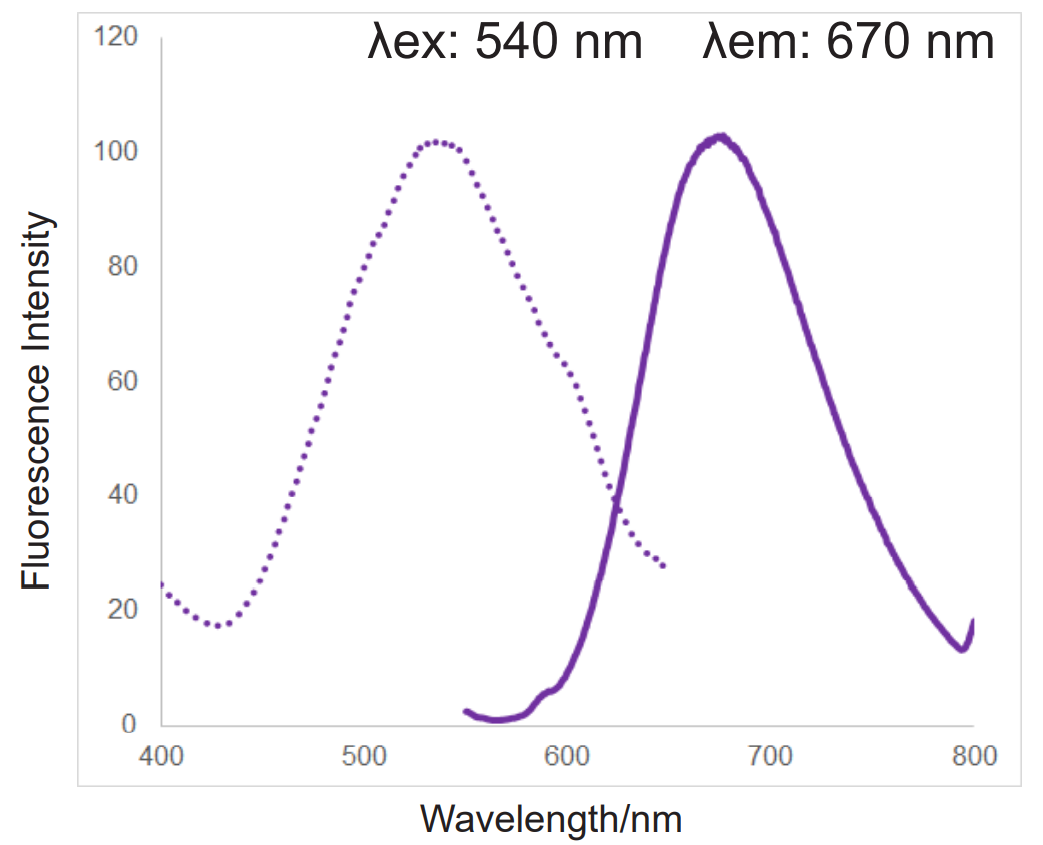
● 独特的荧光特性(λex: 540 nm; λem: 670 nm)


产品概述
线粒体在生成ATP的同时会生成超氧化物。正常情况下,细胞的抗氧化酶等物质会保护细胞免受活性氧的伤害。但是,当线粒体功能异常时,活性氧过量积累会造成细胞的各种机能紊乱。因此在评价细胞氧化应激水平时,往往需要同时检测线粒体的膜电位和线粒体的活性氧。
与其他试剂的比较
对各种活性氧的反应选择性
mtSOXDeep Red相较于T公司的产品Red,在各种活性氧中,对超氧化物的选择性更高。
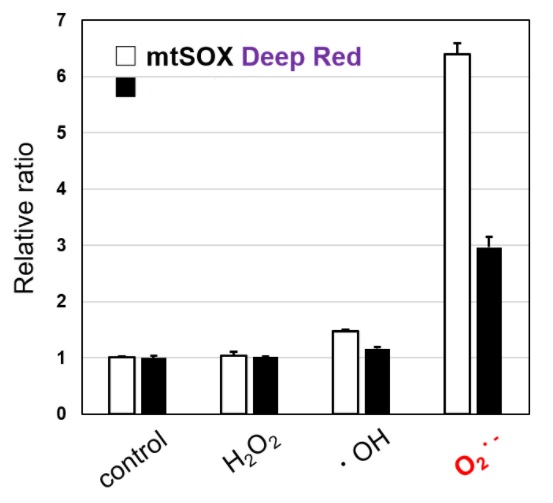
另外,与其他公司产品所不同的是,mtSOX Deep Red拥有独特的荧光特性(λex: 540 nm; λem: 670 nm),可以同时进行线粒体膜电位检测试剂(JC-1 货号MT09; MT-1 货号MT13)的共染色实验。
实验例
线粒体超氧化物和线粒体膜电位的同时检测
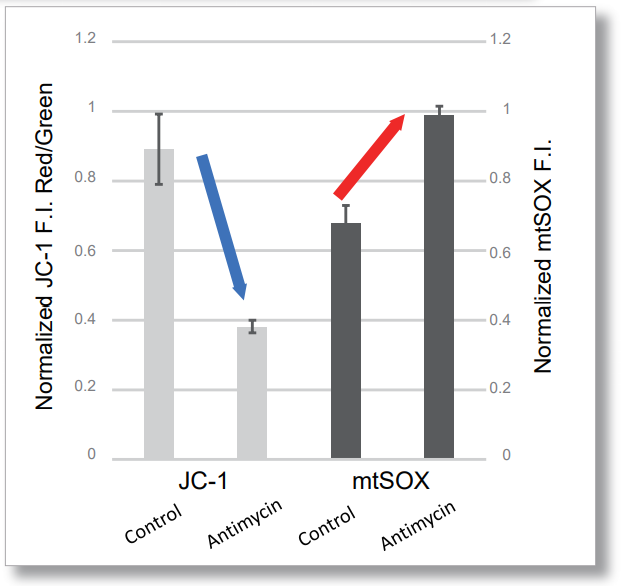
用HBSS清洗HeLa细胞后,使用mtSOX和同仁化学研究所的线粒体膜电位检测试剂(JC-1 货号MT09或MT-1 货号MT13)进行共染色实验,同时观察线粒体ROS和线粒体膜电位。
结果显示,伴随着线粒体ROS的产生,线粒体膜电位也逐渐降低。
<使用JC-1的实验操作>
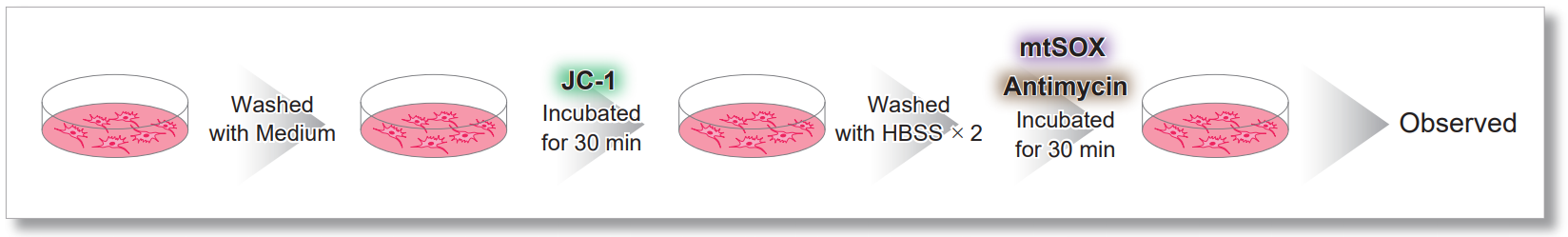
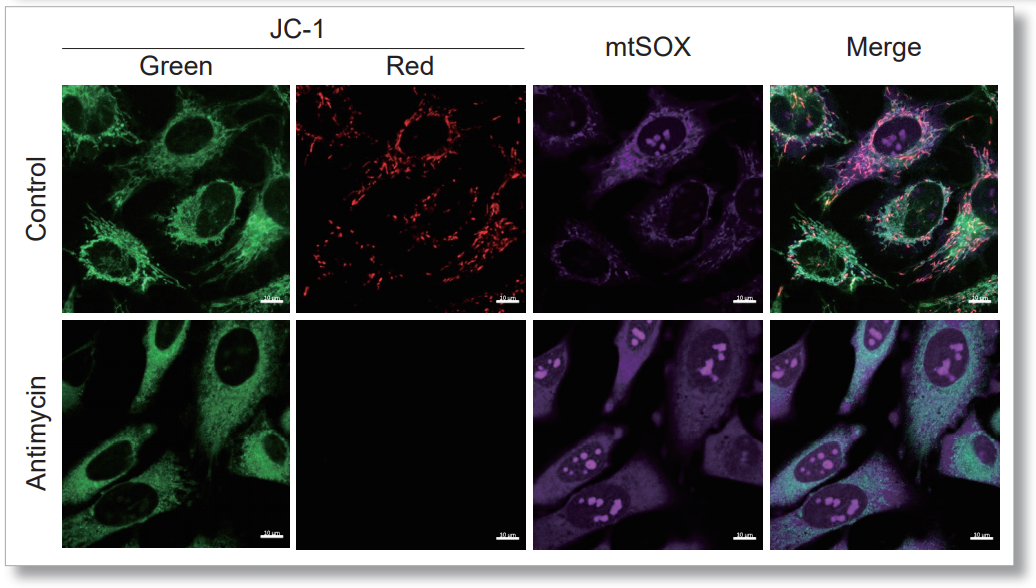
<检测条件>
JC-1:绿Ex=488 nm; Em= 490-520 nm; 红Ex=561 nm; Em= 560-600 nm
mtSOX:Ex=633 nm; Em= 640-700 nm
Scale bar: 10 μm
<检测条件>
JC-1:绿Ex=485 nm; Em= 535 nm; 红Ex=535 nm; Em= 595 nm
mtSOX:Ex=550 nm; Em= 675 nm
<使用MT-1的实验操作>
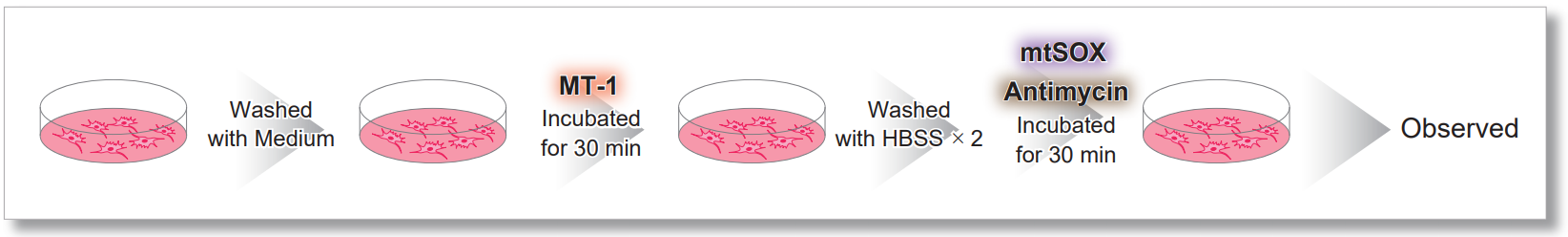
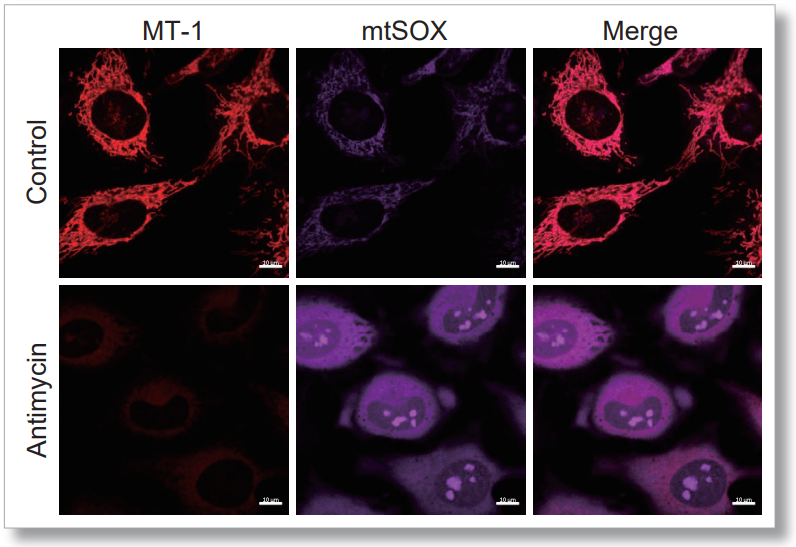
<检测条件>
MT-1: Ex=561 nm; Em= 560-600 nm
mtSOX:Ex=633 nm; Em= 640-700 nm
Scale bar: 10 μm

<检测条件>
MT-1: Ex=545 nm; Em= 600 nm;
mtSOX:Ex=550 nm; Em= 675 nm
细胞内Total ROS和线粒体超氧化物的同时检测
用HBSS清洗HeLa细胞后,使用mtSOX和同仁化学研究所的细胞内ROS检测试剂(ROS Assay Kit -Highly Sensitive DCFH-DA- 货号:R252)进行共染色实验,通过线粒体超氧化物诱导剂Antimycin或过氧化氢诱导后进行荧光观察。
结果显示,可以分别观察到细胞内ROS诱导后的荧光增强和线粒体的ROS诱导后的荧光增强。
<实验操作>
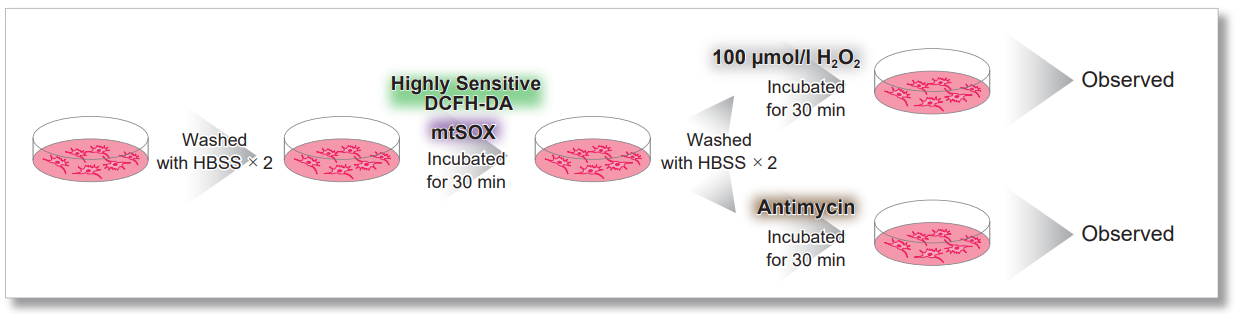
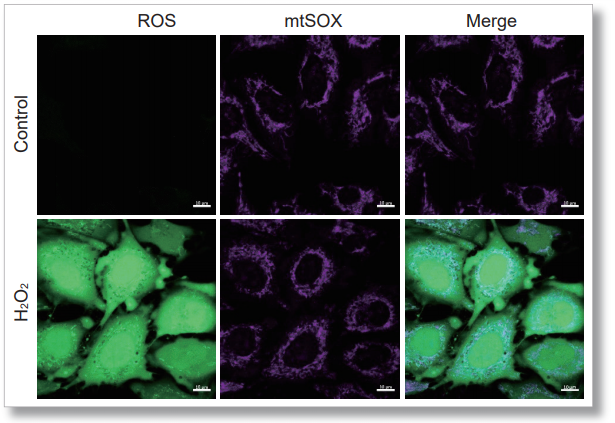
<Antimycin刺激的结果>
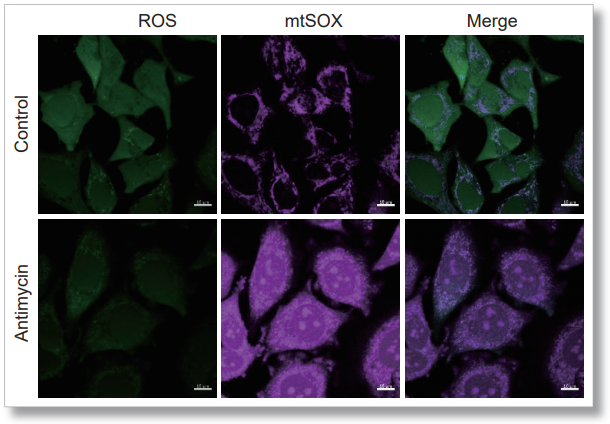
<检测条件>
细胞内ROS: Ex=488 nm; Em= 490-520 nm
mtSOX:Ex=633 nm; Em= 640-700 nm
Scale bar: 10 μm
衰老细胞线粒体超氧化物检测
提示:脂褐素内源性荧光最小化
脂褐素对细胞衰老研究的影响
众所周知,衰老细胞会积累被称为脂褐素的氧化损伤蛋白质,这些蛋白质不会被溶酶体降解。线粒体作为溶酶体中的不溶性物质,导致荧光观察过程中背景增加。在细胞衰老研究中,有必要尽量减少脂褐素或其他物质对内源性荧光的影响。
使用升级后的荧光探针
我们分别使用T公司的产品和Dojindo公司的mtSOX Deep Red-线粒体超氧化物检测用荧光染料,检测在增殖期(第2代)和衰老(第14代)TIG-1细胞(人胎肺来源的成纤维细胞)中观察到线粒体超氧化物。
结果显示:在T公司的产品(染色浓度:5 μmol/l)的情况下,除了在增殖细胞和衰老细胞中观察到线粒体荧光外,还观察到很强的荧光背景。从未染色细胞的图像中发现该背景荧光是内源性荧光。另一方面,当使用mtSOX Deep Red(染色浓度:1μmol/l)时,可以观察到线粒体超氧化物产生的荧光,而荧光背景的影响很小。在观察线粒体超氧化物时,重要的是比较灵敏度、波长和通道,然后用合适的荧光探针进行观察,以最大限度地减少内源性荧光的产生。
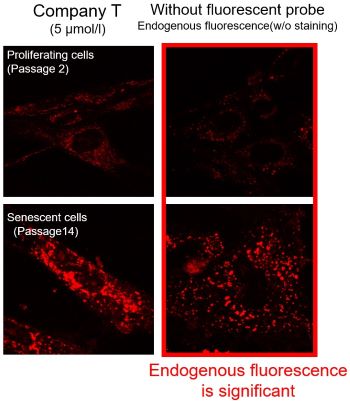
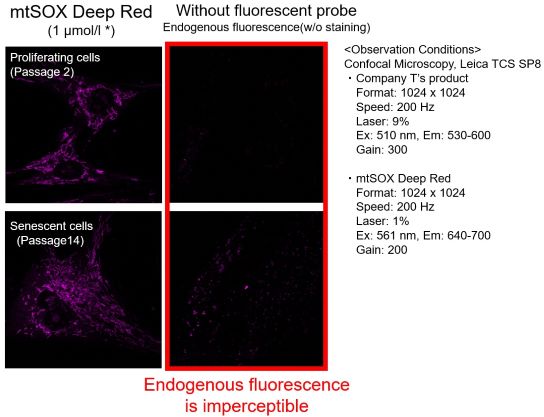
※mtSOX的最佳浓度因细胞而异。关于不同染色浓度下内源性荧光的不同影响的讨论,请参阅”常见问题Q&A”:解答当我观察衰老细胞时,发现线粒体外的荧光,应该如何处理?。
<实验数据>
本实验数据,由东京都老年病学研究所Fujita Yasunori教授友情提供。
<参考文献>
Y. Fujita, M. Iketani, M. Ito and I. Ohsawa, “Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts”, Exp. Gerontol., 2022, 165, 111866.
常见问题Q&A
| Q1:mtSOX Deep Red的检测原理是什么? |
| A1:mtSOX Deep Red被Superoxide特异性氧化后会发出荧光,同时它还可在线粒体处积累,因此可以检测线粒体Superoxide。伴随着Superoxide的增加,线粒体的膜电位消失的话,核小体和细胞质会被染料染色。 |
| Q2:每个试剂盒可以检测多少个样品? |
| A2:可检测的样品数如下。・ 96-well plate: 1块。
・ ibidi 8-well plate: 6块。 ・ 35 mm dish: 5块。 |
| Q3:是否可以用培养基以外的溶液配制Working solution? |
| A3:可以,可使用HBSS或PBS代替培养基。 |
| Q4:各检测仪器适用的滤光片? |
| A4:荧光显微镜、流式细胞仪、荧光酶标仪均可检测。
・激光共聚焦显微镜 Ex/Em: 561/640-700 nm (无红色荧光染料共染时) Ex/Em: 633/640-700 nm (与红色荧光染料共染时)
・荧光显微镜 TxRed Filter
・荧光酶标仪 Ex/Em: 535–565/660–690 nm
|
| Q5:是否可以刺激后再染色? |
| A5:在线粒体膜电位正常的前提下是有可能的。本染料依赖线粒体膜电位在线粒体处积累,因此如果药物刺激造成线粒体膜电位降低的话,染料将无法在线粒体处积累,影响检测结果。因此推荐先染色再进行药物刺激。 |
| Q6:当我观察衰老细胞时,发现线粒体外的荧光,应该如何处理? |
| A6:请检查以下两个实验参数
(1)检测条件 制备染色和未染色的细胞,并在内源性荧光最小化的条件下进行观察。 (2)染料浓度 mtSOX的最佳浓度取决于细胞等多因素;可考虑在1-10μmol/l的浓度范围下摸索。 (参考案例) TIG-1细胞(人胎肺来源的成纤维细胞,传14代)用1、10μmol/l浓度的mtSOX染色并观察。观察到1μmol/l的细胞具有较少的内源性荧光。
<实验数据> 本实验数据,由东京都老年病学研究所Fujita Yasunori教授友情提供。 |
产品文献
1、D. Sun, S. Cui, H. Ma, P. Zhu, N. Li, X. Zhang, L. Zhang, L. Xuan, J. Li , “Salvianolate ameliorates renal tubular injury through the Keap1/Nrf2/ARE pathway in mouse kidney ischemia-reperfusion injury”, 2022, J. Ethnopharmacol., doi:10.1016/j.jep.2022.115331.
2、Y. Fujita, M. Iketani, M. Ito, I. Ohsawa, “Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts”, 2022, Exp. Gerontol., doi:10.1016/j.exger.2022.111866.
3、R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, “Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER”, 2022, iScience, doi:10.1016/j.isci.2022.104603.
4、A. Patel, M. Simkulet, S. Maity, M. Venkatesan, A. Matzavinos, M. Madesh & B. R. Alevriadou, “The mitochondrial Ca2+ uniporter channel synergizes with fluid shear stress to induce mitochondrial Ca2+ oscillations”, 2022, Sci. Rep., doi:10.1038/s41598-022-25583-7.
5、Hao Gu, Yuhui Zhu, Jiawei Yang, Ruixue Jiang, Yuwei Deng, Anshuo Li, Yingjing Fang, Qianju Wu, Honghuan Tu, Haishuang Chang, Jin Wen, Xinquan Jiang,”Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration.Advanced Science”,2023, Advanced Science, doi:10.1002/advs.202302136
关联产品
特点:
● 标记稳定性强、特异性高
● 可用于免疫荧光共染色

规格性状

产品概述
线粒体不仅是细胞中产生能量的场所,也是与癌症、衰老、神经退行性疾病(例如,阿尔茨海默症、帕金森症)等密切相关的最重要的细胞器之一。
近年来,随着显微镜技术的发展,有关细胞器的研究正在由原来的“单独研究线粒体的机能””逐渐向“线粒体与其他细胞器之间的相互作用”的方向转移。因此,对于线粒体的更详细的形态观察需求越来越大。
MitoBright IM Red克服了其他染料的靶向标记稳定性差的问题,是一种可以用于免疫荧光共染色线粒体荧光探针。
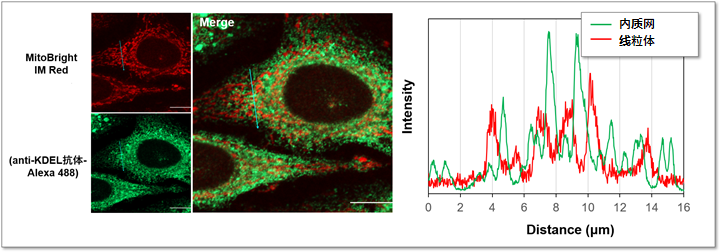
实验例:与内质网标记物KDEL的共染色
用MitoBrightIM Red标记HeLa细胞的线粒体,经固定化和膜透性处理后再用内质网标记物KDEL的抗体进行免疫共染色。并且在左图的箭头所示范围内进行了荧光强度的检测。从荧光图像可以清晰的观察线粒体与附近的内质网的形态。
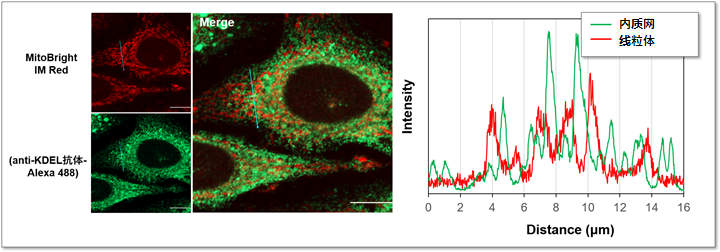
<检测条件>
MitoBright IM Red (红) Ex: 561 nm, Em: 560-620 nm
KDEL抗体-Alexa488 (绿) Ex: 488 nm, Em= 490-550 nm
Scale bar: 10 μm
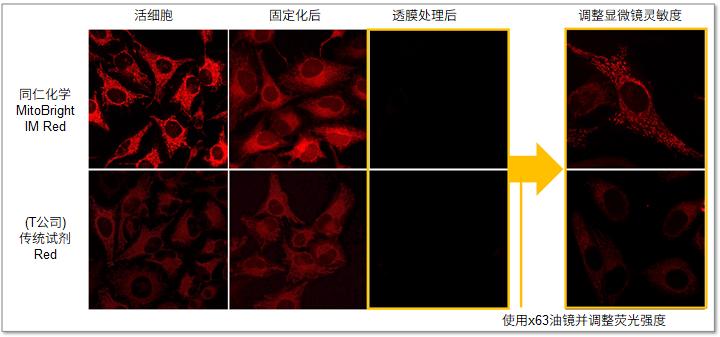
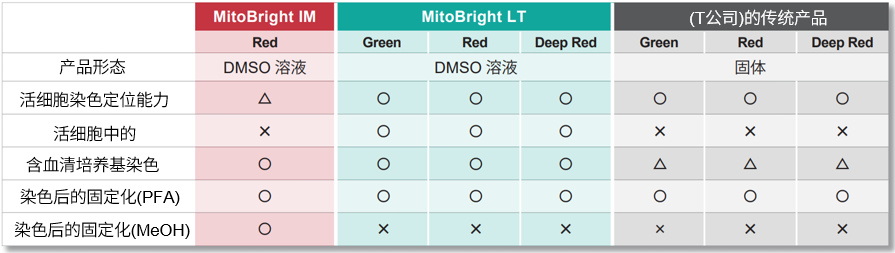
MitoBright IM Red与其他试剂的不同
传统的小分子荧光染料在染色后的固定化操作或透膜剂处理后,往往会失去靶向性。而MitoBright IM Red与其他染料相比,提高了靶向稳定性,可以抑制免疫荧光实验时固定化操作造成的荧光强度减弱等问题。
・荧光强度差的比较
MitoBright IM与(T公司的)传统荧光染料相比,在活细胞线粒体染色后的固定化处理和透膜剂处理后的荧光强度如下图所示。固定化处理和透膜剂处理后,荧光强度都有一定的下降,但是MitoBright IM比传统染料的靶向标记稳定性更高,因此可以观察到更清晰的线粒体染色情况。
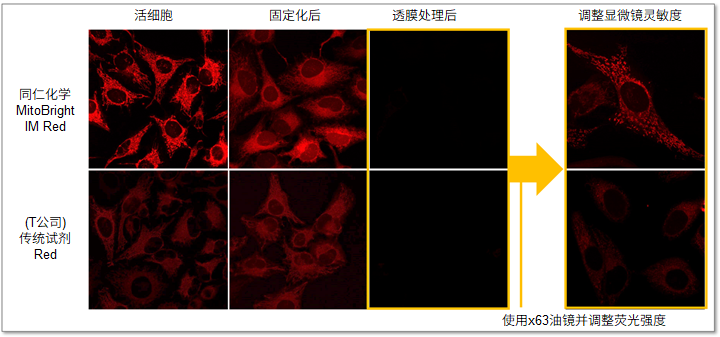
<检测条件>
Ex=561 nm; Em= 560-620 nm
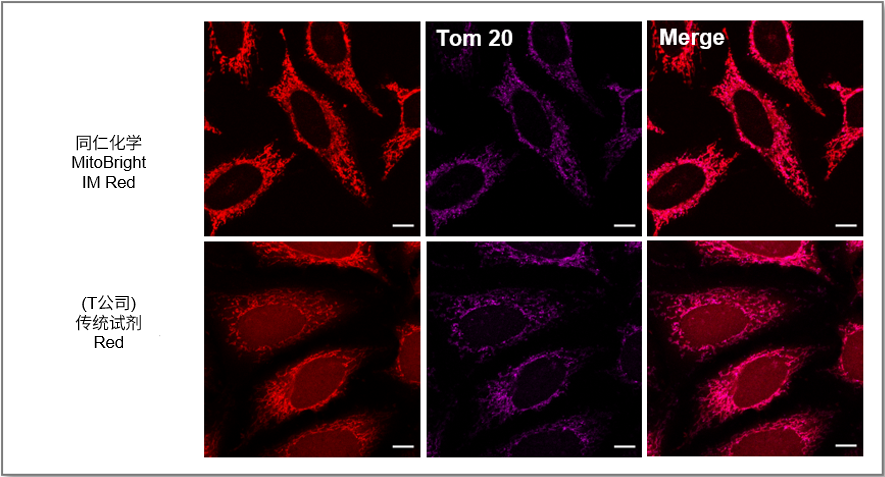
・荧光背景的比较
使用线粒体标记物TOM20抗体比较MitoBrightIM和传统试剂的免疫染色后的线粒体定位情况。 用MitoBrightIM和传统试剂对HeLa细胞进行染色,然后用TOM20抗体进行二抗免疫荧光染色。 结果显示, 用MitoBrightIM或现有试剂对HeLa细胞进行染色,然后用TOM20抗体进行二抗染色。 结果显示,传统试剂有扩散到线粒体以外区域的情况,导致背景很高,而MitoBrightIM的背景更低,而且定位与TOM20抗体一致。
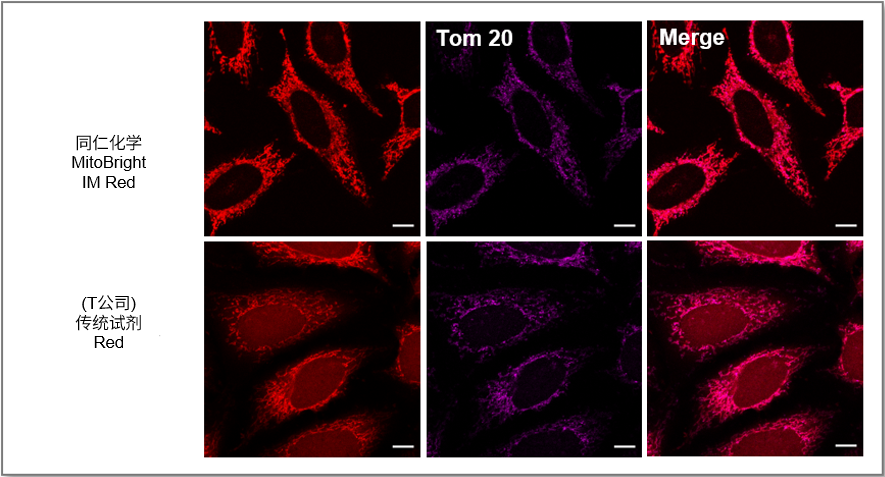
<检测条件>
Ex=561 nm; Em= 560-620 n
与传统试剂的对比
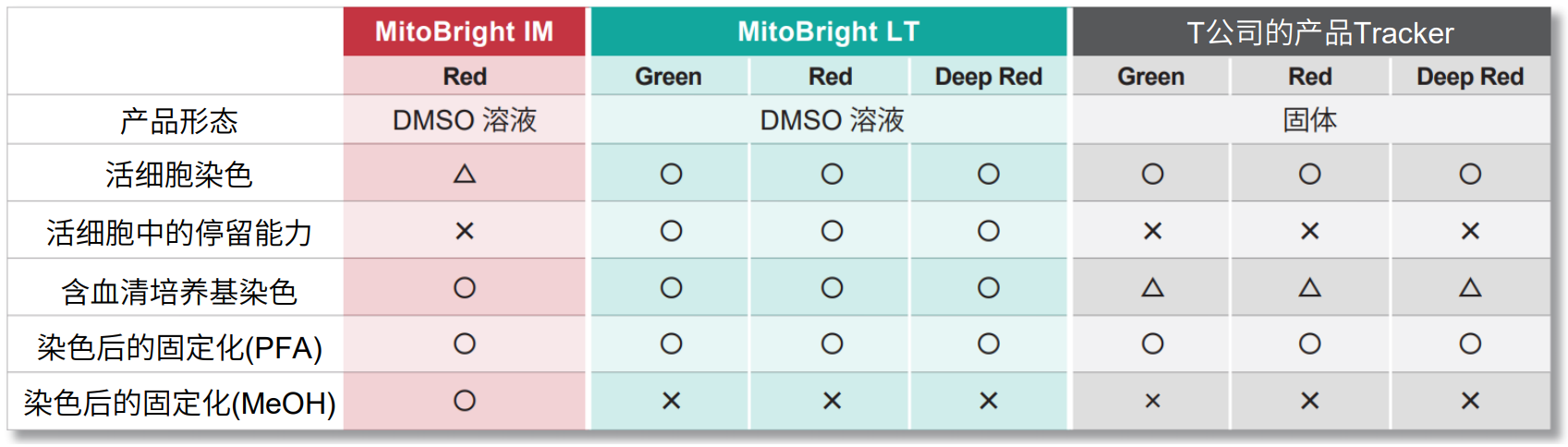
可检测的次数
| MitoBright IM Red
规格 |
荧光显微镜 |
| (35 mm dish, working solution 2 ml/dish时) | |
| 20 μl | 10 枚 |
| 20 µl x3 | 30 枚 |
荧光特性
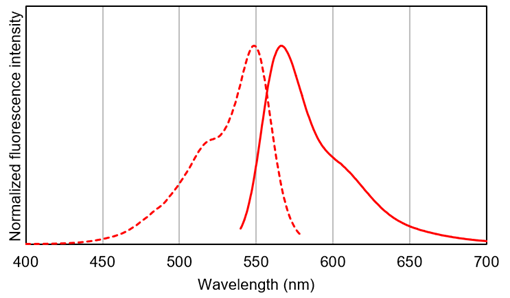
激发波长(λex) : 548 nm
发射波长(λem) : 566 nm
常见问题Q&A
| Q: MitoBright IM Red出厂就是是DMSO溶液状态,反复冻融是否会影响染色结果? |
| 我们做过反复冻融5次的稳定性实验,染色结果正常。如果长时间保存时需要反复冻融,保险起见建议提前分装,分开保存。 |
| Q:先药物刺激再进行MitoBright IM染色时,发现有荧光辉斑产生,请问是否有好的解决办法? |
| A:请在药物刺激前进行MitoBright IM的染色。 由于本试剂是依靠线粒体膜电位在线粒体处积累的,如果线粒体膜电位大幅降低,会导致试剂无法在线粒体处聚集。
(参考实验) 分别采用“先FCCP刺激后染色” 和“先染色后FCCP刺激” 的方法对HeLa细胞进行实验并观察荧光。 先进行MitoBright IM染色再FCCP刺激的实验组很顺利的观察到了荧光,而相反的实验组没有观察到荧光。
|
关联产品




特点:
● 标记稳定性强、特异性高
● 可用于免疫荧光共染色
规格性状

产品概述
线粒体不仅是细胞中产生能量的场所,也是与癌症、衰老、神经退行性疾病(例如,阿尔茨海默症、帕金森症)等密切相关的最重要的细胞器之一。
近年来,随着显微镜技术的发展,有关细胞器的研究正在由原来的“单独研究线粒体的机能””逐渐向“线粒体与其他细胞器之间的相互作用”的方向转移。因此,对于线粒体的更详细的形态观察需求越来越大。
MitoBright IM Red克服了其他染料的靶向标记稳定性差的问题,是一种可以用于免疫荧光共染色线粒体荧光探针。
实验例:与内质网标记物KDEL的共染色
用MitoBrightIM Red标记HeLa细胞的线粒体,经固定化和膜透性处理后再用内质网标记物KDEL的抗体进行免疫共染色。并且在左图的箭头所示范围内进行了荧光强度的检测。从荧光图像可以清晰的观察线粒体与附近的内质网的形态。
<检测条件>
MitoBright IM Red (红) Ex: 561 nm, Em: 560-620 nm
KDEL抗体-Alexa488 (绿) Ex: 488 nm, Em= 490-550 nm
Scale bar: 10 μm
MitoBright IM Red与其他试剂的不同
传统的小分子荧光染料在染色后的固定化操作或透膜剂处理后,往往会失去靶向性。而MitoBright IM Red与其他染料相比,提高了靶向稳定性,可以抑制免疫荧光实验时固定化操作造成的荧光强度减弱等问题。
・荧光强度差的比较
MitoBright IM与(T公司的)传统荧光染料相比,在活细胞线粒体染色后的固定化处理和透膜剂处理后的荧光强度如下图所示。固定化处理和透膜剂处理后,荧光强度都有一定的下降,但是MitoBright IM比传统染料的靶向标记稳定性更高,因此可以观察到更清晰的线粒体染色情况。
<检测条件>
Ex=561 nm; Em= 560-620 nm
・荧光背景的比较
使用线粒体标记物TOM20抗体比较MitoBrightIM和传统试剂的免疫染色后的线粒体定位情况。 用MitoBrightIM和传统试剂对HeLa细胞进行染色,然后用TOM20抗体进行二抗免疫荧光染色。 结果显示, 用MitoBrightIM或现有试剂对HeLa细胞进行染色,然后用TOM20抗体进行二抗染色。 结果显示,传统试剂有扩散到线粒体以外区域的情况,导致背景很高,而MitoBrightIM的背景更低,而且定位与TOM20抗体一致。
<检测条件>
Ex=561 nm; Em= 560-620 n
与传统试剂的对比
可检测的次数
| MitoBright IM Red
规格 |
荧光显微镜 |
| (35 mm dish, working solution 2 ml/dish时) | |
| 20 μl | 10 枚 |
| 20 µl x3 | 30 枚 |
荧光特性

激发波长(λex) : 548 nm
发射波长(λem) : 566 nm
常见问题Q&A
| Q: MitoBright IM Red出厂就是是DMSO溶液状态,反复冻融是否会影响染色结果? |
| 我们做过反复冻融5次的稳定性实验,染色结果正常。如果长时间保存时需要反复冻融,保险起见建议提前分装,分开保存。 |
| Q:先药物刺激再进行MitoBright IM染色时,发现有荧光辉斑产生,请问是否有好的解决办法? |
| A:请在药物刺激前进行MitoBright IM的染色。 由于本试剂是依靠线粒体膜电位在线粒体处积累的,如果线粒体膜电位大幅降低,会导致试剂无法在线粒体处聚集。
(参考实验) 分别采用“先FCCP刺激后染色” 和“先染色后FCCP刺激” 的方法对HeLa细胞进行实验并观察荧光。 先进行MitoBright IM染色再FCCP刺激的实验组很顺利的观察到了荧光,而相反的实验组没有观察到荧光。
|
特点:
● 流式细胞仪检测
● 可固定细胞
● 荧光不会泄露

产品概述
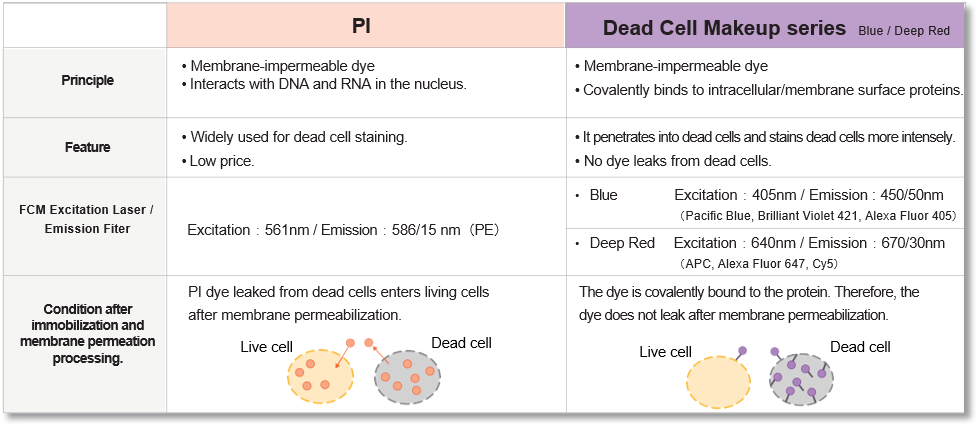
该试剂可与细胞表面和细胞内的蛋白质共价结合,对膜受损的死亡细胞进行强染色。此外,染色剂在固定和渗透细胞后不会渗漏。染色后,活细胞和死细胞的荧光强度差异显著,通过流式细胞仪分析,死细胞很容易区分和排除。
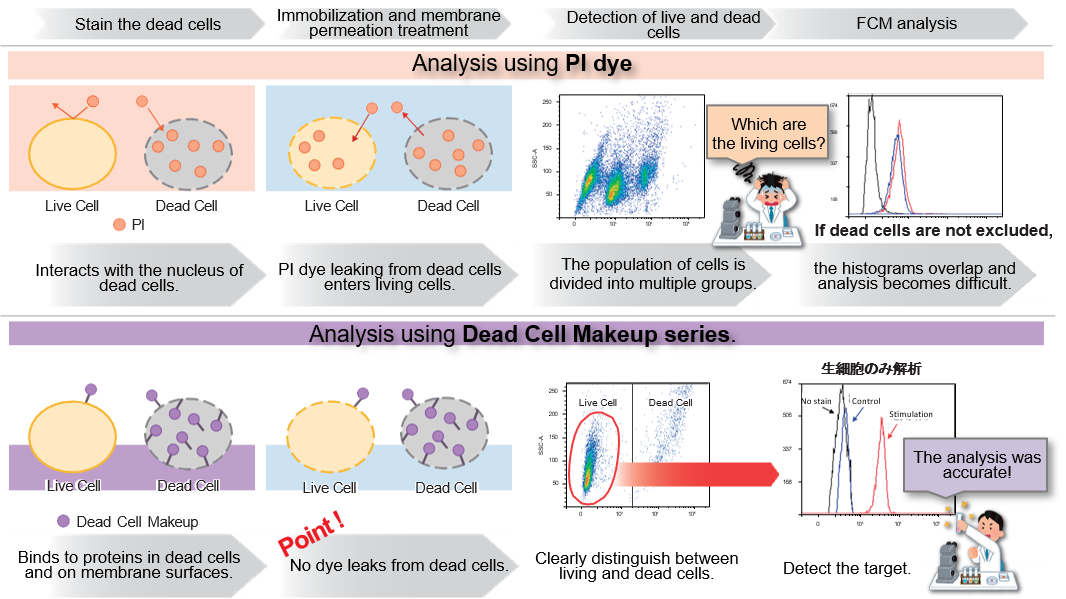
技术信息
区分和排除死细胞对使用流式细胞仪 (FCM) 获得准确数据至关重要,近年来,这一过程已成为发表论文时越来越常见的要求。碘化丙啶(PI)可用于区分死细胞,但细胞膜的固定或渗透会导致 PI 从细胞中渗出,从而难以获得准确的数据。这种试剂具有与细胞表面和细胞内部蛋白质共价结合的特性,因此即使细胞被固定或渗透后,染料也不会渗出。此外,染色后活细胞和死细胞的荧光强度差异很大,因此 FCM 可以轻松区分死细胞并将其排除在分析之外。
DMSO 储存溶液的保质期
本产品的 DMSO 储备溶液可冷冻保存六个月。
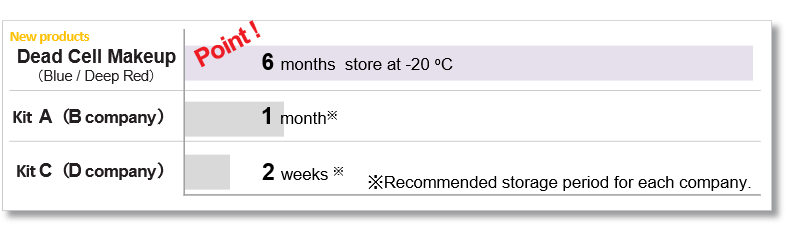
与现有 PI 方法的比较
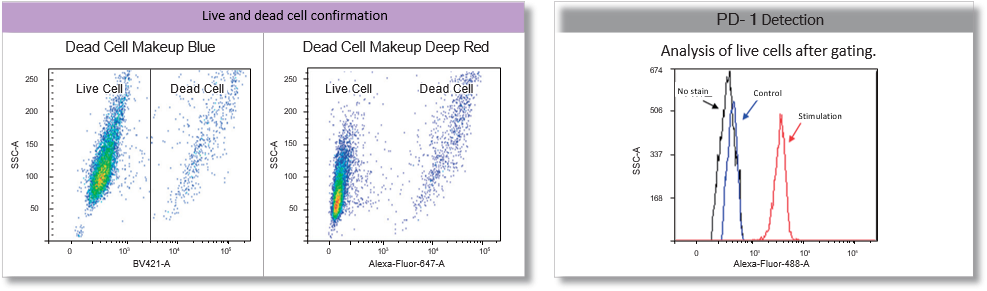
实验案例: 诱导 MOLT-4 细胞衰竭后的 PD-1 检测
MOLT-4 细胞在含有 Ionomycin(500 ng/ml)和 PMA(Phorbol 12-myristate 13-acetate,50 ng/ml)的 RPMI 培养基中刺激 48 小时。死细胞用本品染色,PD-1 表达用免疫染色法检测(一抗:抗 PD-1 小鼠抗体,二抗:抗小鼠抗体-Alexa488)。结果表明,死细胞和活细胞可以清楚地区分开来,而且在只选取活细胞的情况下,受刺激细胞组的 PD-1 表达升高。
实验步骤

试验结果
常见问题Q&A
| Q1:能否测量贴壁细胞? |
| A1:可对贴壁细胞进行检测。用胰蛋白酶消化细胞或用刮板收集细胞,以制备细胞悬液。 |
| Q2:胰蛋白酶会干扰测量吗? |
| A2:通过以下实验证实胰蛋白酶对 HeLa 细胞的影响。我们将胰蛋白酶处理与使用刮板进行了比较,确认两种情况下的分析结果没有区别。
|
| Q3:是否可以用显微镜进行观察? |
| A3:我们已经证实,可以对染色后的 HeLa 细胞进行成像。用这种染料染色的 HeLa 细胞在固定和膜渗透后的成像结果如下。
|
| Q4:染色是否会产生细胞毒性? |
| A4:使用CCK-8 来评估染色对 HeLa 细胞的细胞毒性,结果显示几乎没有细胞毒性。 |
| Q5:染色后能否保存固定的细胞? |
| A5:不建议保存。由于荧光强度在固定后会随着时间的推移而降低,因此染色后的样本应在当天进行检测。 |
| Q6:DMSO stock solution的稳定性如何? |
| A6:该产品在 -20°C 下冷冻保存 6 个月是稳定的。本品受潮后会降解;如果考虑长期储存超过 6 个月,请使用未开封且含水量低的DMSO。
此外,如有必要,可将产品分成小份储存 |
| Q7:如何对细胞进行栅极化? |
| A7:以下是使用 Becton Dickinson (BD) 流式细胞仪的方法。
|