特点:
● 定位线粒体
● 更深层次脂质过氧化探究


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. FerroOrange 细胞亚铁离子检测
NO.2. Mito-FerroGreen 线粒体内亚铁离子检测
NO.3. Liperfluo 细胞脂质过氧化物检测
NO.4. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.5. ROS Assay Kit 活性氧检测
产品概述
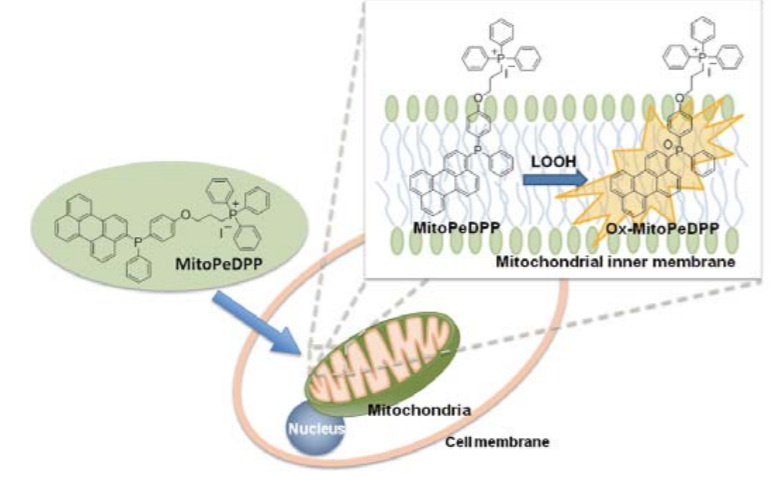
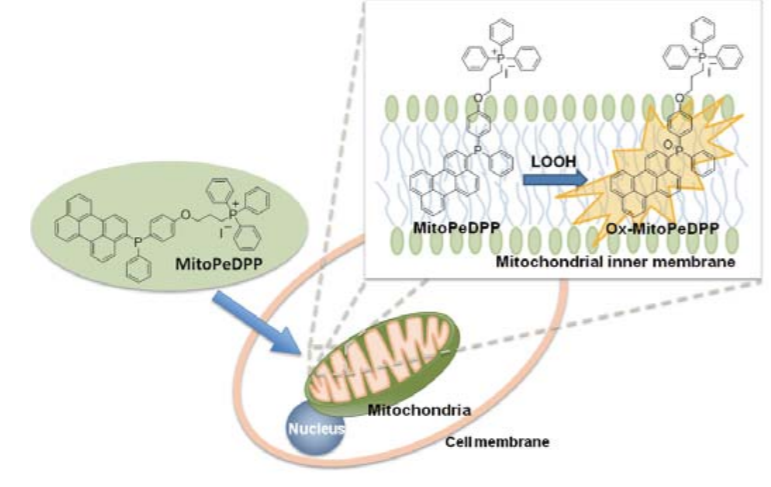
MitoPeDPP是一种新型荧光染料,由于其具有三苯基膦结构,因此可以穿过细胞膜并在线粒体中聚集。
聚集在线粒体内膜上的MitoPeDPP可以被脂质过氧化物氧化而释放出强荧光。由于氧化的MitoPeDPP
(Ox-MitoPeDPP) 的激发和发射波长分别是452 nm和470 nm,可以减小样品的光损伤和自发荧光,因此利用
荧光显微镜MitoPeDPP可以检测活细胞中的脂质过氧化物。
特点
1.特异性的在细胞中线粒体内聚集
2.可以检测线粒体膜内的脂质过氧化物
3.可以在488 nm和535 nm的荧光波长下进行检测
* 本产品由福冈大学化学系的Dr. Shioji开发
*由于MitoPeDPP量极少不宜看到,可以通过观察MitoPeDPP DMSO溶液的颜色是否为黄色来判断。
检测原理
MitoPeDPP可以穿过细胞膜并在线粒体中聚集。聚集在线粒体内膜上的MitoPeDPP可以被脂质过氧化物氧化而释放出强荧光。
实验例
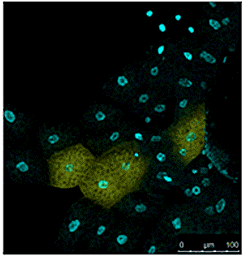
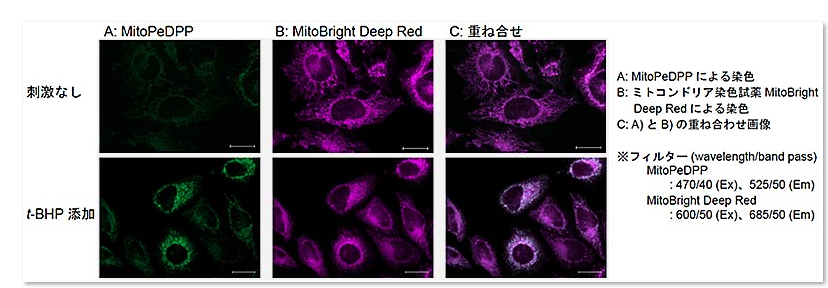
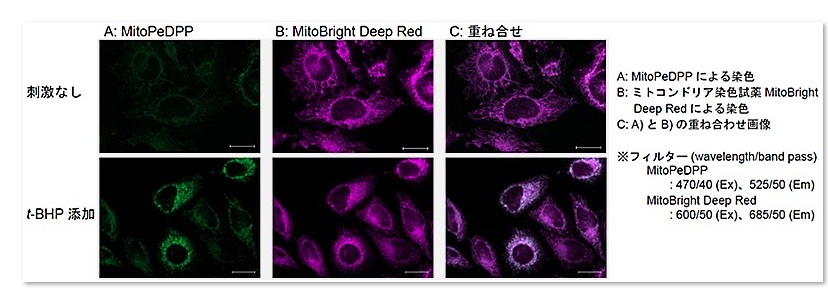
1.MitoPeDPP和线粒体染色试剂MitoBright共同染色的实施例
在HeLa细胞中添加t-BHP(氢过氧化叔丁基),检测脂质过氧化物
波长(wavelength/band pass)
MitoPeDPP:470/40(Ex),525/50(Em)
MitoBright DeepRed:600/50(Ex),685/50(Em)
结果证实在HeLa细胞内的线粒体中,MitoPeDPP受t-BHP氧化后会发出荧光。另外通过与线粒体染色试剂(MitoBright Deep Red:MT08)的共染色,确认了MitoPeDPP的荧光是定位在线粒体中。
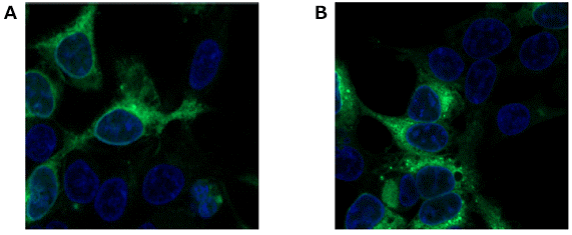
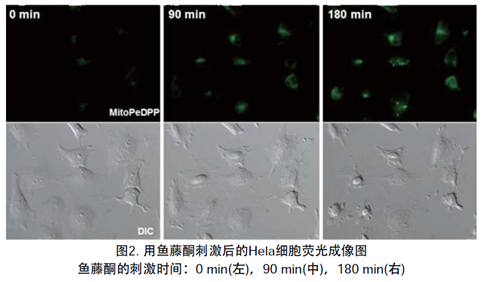
2.检测添加Rotenone产生的脂质过氧化物
向HeLa细胞[μ-slide,8孔(由Ibidi制造)]中添加MitoPeDPP之后,添加Rotenone溶液并使用荧光显微镜观察。实验结果证实,添加Rotenone后,检测到细胞中产生了脂质过氧化物。
Rotenone的刺激时间:0 min(左),90 min(中),180 min(右)
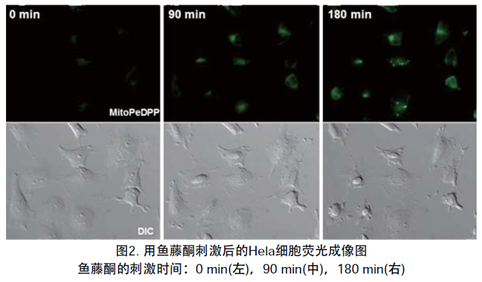
上部)荧光图,下部)明场图
3.神经细胞使用MitoPeDPP的实验例
A.荧光显微镜检测
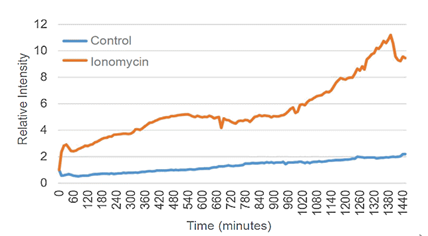
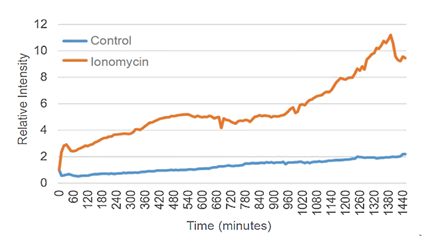
向NIE-115细胞(小鼠神经芽细胞瘤)添加异黄素,诱导Ca2+流入细胞内,并通过MitoPeDPP的荧光染色来观察线粒体膜内的脂溶性过氧化物的产生。实验结果证实添加了异霉素的实验组相比对照组来说荧光更强。

B. 平均荧光强度数据比较
为了量化对照组细胞和添加了离子霉素的细胞的荧光强度,对两组数据进行基于平均荧光强度的比较。
结果证实,加入离子霉素后30分钟的细胞对比对照组的细胞,观察到的荧光强度显着增加。
数据提供(Free Radical Research, in press)
参照芝浦工业大学系统理工学院 福井浩二副教授、中村沙希[参考文献3]
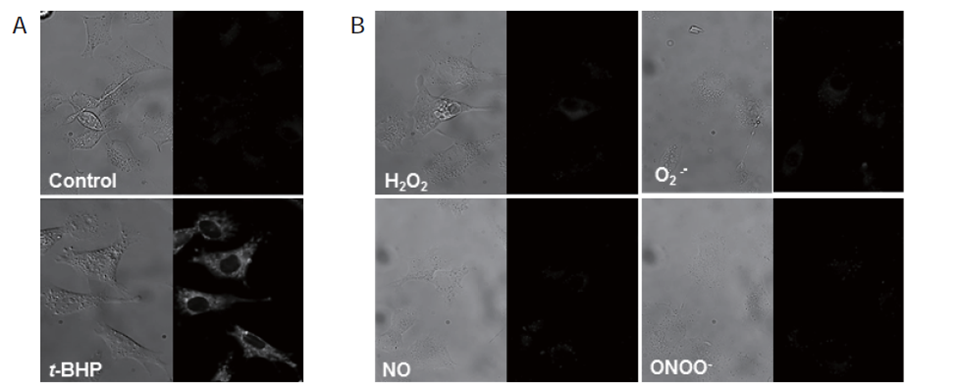
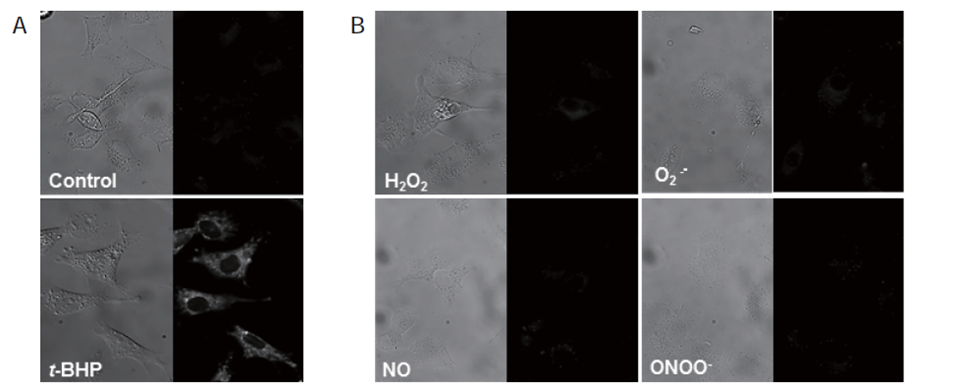
4.MitoPeDPP反应的选择性
在不含细胞的反应体系中,MitoPeDPP可以与各种过氧化物如H2O2,t-BHP和ONOO- 反应,但是在细胞中,积
累在线粒体中的MitoPeDPP可以被t-BHP氧化而释放出较强荧光 (图3A),却和其它ROS或RNS反应很弱 (图3B)。
A) 在HepG2细胞中加入MitoPeDPP培养15 min,然后用100 μmol / l的t-BHP处理。
B) 在HepG2细胞中加入MitoPeDPP培养15 min后,加入ROS、RNS诱导剂。
分别加入100 μmol / l (H2O2,NO和ONOO-诱导剂)和10 μmol / l PMA(O2-.诱导剂) 。
左边为明场图,右边为荧光图
* t-BHP:tert-Butylhydroperoxide; PMA, Phorbol myristate acetate;
SIN-1, 3-(Morpholinyl)sydnonimine, hydrochloride;
NOC 7, 1-Hydroxy-2-oxo-3-(N-methyl-3-aminopropyl)-3-methyl-1-triazene
波长/带通滤波器:470/40 (Ex), 525 /50 (Em)
参考文献
1) K. Shioji K, Y. Oyama, K. Okuma and H. Nakagawa, “Synthesis and properties of fluorescence probe for detection of peroxides in mitochondria.”, Bioorg Med Chem Lett., 2010, 20, (13), 3911.
2) S. Oka, J. Leon, K. Sakumi, T. Ide, D. Kang, F. M. LaFerla and Y. Nakabeppu, “Human mitochondrial transcriptional factor A breaks the mitochondria-mediated vicious cycle in Alzheimer’s disease”, Scientific Reports ., 2016, DOI: 10.1038/srep37889 , .
3) S. Nakamura, A. Nakanishi, M. Takazawa, S. Okihiro, S. Urano and K. Fukui, “Ionomycin-induced calcium influx induces neurite degeneration in mouse neuroblastoma cells: Analysis of a time-lapse live cell imaging system”, Free Radical Research., 2016, 50, (11), 1214.
4) M. Akimoto, R. Maruyama, Y. Kawabata, Y. Tajima and K. Takenaga, “Antidiabetic adiponectin receptor agonist AdipoRon suppresses tumour growth of pancreatic cancer by inducing RIPK1/ERKdependent necroptosis”, Cell Death Dis., 2018, 9, 804.
5) M. Álvarez-Córdoba, A. Fernández Khoury, M. Villanueva-Paz, C. Gómez-Navarro, I. Villalón-García, J. M. Suárez-Rivero, S. Povea-Cabello, M. Mata, D. Cotán, M. Talaverón-Rey, A. J. Pérez-Pulido, J. J. Salas, E. M. Pérez-Villegas, A. Díaz-Quintana, J. A. Armengol, J. A. Sánchez-Alcázar , “Pantothenate Rescues Iron Accumulation in Pantothenate Kinase-Associated Neurodegeneration Depending on the Type of Mutation.”, Mol. Neurobiol. ., 2019, 56, (5), 3638.
6)Yaxu Li, Qiao Ran, Qiuhui Duan, Jiali Jin, Yanjin Wang, Lei Yu, Chaojie Wang, Zhenyun Zhu, Xin Chen, Linjun Weng, Zan Li, Jia Wang, Qi Wu, Hui Wang, Hongling Tian, Sihui Song, Zezhi Shan, Qiwei Zhai, Huanlong Qin, Shili Chen, Lan Fang, Huiyong Yin, Hu Zho“7-Dehydrocholesterol dictates ferroptosis sensitivity”Nature.626, 411-418(2024).