特点:
● 可长时间持续观测ROS水平
● 染色后可PFA固定和免疫共染色
● 可用于多种仪器的检测

产品解说
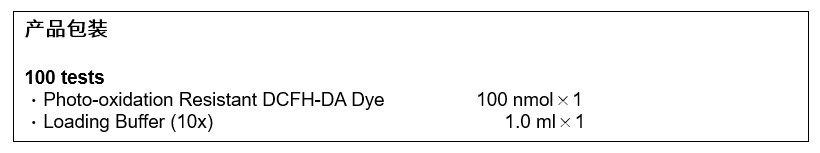
规格性状
产品概述
ROS(Reactive Oxygen Species)主要是在线粒体中合成ATP时所产生的高活性氧簇。适量的ROS对细胞内的信号传导以及免疫机能都有促进作用,而过量的ROS对DNA和蛋白质所造成的氧化作用是导致多种疾病和细胞衰老的原因之一。
常见的细胞内ROS检测方法是利用DCFH-DA进入细胞内被ROS氧化后会发出荧光的特性进行检测。然而,DCFH-DA有灵敏度较低、染色后易从细胞内漏出、观察光所引起的自发荧光1)等问题。
ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-克服了上述问题, 是一种比DCFH-DA灵敏度更高、进入细胞后可以与蛋白质结合抑制向细胞外漏出的荧光探针。更重要的是,它可以抑制由观察光所引起的自发荧光,可以更准确的反映细胞内ROS水平。另外,使用试剂盒内附带的Buffer进行观察,可以在尽量不伤害细胞的状态下检测细胞内的ROS。
1) M. Afzal, et al., “Method to overcome photoreaction, a serious drawback to the use of dichlorofluorescin in evaluation of reactive oxygen species” BBRC, 2003, 304, 619–624.
常见问题
相同实验条件下,检测结果的重现性差、由观察光引起荧光探针自发荧光的假阳性等问题是ROS检测的常见问题。而本试剂盒可以有效地解决上述问题。

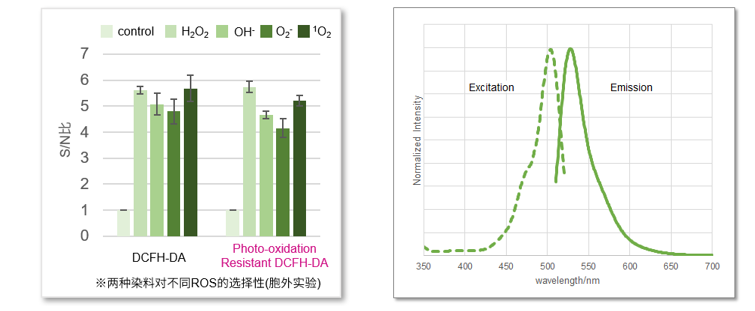
选择性对比
Photo-oxidation Resistant DCFH-DA对各种活性氧(ROS)的选择性与DCFH-DA的选择性基本相同。另外,由于荧光特性(λex:505 nm; λem:525 nm)也相同,可以使用DCFH-DA相同的检测波长或Filter。
性能比较表
同仁化学研究所的ROS荧光探针与市面上常见的ROS荧光探针的性能比较。

关联产品:ROS Assay Kit -Highly Sensitive DCFH-DA-试剂 ←
抑制观察光造成的自发氧化
在未经任何刺激的正常HeLa细胞中,使用Photo-oxidation Resistant DCFH-DA染色细胞后,每5分钟观察一次细胞。结果显示,与一般的DCFH-DA相比,Photo-oxidation Resistant DCFH-DA可以改善观察光所引起的荧光探针的自氧化(假阳性)。
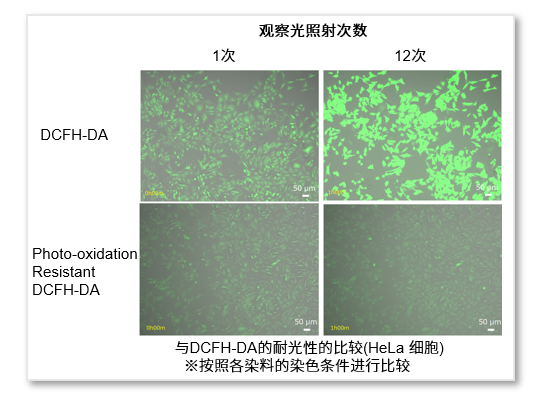
<实验条件>
细胞系:HeLa(未经任何刺激,正常状态)
荧光显微镜(BZ-X800, KEYENCE)
GFP Filter: Ex= 450 – 490 nm, Em = 500 – 550 nm
拍摄时间间隔: 5 min
拍摄曝光时间: 1.5 sec
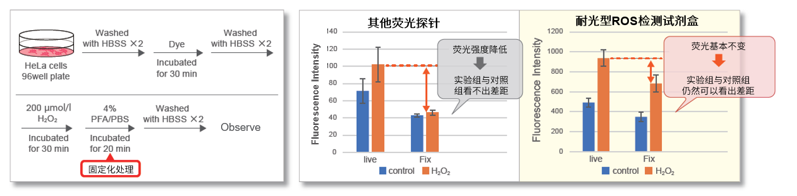
染色后的细胞固定
一般的荧光探针在细胞固定后容易泄漏到细胞外造成荧光强度降低,而用本试剂盒染色HeLa细胞并加入过氧化氢后,用PFA进行细胞固定,然后通过荧光观察发现固定后的荧光强度几乎没有变化,而且染料基本都滞留在细胞内。
检测灵敏度的比较
利用LPS诱导RAW264.7细胞炎症模型,比较Photo-oxidation Resistant DCFH-DA与一般的DCFH-DA检测ROS的区别。从实验结果可以看出,同仁化学研究所的探针的灵敏度更高。
① 荧光显微镜检测
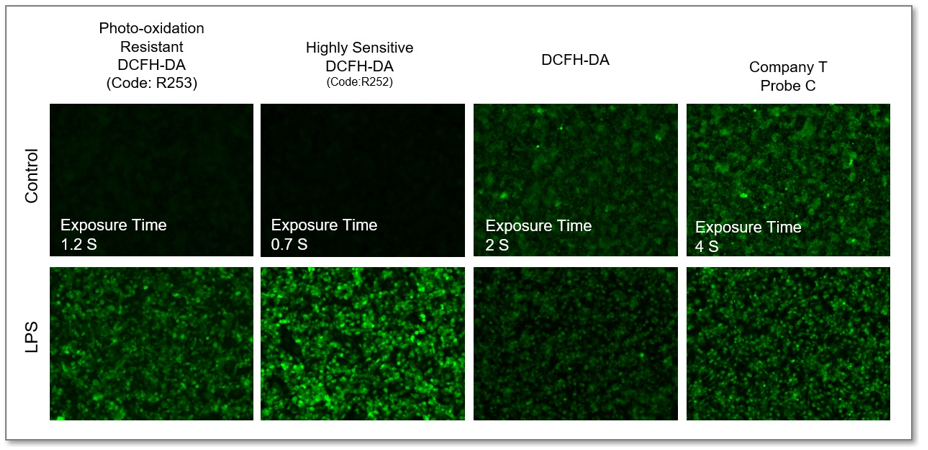
<检测条件>
GFP Filter: Ex = 450 – 490 nm, Em = 500 – 550 nm)
② 荧光酶标仪检测
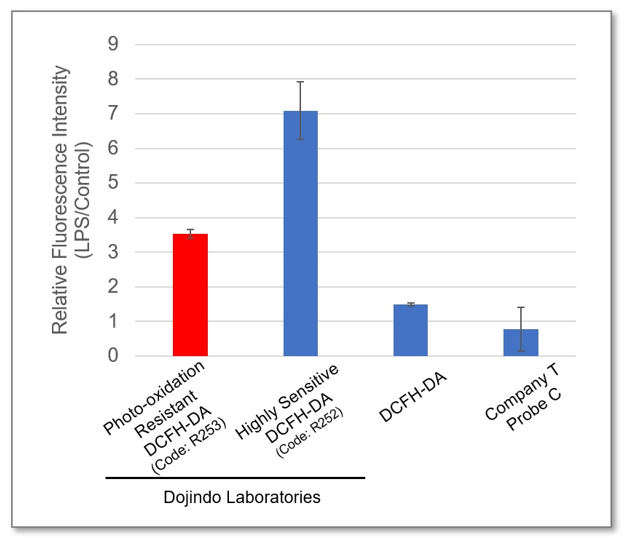
<检测条件>
Ex = 490 – 520 nm, Em = 510 – 540 nm
③ 流式细胞仪检测

<检测条件>
Ex = 488 nm, Em = 515 – 545 nm)
检测例
LPS诱导后,细胞内ROS水平的监测
用ROS Assay Kit –Photo-oxidation Resistant DCFH-DA-染色RAW264.7细胞后,加入脂多糖(LPS)刺激细胞并开始实时监测细胞内的ROS水平。通过对检测结果的数值化分析可以看出,在LPS诱导10小时后,胞内的ROS水平明显开始升高。
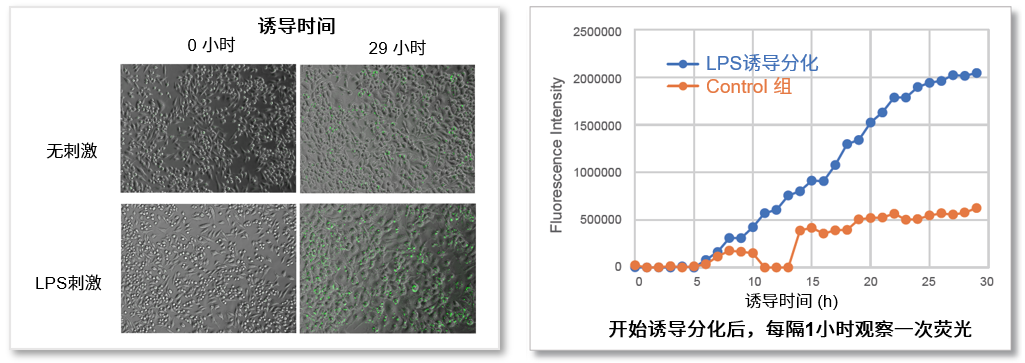
<检测条件>
细胞内ROS Photo-oxidation Resistant DCFH-DA Dye)
GFP Filter (Ex = 450 – 490 nm, Em = 500 – 550 nm)
<实验步骤>
1. 将RAW264.7细胞(2×105 cells/ml, DMEM, 10% fetal bovine serum, 1% penicillin-streptomycin)接种于黑色96-well孔板中。
2. 37℃、5% CO2培养箱过夜培养。
3. 去除培养基,用HBSS清洗细胞2次,添加Photo-oxidation Resistant DCFH-DA Dye Working solution。
4. 37℃、5% CO2培养箱内培养30 min。
5. 去除培养基,用HBSS清洗细胞2次,添加Highly Sensitive DCFH-DA Dye Working solution。
6. 37℃、5% CO2培养箱内培养30 min。
7. 去除培养基,用HBSS清洗细胞2次。添加含有500 ng/ml LPS的DMEM培养基,用荧光显微镜观察。
8. 每隔1小时检测荧光强度并绘制荧光强度/时间的曲线图。
与线粒体标记物Tom 20的共染色
使用本试剂盒染色HeLa细胞后加入过氧化氢,与Tom 20抗体进行免疫共染色,实现了胞内ROS水平与线粒体的形态的同时观察。该实验证明了本试剂盒可以完美解决传统ROS荧光探针无法用于免疫荧光染色的问题。
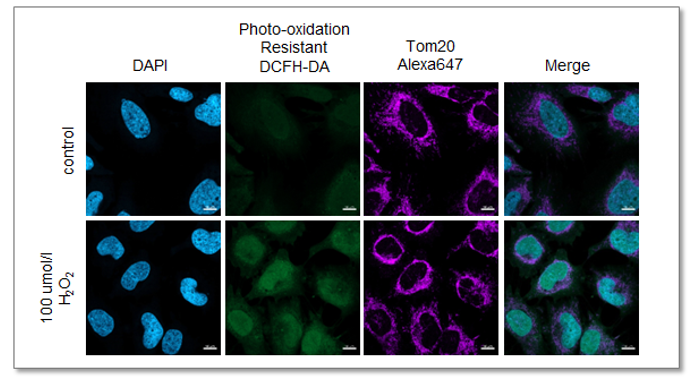
<检测条件>
激光共聚焦显微镜
(蓝) DAPI: Ex = 405 nm, Em = 450-495 nm
(绿) Photo-oxidation Resistant DCFH-DA: Ex = 488 nm, Em = 500-550 nm
(紫) Alexa Fluor 647: Ex = 633 nm, Em = 640-700 nm
Scale bar:10 µm
使用活细胞高内涵成像检测被激活的巨噬细胞中ROS的产生
免疫细胞通过炎症反应消除外来物质,在维持正常身体方面发挥了作用。受到外来物质刺激的单核细胞在线粒体中产生活性氧(ROS),分化成活化的巨噬细胞,并分解外来物质。另一方面,过度的炎症会引起自身免疫性疾病、过敏、糖尿病和阿尔茨海默病。这就是为什么ROS检测成为炎症药物的一个重要指标。
<实验>
脂多糖(LPS)刺激的巨噬细胞可以吞噬死细胞。LPS诱导的巨噬细胞的炎症反应是以ROS为指标进行评估的。在尼康倒置显微镜(Ti2-E)上用ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-检测ROS。此外,使用体积对比图像检测每个细胞的ROS随时间的变化。
<结果>
细胞形态和细胞计数的观察
LPS刺激增加了每个细胞的面积(图1A)。 与对照组细胞相比,它还导致了细胞数量的减少(图1B)。
ROS的检测
当测量整个视野中的细胞数量并计算每个细胞的荧光强度时,与500 ng/ml相比,成像开始21小时后,1000 ng/ml的LPS的荧光强度更高,更高的LPS浓度导致每个细胞产生更多的ROS(图2)。 此外,延时成像显示由于细胞分裂导致细胞数量增加,而由于巨噬细胞吞噬死细胞导致细胞数量减少和ROS增加(图3)。传统的ROS检测试剂由于受到激发光的自动氧化,很难测量随时间的变化和进行高重复性的实验,但本实验中使用的ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-减少了激发光对染料的自动氧化,此外,染料在细胞内结合,所以不会产生ROS。 实验中使用的ROS Assay Kit -Photo-oxidation Resistant DCFH-DA-减少了激发光对染料的自动氧化,而且,由于染料在细胞内结合,在产生ROS的区域专门检测到荧光,能够以低背景进行高度准确的分析。 而且,该染料在细胞内的滞留型高,可以在成像48h后仍然检测出高荧光强度,从而使长时间内ROS随时间的变化检测成为可能。
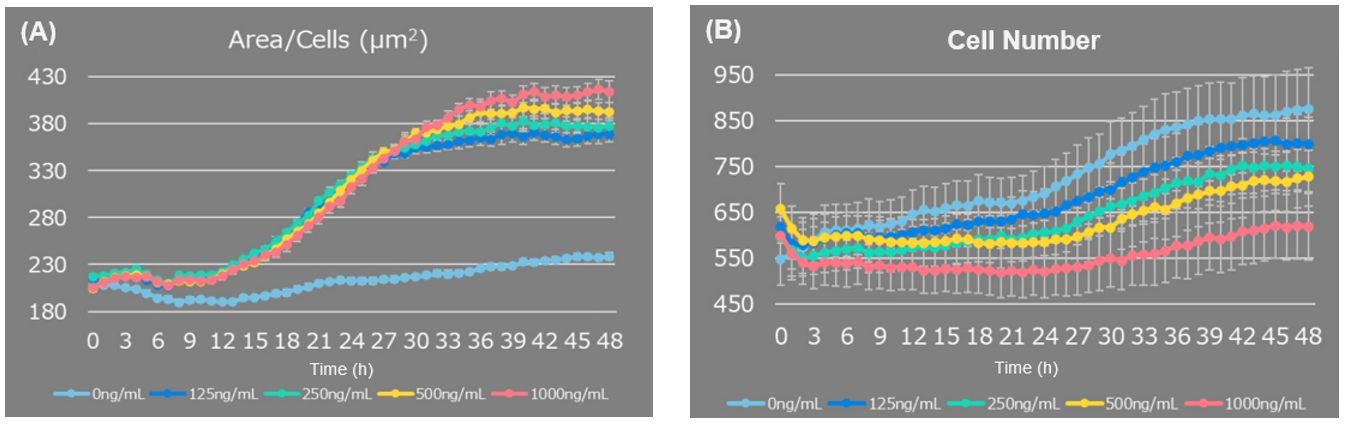
图 1. 添加LPS后细胞数量及细胞面积的变化情况
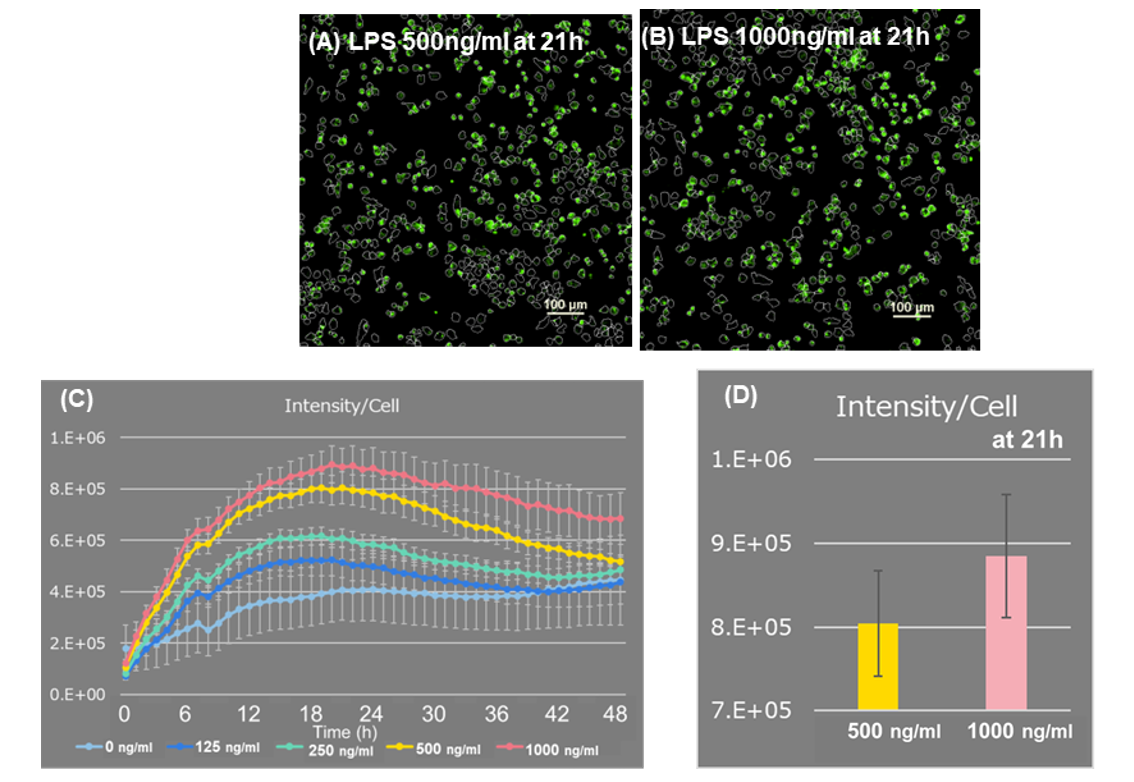
图 2. ROS的荧光强度分析
(A, B) LPS添加21h后荧光图像 比例尺: 100 μm
(C, D) 每个细胞ROS的荧光强度
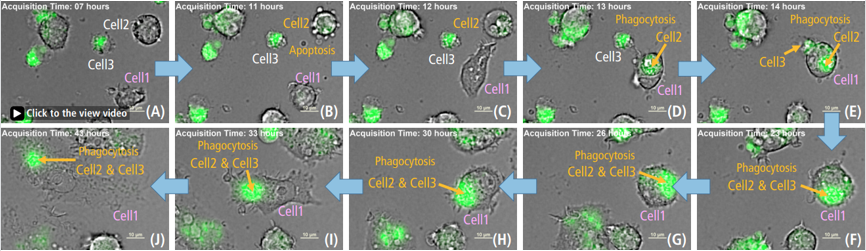
图 3. 被激活的巨噬细胞对死细胞的吞噬作用
使用500 ng/ml LPS后Time-lapse 成像结果 Green: ROS, 比例尺: 10 μm
细胞2,凋亡细胞 (B) 1h后显示死细胞形态 (C).
细胞1吞噬死亡的细胞2和细胞3,并且ROS增加(C-F)
※ 详见以下视频
*<用细胞数进行校正(体积对比(VC)成像)>
在这个实验中,”显微镜附加模块体积对比 “被用来校正细胞数。通过使用体积对比(VC)图像,可以从三个不同焦平面的明视野图像中构建类似荧光的相位分布图像、这有利于识别背景和细胞区域,还可以在没有染料或激发光造成的毒性的情况下校正细胞数量。
<仪器>
高内涵分析(HCA)显微镜系统
(Nikon https://www.microscope.healthcare.nikon.com/zh_CN/)
*关于详细步骤和分析可参见:
Nikon ”APPLICATION NOTE: High-content live cell imaging of ROS production in activated macrophages”
FAQ
| Q:每个试剂盒可以检测多少个样品? |
| A:可检测的样品数请参考下列信息:
・ 96-well plate:1块板 |
| Q:是否有可作为“阳性对照”的实验例? |
| A:产品的使用说明书中的“实验例2”有过氧化氢刺激HeLa的检测实例。请参考说明书实验例2的步骤1-5。 |
| Q:是否可以使用Loading buffer以外的缓冲液来配制Working solution? |
| A:为了减小观测时对细胞的损伤,建议尽量使用Loading buffer来配制。另外,也可以使用 Hanks’ HEPES或HBSS来配制。如果需要用培养基配制,请使用无血清培养基。 |
| Q:清洗细胞时,是否可以用PBS替代HBSS? |
| A:为了减小对细胞的损伤,建议尽量使用HBSS。如果手头没有HBSS,建议用培养基清洗细胞。 |
| Q:在使用流式细胞仪检测时,建议在哪一步将贴壁细胞剥落? |
| A:参照使用说明书,建议在步骤6(药物刺激后并用HBSS清洗细胞之后),将细胞剥离(胰酶消化)。胰酶消化后重新加入培养基,离心后用HBSS清洗1次,再次离心去上清之后,用HBSS重悬细胞用于检测 |
关联产品