C26H28N6
424.54
特点:
● 水溶性好并且能透过细胞膜
● 高度选择性过渡金属螯合剂

C26H28N6
424.54
特点:
● 水溶性好并且能透过细胞膜
● 高度选择性过渡金属螯合剂
C27H39N4NaO6
538.61
特点:
● 可用于流式细胞仪、共聚焦显微镜
● 操作简便
性质
它是Bis-oxonol型阴离子膜电位敏感染料,随着细胞膜去极化,其在细胞质中的分布增加,荧光增强。 据报道,在BICR / M1R-k细胞(大鼠乳腺癌细胞)中,在-25至-90mV的膜电位范围内获得了约1%/ mV的荧光强度变化。 与电势变化相关的响应遵循一阶速率方程,其速率常数为0.1至0.8 / min。
由于可以被Ar激光(488nm)激发,因此可以用于流式细胞术,共聚焦显微镜等。 除膜电位测量外,还有在细胞活力和离子通道活性评估中应用的实例。 它也可以用于高通量筛选(HTS)细胞反应。
*有关使用方法,请参照操作说明书。
参考文献
1) D. E. Epps, M. L. Wolfe and V. Groppi, “Characterization of the Steady-state and Dynamic Fluorescence Properties of the Potential-sensitive Dye Bis-(1,3-dibutylbarbituric acid)trimethine oxonol(Dibac4(3)) in Model Systems and Cells”, Chem. Phys. Lipids, 1994, 69, 137.
2) T. Braner, D. F. Hulser and R. J. Strasser, “Comparative Measurements of Membrane Potentials with Microelectrodes and Voltage-sensitibe Dyes”, Biochim. Biophys. Acta, 1984, 771, 208.
3) T. T. Rohn, A. Sauvadet, C. Pavoine and F. Pecker, “Xanthine Affects [Ca2+]i and Contractile Responses of Ventricular Cardiocytes to Electrical Stimulation”, Am. J. Physiol., 1997, 273, C909.
4) D. J. Mason, R. Allman, J. M. Stark and D. Lloyd, “Rapid Estimation of Bacterial Antibiotic Susceptibility with Flow Cytometry”, J. Microsc., 1994, 176, 8.
5) U. Langheinrich and J. Daut, “Hyperpolarization of Isolated Capillaries from Guinea-pig Heart Induced by K+ Channel Openers and Glucose Deprivation”, J. Physiol., 1997, 502, 397.
6) V. Dall’Asta, R. Getti, G. Orlandini, P. A. Rossi, B. M. Rotoli, R. Sala, O. Bussolati and G. C. Gazzola, “Membrane Potential Changes Visualized in Complete Growth Media through Confocal Laser Scanning Microscopy of bis-Oxonol-loaded Cells”, Exp. Cell Res., 1997, 231, 260.
7) K. S. Schroeder and B. D. Neagle, “FLIPR: A New Instrument for Accurate, High Throughput Optical Screening”, J. Biomol. Screening, 1996, 1, 75.
规格性状
规格性状:
本品为橙红色至红色粉末。
纯度(HPLC):98.0%或更高
二甲基亚砜可溶:测试合格性
摩尔消光系数:140,000或更高(约493 nm)
红外光谱:测试合格
处理条件
1.保存方法:冷藏
C22H20K4N2O10
628.79
性质
酸解离常数为pKa3 = 5.47和pKa4 = 6.36,金属离子的稳定常数为logKCa = 6.97和logKMg = 1.77。 因此,它是接近中性的Ca2 +的选择性螯合剂。
长期以来,GEDTA被认为是一种选择性捕获钙的螯合剂。 GEDTA首先证明了钙在肌肉收缩研究中的重要性。 如果要在生理pH条件(pH值为7)下进行实验,则需要将GEDTA的酸解离常数进一步降低2到3个数量级,以抑制质子化的副反应。
Tsien等人通过合成BAPTA(一种使用芳族胺而不是脂肪族胺的螯合剂)达到了这一要求。 下面是GEDTA和BAPTA常数值的比较,图中显示了各种Ca2 +配合物的条件常数与pH之间的关系。 可以看出,即使接近中性,BAPTA也不容易受到质子的影响。
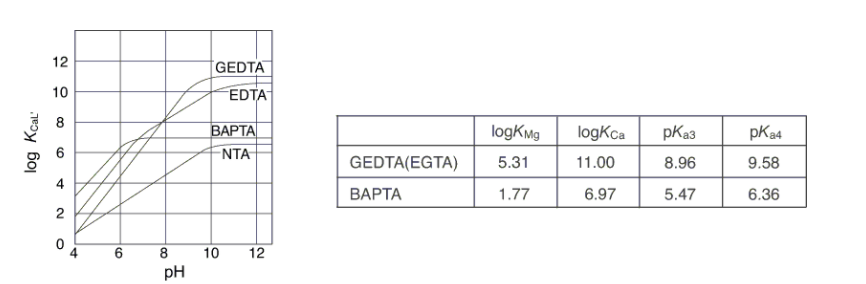
各种钙离子螯合剂的条件常数与pH的关系
溶解例
1.8 g/50 mL(水)
规格性状
规格性状:
本产品为白色粉末或结晶性粉末,可溶于水。
纯度(滴定,干物质转化率):95.0%或更高
水溶性:测试合格
PH(25°C):8.0-9.5
水分:3.5至14.0%或更高
灼烧残渣(硫酸盐):46.0-53.0%或更高
红外光谱:测试合格
C34H20O7S2
604.65
特点:
● 荧光背景低
● 灵敏度高
C30H33CuN5O10S
719.22


产品性状
规格:
性状: 本品为褐色固体
纯度(HPLC): 90%以上
处理条件
保存方法: 0~5°C
产品概述
硫化氢 (H2S) 在舒张血管,保护细胞和调节胰岛素分泌方面具有重要的生理作用已经得到广泛的认可。 H2S被认为是一种类似于NO和CO的气体信号分子,但在生理条件下大约80%的H2S是以HS-的状态存在的 (pKa=7)。HS- 很容易转变为各种过硫化物和多硫化物。 -SulfoBiotics- HSip-1 是一种新的特异性检测H2S的荧光探针,当和H2S反应时会发出较强的绿色荧光。 -SulfoBiotics- HSip-1 DA可以穿透细胞膜检测细胞内的H2S。
检测原理
硫化氢 (H2S) 在舒张血管,保护细胞和调节胰岛素分泌方面具有重要的生理作用已经得到广泛的认可。
H2S被认为是一种类似于NO和CO的气体信号分子,但在生理条件下大约80%的H2S是以HS–的状态存在的(pKa=7)。
HS-很容易转变为各种过硫化物和多硫化物。
-SulfoBiotics- HSip-1 是一种新的特异性检测H2S的荧光探针,当和H2S反应时会发出较强的绿色荧光。
-SulfoBiotics- HSip-1 DA可以穿透细胞膜检测细胞内的H2S。
溶解比例
制备10 mmol/l HSip-1储存液,加117 ul超纯水至含有1 mg HSip-1的管子中,用移液器吹打溶解。
*配制好的溶液请在-20℃保存,可以保存1个月。
荧光参数
Ex: 470 ~ 500 nm
Em:500 ~ 550 nm

实验案例
一. 用HSip-1检测硫化氢
1. 用PBS稀释10 mmol/l HSip-1储存液,制成200 umol/l的 HSip-1工作液。
2. 用1 ml 充氮处理过的超纯水溶解7.8 mg Na2S制成 100 mmol/l Na2S溶液。
3. 吸取20 ul 100 mmol/l 的Na2S溶液至980 ul超纯水中,制成2 mmol/l 的Na2S溶液。
4. 吸取100 ul 2 mmol/l 的Na2S溶液至900 ul超纯水中,制成200 umol/l 的Na2S溶液。
5. 用超纯水稀释200 umol/l 的Na2S溶液,制成一个系列浓度的 (200 umol/l, 100 umol/l,
50 umol/l, 25 umol/l, 12.5 umol/l, 6.3 umol/l, 3.2 umol/l, 0 umol/l) 的Na2S标准溶液。
6. 吸取350 ul 200 umol/l的 HSip-1工作液至300 ul的Na2S溶液中,并用涡旋振荡器振荡混匀。
7. 上述溶液在室温培养30 min后,转移至96孔板中 (200 ul/孔)。
8. 用荧光酶标仪测定在516 nm (ex=491 nm)的荧光强度。
C15H25N2O3PS2
376.47
特点:
● 缓慢释放H2S的供体
● 水溶性好
分子式:
C27H34I2N4
分子量:
668.39
特点:
● 与死细胞DNA结合
● 常用于细胞凋亡检测
● 可与Calcein-AM或者FDA等荧光探针一起使用

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Calcein-AM 细胞质染色
NO.2. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.3. Amine Coupling Kit 自组装单分子膜SAM
NO.4. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.5. Annexin V, 633 Apoptosis Detection Kit 细胞凋亡检测
规格性状
规格
特性:该产品为红棕色粉末或固体,易溶于水和稀盐酸。
水溶性:试验成功
NMR光谱:试验成功
产品概述
荧光染料PI(碘化丙啶)是一种可对DNA染色的细胞核染色试剂,常用于细胞凋亡检测,英文全称是Propidium Iodide。它是一种溴化乙啶的类似物,在嵌入双链DNA后释放红色荧光。尽管PI不能通过活细胞膜,但却能穿过破损的细胞膜而对核染色。PI经常被用来与Calcein-AM或者FDA等荧光探针一起使用,能同时对活细胞和死细胞染色。PI-DNA复合物的激发和发射波长分别为535nm和615nm。
荧光特性
λex=530 nm, λem=620 nm
操作说明
1.用PBS或适当的缓冲液制备10-50μMPI溶液。a)
2.在细胞培养基中加入体积为细胞培养基1/10的PI溶液。b)
3.将细胞在37oC下孵育10-20分钟。
4.用PBS或适当的缓冲液清洗细胞两次。
5.在带有535 nm激发光和615 nm发射滤光片的荧光显微镜下观察细胞。
a)由于PI可能致癌,因此在处理过程中必须格外小心。
b)或者您可以用1/10浓度的PI缓冲溶液代替培养基。
文献
1) I. W. Taylor and B. K. Milthorpe, “An Evaluation of DNA Fluochromes, Staining Techniques, and Analysis for Flow Cytometry. I. Unperturebed Cellpopulations”, J. Histochem. Cytochem., 1980, 28(11), 1224.
2) W. M. J. Vuist, F. V. Buitenen, M. A. De Rie, A. Hekman, P. Ruemke and C. J. M. Melief, “Potentiation by Interleukin 2 of Burkitt’s Lymphoma Therapy with Anti-Pan B (Anti-CD19) Monoclonal Antibodies in a Mouse Xenotransplantation Model”, Cancer Res., 1989, 49, 3783.
3) A. K. El-Naggar, J. G. Batsakis, K. Teague, L. Garnsey and B. Barlogie, “Single- and Double-stranded RNA Measurements by Flow Cytometry in Solid Neoplasms”, Cytometry, 1991, 12, 330.
4) C. Souchier, M. Ffrench, M. Benchaib, R. Catallo and P. A. Bryon, “Methods for Cell Proloferation Analysis by Fluorescent Image Cytometry”, Cytometry, 1995, 20, 203.
5) T. Irino, T. Kitoh, K. Koami, T. Kashima, K. Mukai, E. Takeuchi, T. Hongo, T. Nakahata, S. M. Schuster and M. Osaka, “Establishment of Real-Time Polymerase Chain Reaction Method for Quantitative Analysis of Asparagine Synthetase Expression”, Mol. Diagn., 2004, 6, 217.
常见问题Q&A
| Q1:核染色中所用染料的特征和区别是什么?
|
|
A1: 这里引入的染料具有通过与核酸相互作用而发出荧光或增加荧光强度的特性。 除荧光波长以外的差异如下。 [EB] 它没有碱基特异性,可与所有DNA和RNA结合。 它没有活细胞的膜通透性,并且可以染色死细胞。 [PI] 像EB一样,它没有基础特异性。它是一种更广泛使用的染料,因为插入时它的荧光强度比EB高。 它没有活细胞的膜通透性,并且可以染色死细胞。 [DAPI] 与双链小槽结合。它与腺嘌呤-胸苷簇具有高度结合。 它没有活细胞的膜通透性,并且可以染色死细胞。 [AO] 通过利用插入双链时和与单链磷酸结合时荧光波长不同的事实,可以在双链和单链之间进行区分。 它渗透到活细胞的细胞膜上。 [Hoechst33342,33258] 它与DNA的腺嘌呤胸苷部分特异性结合。 它是一种颜料,可以渗透到活细胞的细胞膜上并染色活细胞的DNA。
|
|
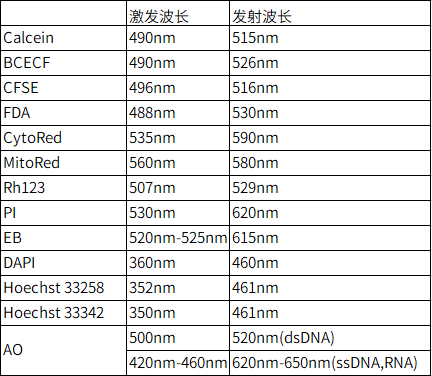
Q2:细胞染料的激发波长和发射波长是多少。 |
| A2: |
| Q3:如何使用PI进行核染色?
|
|
A3:一个例子如下所示。根据细胞类型和观察条件,考虑细胞固定和试剂浓度。 [使用示例①] Vollenweider等人进行了PI染色,并在荧光素激活的杀伤(LAK)细胞增殖试验中使用了荧光板读数器进行了测量。 此时的浓度为0.5 mg / mL PBS(-)。所用浓度为5μg/ mL柠檬酸钠溶液,每孔100μL用于荧光染色。 ·I.Vollenweider,P.Groscurth,J.Immunol.Methods,149,133(1992)。 [用法示例(2)] (1)对于包含实体瘤或团块的样品,请用0.02%tripsin EDTA处理。 在37°C下孵育30分钟后,以1500 rpm进行5分钟,然后弃去上清液。 (2)在-20℃用50%甲醇固定后,以1500rpm进行5分钟,并弃去上清液。 (3)在-20℃下用30%甲醇洗涤后,以1500rpm进行5分钟,弃去上清液。 (4)用0.2 mol / L磷酸盐缓冲液(pH 7.2)洗涤后,以1500 rpm进行5分钟,并弃去上清液。 (5)每106个细胞RNase 0.2 mol / L磷酸盐缓冲液(pH 7.2)溶液(1 mg / mL) 加入0.2 mL,并在37°C下孵育30分钟。 (6)用0.2 mol / L磷酸盐洗涤后,以1500 rpm进行5分钟,并弃去上清液。 (7)加入10 mL PI溶液(50μg/ mL),在黑暗中于4°C染色2小时。 ・医学院出版《流式细胞仪入门》 |
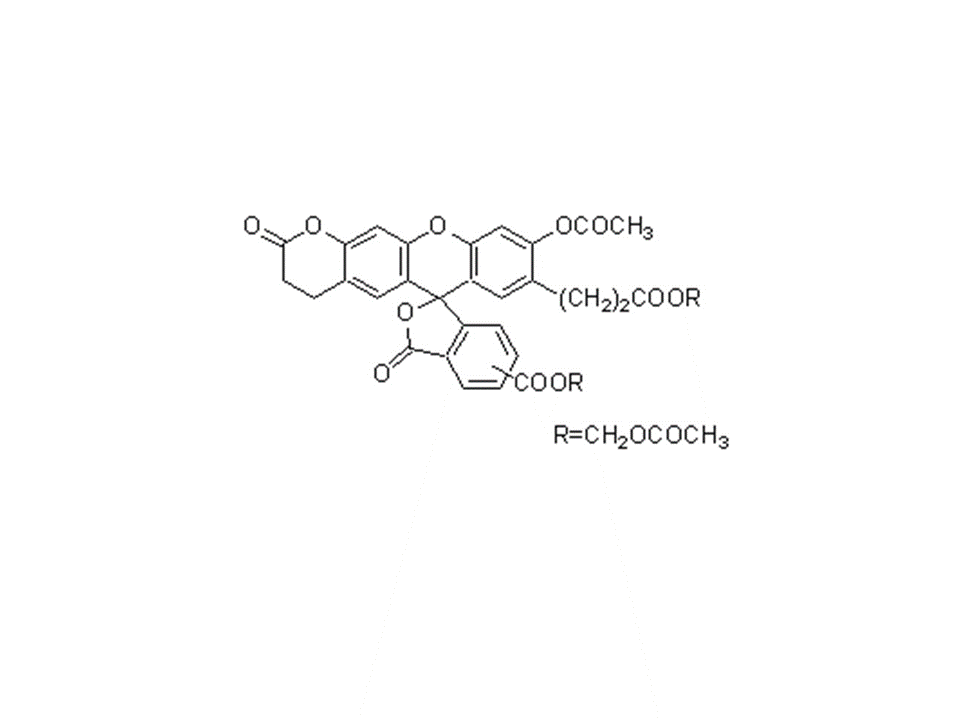
C35H28O15
688.59
特点:
● 水溶性好,可进入细胞膜
● 荧光强度高

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.2. Cell Counting Kit-8 细胞增殖毒性检测
NO.3. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.4. Cell Viability Assay Kit 细胞增殖/毒性检测
NO.5. Fluo 4-AM special packaging 细胞内钙离子检测
规格性状
规格
特性:该产物为浅橙色至浅橙色棕色粉末或固体,可溶于DMSO和乙腈。
纯度(HPLC):90%以上
荧光光谱:试验成功
NMR光谱:试验成功
产品概述
BCECF被广泛地用于细胞内pH的测定。Tsien博士和其他人通过加入2个额外的羧化物基团改进了这种羧基荧光素。加入的两个羧基使得它能更好地被固定在细胞内。BCECF具有很好的水溶性,是因为它在中性pH时带有4-5个负电荷。但是BCECF却很难穿过细胞膜进入到细胞内。它的pKa值为6.97,高于其它的羧基荧光素。BCECF在激发光谱439nm处有等吸收点,因此它能和Fura 2一样可用比率法测定。505nm和439nm通常是非常有用的用于比率测量的波长,一般会将490nm和450nm的滤光片加在激发光源的前面。而530nm的滤光片则是用来查看它的荧光信号的。这里要注意的是激发光谱与吸收光谱有一些细微的区别。BCECF-AM是乙酰甲酯化的BCECF。它能够轻易地进入到细胞内。就和其他的乙酰甲酯类一样,BCECF-AM只需要通过孵育就能进入细胞。BCECF-AM对潮湿非常敏感,所以要小心保存。如果DMSO储存液的颜色从浅黄色变为深橙色就代表了AM的分解。所以通过对颜色变化的观测,能判断AM酯的水解情况。
产品特性
BCECF-AM是一种对细胞内pH敏感的新型荧光探针,分别用490nm和440nm波长激发BCECF所得到的发射荧光之比与pH有很好的线性关系。BCECF-AM是乙酰甲酯化的BCECF,BCECF-AM是一种可以穿透细胞膜的荧光染料,BCECF-AM没有荧光,进入细胞后被细胞内的酯酶水解成BCECF,从而被留在细胞内。BCECF在适当的pH值情况下可以被激发形成绿色荧光。BCECF-AM不仅被广泛用于哺乳动物细胞的研究,也有报道用于动物组织、植物细胞、细菌和酵母等的细胞内pH水平检测。在有细胞内pH变化的细胞毒性、细胞凋亡、细胞粘附、药物抵抗、细胞趋化等过程中BCECF AM被广泛应用。BCECF-AM(pH荧光探针)需用无水DMSO(anhydrous DMSO)配制。

操作说明
试剂 (溶解方法):
1.45 mM的BCECF-AM/DMSO溶液(将1 mg 的BCECF-AM溶于1mlDMSO)HEPES缓冲液(20mM HEPES,153mM NaCl,5mM KCl,5mM glucose,pH7.4)
操作:
1.用HEPES制备细胞悬液,细胞浓度为4×107个/ml。
2.将1.45 mM的BCECF-AM/DMSO溶液加入细胞悬液中 (细胞悬液的1/300体积),BCECF-AM终浓度为3mM。
3.37℃培养30min。
4.用HEPES缓冲液清洗细胞3次,制成3×106个/ml的细胞悬液。
5.使用荧光显微镜或带有图像分析系统的激光共聚焦显微镜检测细胞的荧光强度。
*标记的条件因细胞种类而异,在每次实验前,请先确定最佳条件。以上方法仅供参考。
文献
1.R.A.Steinhardt, et al.,Development of K+-conductance and Membrane Potentials in Unfertilized Sea Urchin Eggs After Exposure to NH4OH. Nature.1973;241:400-401.
2.T.J.Rink, et al.,Cytoplasmic pH and Free Mg2+ in Lymphocytes.J Cell Biol.1982;95:189-196.
3.A.M.Paradiso,et al.,Na+ -H+ Exchange in Gastric Glands as Measured with a Cytoplasmic-trapped, Fluorescent pH Indicator. PNAS.1984;81:7436-7440.
4.S.Grinstein,et al.,Phorbol Ester-induces Changes of Cytoplasmic pH in Neutrophils:Role of Exocytosis in Na+ – H+ Exchange.Am J Physiol.1985;248:C379-C386.
5.G.B.Zavoico, et al.,Regulation of intracellular pH in human platelets.Effects of thrombin,A23187,and ionomycin and evidence for activation of Na+/H+ exchange and its inhibition by amiloride analogs.J Biol Chem.1986;261:13160-13167.
6.G.R.Bright,et al.,Fluorescence Ratio Imaging Microscopy: Temporal and Spatial Measurements of Cytoplasmic pH.J Cell Biol.1987;104:1019-1033.
7.C.Aalkjaer,et al.,Intracellular pH Regulation in Resting and Contracting Segments of Rat Mesenteric Resistance Vessels. J Physiol.1988;402:391-410.
8.K.Tsujimoto,et al.,Intracellular pH of Halobacteria Can Be Determined by the Fluorescent Dye 2 E 7 Ebis(carboxyethyl)-5(6)-carboxyfluorescein.Biochem Biophys Res Commun.1988;155:123-129.
9.M.A.Kolber,et al.,Measurament of Cytotoxicity by Target Cell Release and Retention of the Fluorescent Dye Bis-carboxyethylcarboxyfluorescein(BCECF).J Immunol Methods.1988;108:255-264.
10.H.Harada,et al.,cAMP Activates Cl-/HCO3 – Exchange for Regulation of Intracellular pH in Renal Epithelial Cells. Biochim Biophys Acta. 1991;1092:404-407.11.C.C. Freudenrich, et al.,Intracellular pH Modulates Cytosolic Free Magnesium in Cultured Chicken Heart Cells.Am J Physiol.1992;262:C1024-C1030.
12.K.Khodakhah,et al.,Functional Heterogeneity of Calcium Release by Inositol Triphosphate in Single Purkinje Neurones, Cultured Cerebellar Astorocytes, and Peripheral Tissues. PNAS. 1993;90:4976-4980.
13.G.Boyarsky,et al.,Superiority of in vitro Over in vivo Calibrations of BCECF in Vascular Smooth Muscle Cells. FASEB J.1996;10:1205-1212.
14.S.A. Weston,et al., New Fluorescent Dyes for Lymphocyte Migration Studies Analysis by Flow Cytometry and Fluorescent Microscopy.J Immunol Methods.1990;133:87-97.
15.L.S.De Clerck,et al.,Use of Fluorescent Dyes in the Determination of Adherence of Human Leucocytes to Endothelial Cells and the Effects of Fluorochromes on Cellular Function.J Immunol Methods.1994;172:115-124.
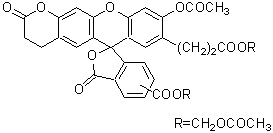
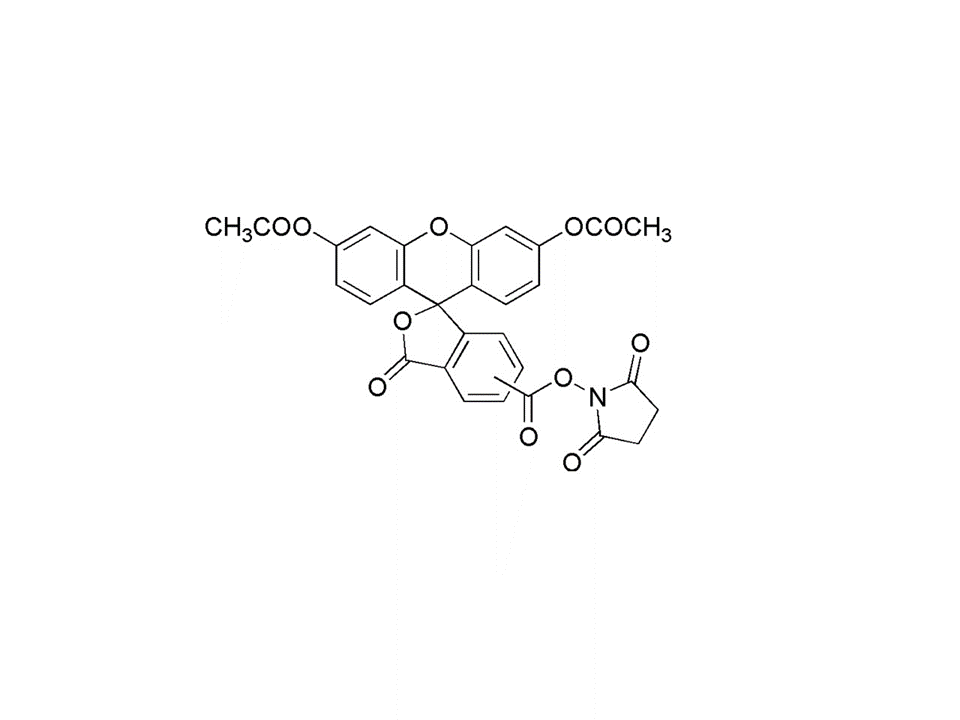
C29H19NO11
557.46
特点:
● 可用于细胞增殖检测
● 长效荧光染色,最长三周可见
● 可用于流式细胞仪检测

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.2. Annexin V, 633 Apoptosis Detection Kit 细胞凋亡检测
NO.3. Calcein-AM 细胞质染色
NO.4. Cell Viability Assay Kit 细胞增殖/毒性检测
NO.5. FerroOrange 细胞亚铁离子检测
规格性状
规格
特性:该产物为无色至微黄色固体,可溶于二甲基亚砜和乙腈。
可溶于二甲基亚砜:试验成功
NMR光谱:试验成功
产品概述
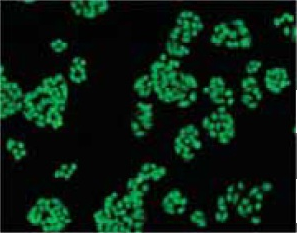
荧光染料 CFSE(CFDA-SE),是一种可对活细胞进行荧光标记的新型染料,可以标记活体细胞。其基本原理如下:CFSE 是一种带有琥珀酰亚胺(NHS)的荧光染料,可以结合细胞内的蛋白质。CFSE 在结构上将酚羟基部位改造成 AM 体,所以自身不发荧光,荧光背景低,脂溶性高,能够轻易穿透细胞膜,在活细胞内与胞内蛋白共价结合,进入细胞内的 CFSE 的 AM 部位能被细胞内酯酶水解发出绿色荧光。CFSE 的琥珀酰亚胺(NHS)和细胞内蛋白质的氨基部位结合,固定在细胞内,不会漏出细胞外。CFSE 进入细胞后定位于细胞膜、细胞质和细胞核,在细胞核的荧光最强。
在细胞分裂增殖过程中,CFSE 的荧光强度会随着细胞的分裂而逐级递减,标记荧光可平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半,根据这一特性,它可被用于检测细胞增殖,细胞周期的估算及细胞分裂等方面。另外,CFSE 标记的细胞用于体内观察可以长达数周之久,它常被用来做活体细胞检测实验和用荧光电镜观察细胞长期活动的实验。有报道证实 CFSE 毒性小,不影响细胞的增殖能力。此方法操作简单,且不用放射性同位素,不存在安全隐患。可以更快速,更准确和更安全地得到想要的实验数据。


原理
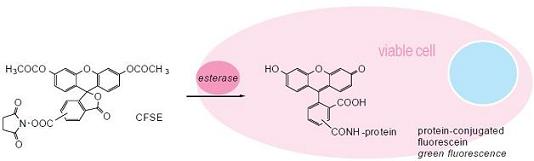
荧光特性
荧光波长:λex=496 nm, λem=516 nm
操作说明
*建议您在正式实验前先摸索一下细胞量、CFSE的终浓度、培养时间等,找到最佳实验条件。
配制试剂:
1、从冰箱中取出CFSE试剂,放至室温后再打开。盛放CFSE的管子开盖前请轻弹管壁几次,让粉末充分落入管底,必要时可采用离心的方法。
2、取0.9 ml DMSOa)加到CFSE管中溶解,配制成2 mM的CFSE母液b)(加入DMSO后请先盖上盖子,反复颠倒把盖子和管壁上的试剂洗到底部,并用移液器反复吹打使溶解完全)。
3、用PBS(-)或适当的缓冲液将其稀释成100 μM或其它浓度(如果采用载玻片观察法,建议浓度为20 μM的工作液c))。
a) DMSO需要保证新鲜无水,否则将会导致AM体水解,使荧光染料无法进入细胞,影响实验效果。
b) 由于CFSE母液遇水极易分解,所以建议分装保存,例如分装成5 μl/管。
方法:分装后用封口膜密封管口,再用锡箔纸包裹,最后和干燥剂一起用塑料袋密封,≦-20℃冷冻保存。
c) CFSE工作液应现配现用,因为CFSE吸水会分解,影响染色效果。
* PBS(-):不含钙和镁离子的PBS。
细胞染色(仅供参考):
例1 培养板观察法
1、准备细胞悬液,用PBS(-)等合适的培养基a)调整细胞浓度至约107个/ml。
2、取1ml细胞悬液至试管中,加入适量CFSE工作液,轻轻搅拌混匀(建议CFSE的终浓度参考相关论文或做个预实验:分别设定终浓度为0.5,1,2,5,10,20 μM…,以确定最佳染色浓度b))。
3、在37℃培养箱中培养15-30分钟。
4、离心后去上清,加入2 ml PBS溶液,再离心后去上清,重复此操作一次。
5、加入合适的培养基制成细胞悬液。
6、取500 μl的细胞悬液加在培养孔中,用荧光显微镜观察,看到荧光后,根据自己实验的要求调整细胞数量c)进行实验。
例2 载玻片观察法
1、准备1 ml细胞悬液,用PBS(-)等合适的培养基a)调整细胞浓度至约107个/ml。
2、取30 μl细胞悬液至试管中,加入10 μl浓度为20 μM的CFSE工作液(终浓度为5μM),轻轻搅拌混匀b)。
3、在37 ℃培养箱中培养15-30分钟。
4、滴10 μl的细胞悬液在载玻片上,用荧光显微镜观察,看到荧光后,根据自己实验的要求调整细胞数量C)进行实验。
*如果背景高的话,第3步之后需要洗去多余的CFSE:
离心后去上清,加入90 μl PBS溶液,再离心后去上清,重复此操作一次。
a)尽可能用不含血清的培养基,血清中的酶和蛋白质会分解CFSE,可能会影响染色效果。
b)如果荧光强度弱,可以适当提高CFSE的终浓度。如果细胞毒性大或背景太高,可以适当降低CFSE的终浓度,请摸索条件找到最佳浓度。
c)根据不同的实验目的和要求,采用稀释的方法调整细胞数量。
文献
1) M. Bronner-Fraser, “Alterations in Neural Crest Migration by a Monoclonal Antibody That Affects Cell Adhesion”, J. Cell Biol., 1985, 101, 610.
2) A. Nose and M. Takeichi, “A Novel Cadherin Cell Adhesion Molecule:Its Expression Patterns Associated WithImplantation and Organogenesis of Mouse Embryos”, J. Cell Biol., 1986, 103, 2649.
3) S. A. Weston and C. R. Parish, “New Fluorescent Dyes for Lymphocyte Migration Studies Analysis by Flow Cytometry and Fluorescent Microscopy”, J. Immunol. Methods, 1990, 133, 87.
4) C. K. Raymond, P. J. O’hara, G. Eichinger, J. H. Rothman and T. H. Stevens, “Molecular Analysis of the Yeast VPS3 Gene and the Role of Its Product in Vacuolar Protein Sorting and Vacuolar Segregation during the Cell Cycle”, J. Cell Biol., 1990, 111, 877.
5) G. Radcliff, R. Waite, J. Lefevre, M. D. Poulik and D. M. Callewaert, “Quantification of Effector/Target Conjugation Involving Natural Killer(NK) or Lymphokine Activated Killer(LAK) Cells by Two-color Flow Cytometry”, J. Immunol. Methods, 1991, 139, 281.
6) S. A. Weston and C. R. Parish, “Calcein: a Novel Marker for Lymphocytes Which Enter Lymph Nodes”, Cytometry, 1992, 13, 739.
7) L. S. D. Clerck, C. H. Bridts, A. M. Mertens, M. M. Moens and W. J. Stevens, “Use of Fluorescent Dyes in the Determination of Adherence of Human Leucocytes to Endothelial Cells and the Effects of Fluorochromes on Cellular Function”, J. Immunol. Methods, 1994, 172, 115.
常见问题Q&A
|
Q1 请告诉我如何使用CFSE。
|
|
A1:参考文献[1]中的描述如下所示。 杀死7-10周大的CBA / H小鼠,去除脾脏(或其他目标器官),然后浸入F15培养基(1%FCS)中。 然后,通过金属网获得细胞悬液,并通过离心除去红细胞,死细胞等。 将纯化的淋巴细胞悬浮在pH 7.0的PBS中至50,000,000细胞/ mL。 加入5.0μM浓度的CFSE,并在37°C下标记15分钟。悬浮在冰冷却的F15培养基(1%FCS)中并离心 用(350g,5分钟,20℃)洗涤两次。悬浮在F15培养基中。 静脉注射到CBA / H小鼠中。一定时间后,杀死鼠标并去除脾脏(或其他目标器官)。 切除淋巴细胞并分离并通过流式细胞仪分析。 参考文献[2]是关于钙黄绿素-AM的,但也通过与[1]相同的步骤将其与CFSE进行了比较。 【参考文献】 1. Susan A. Weston, Christopher R. Parish, J. Immunol. Methods, 133, 87 (1990). 2. Susan A. Weston, Christopher R. Parish, Cytometry, 13, 739 (1992). |
|
Q2:细胞染料的激发波长和发射波长是多少。 |
| A2: |

|
Q3:细胞染色试剂Cellstain的哪些活细胞染色染料可以在细胞中长时间停留? |
|
A3: “就细胞内保留而言,“ CFSE”可以在细胞中停留最长时间。尽管荧光强度降低,但是已经证实细胞中存在荧光染料达8周。用“ Calcein-AM”和“ BCECF-AM”观察到荧光达3天。也有报道称“钙蛋白-AM”在6小时内在细胞中保留了90%” ・S.A.Weston, et.al., J.Immunol.Methods, 133, 87-97(1990) ・H.P.Zhong, et.al., Hum.Immunol., 37, 264-270(1993)” 但是,“钙调蛋白-AM”和“ BCECF-AM”对细胞毒活性没有影响。 ・L.S.D.Clerck, et.al., J.Immunol.Methods, 172, 115-124(1994) 还要注意的一点是,原始的基本骨架是荧光素,因此由于激发光而褪色由于容易发生,因此可能难以通过长期激发来观察荧光。 (尽管最好使用防褪色剂等) |
关联产品




C16H17N2NaO9S
436.37