特点:
● 特异性外泌体定位,细胞外不聚集
● 回收率高
● 多种颜色可供选择


试剂盒内含

概述
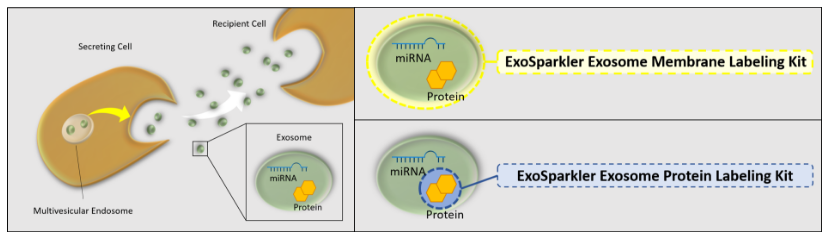
近年来研究发现,外泌体作为细胞外囊泡(Extracellular vesicle; EV)的一种,与癌症的恶化与转移密切相关, 外泌体相关的研究也逐渐成为了关注的热点。为了研究通过外泌体的细胞间通信,细胞摄入外泌体时的示踪技术非 常重要,然而目前广泛使用的磷脂双分子层的荧光染料存在明显的缺点(1. 染色后外泌体粒径增大。2. 荧光染料自身形成粒子,造成背景增高)。本产品是为了解决这些问题而开发的新型荧光染料,并且有 Green, Red, Deep Red 三种颜色,可满足多重染色在内的各种实验需求。
特点
特点1:外泌体的标记和纯化一步到位
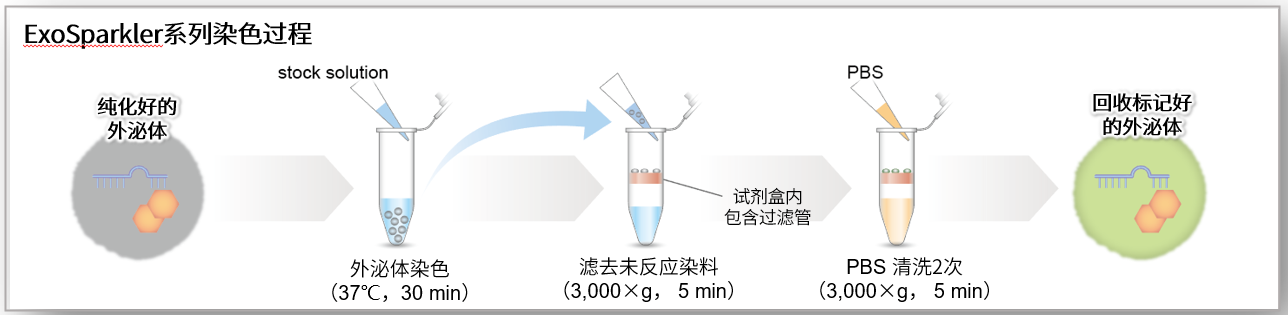
ExoSparkler系列已经对外泌体标记的最佳条件进行摸索并做成了操作手册,试剂盒内包含纯化所需的过滤管,可以简单快捷的进行外泌体的标记和纯化。
纯化方法(未反应染料的去除)的比较
ExoSparklar系列中用于除去未反应染料的过滤管,与以往使用的相同用途的凝胶过滤法相比,能够以更高的回收率纯化外泌体。
| 回收率 | |||||
| 过滤管(本试剂盒) | 50% | ||||
| 凝胶过滤法 | 10% | ||||
| ※本公司的实施例:通过NTA技术(纳米颗粒跟踪分析)比较提取前后的外泌体粒子数 | |||||
关于使用过滤管进行纯化的有效性,常见问题是:标记后的纯化操作时,过滤膜上有颜色残留,能否确定未反应的染料彻底分离了?详见Q&A。
特点2:多种颜色选择
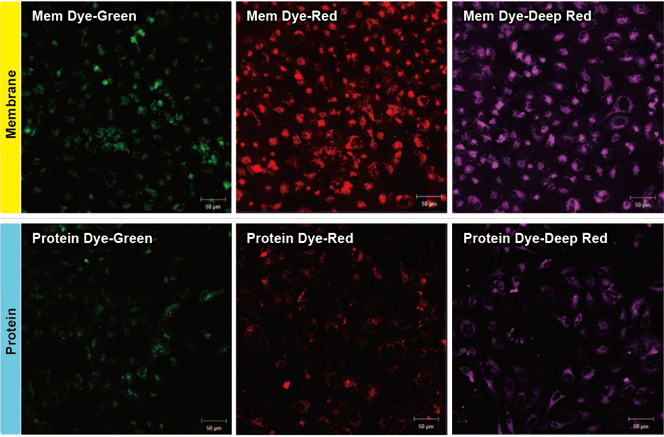
ExoSparkler系列包括膜 (Mem Dye)和蛋白质 (Protein Dye)荧光染色试剂,各三种颜色 (Green, Red, Deep Red)。
■实验条件
超速离心法纯化的外泌体(蛋白质的量为10 μg)经过各试剂染色后,与HeLa细胞(1.25×104 cells)一起培养24 h,清洗后进行荧光观察。
■观察条件
Green:
Ex: 488 nm / Em: 490-540 nm
Red:
Ex: 561 nm / Em: 570-640 nm
Deep Red:
Ex: 640 nm / Em: 640-760 nm
实验例
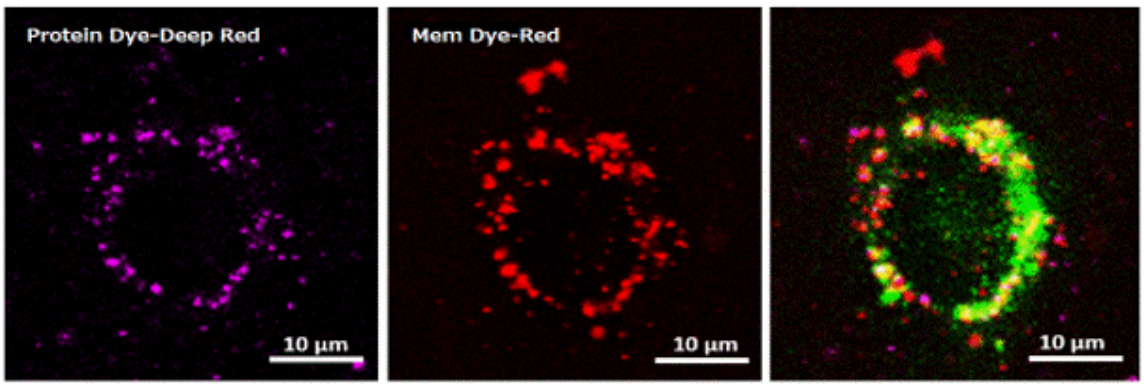
实验例:确认外泌体的局部存在
将用ExoSparkler Exosome Protein Labeling Kit-Deep Red(产品名称:EX06,Protein Dye-Deep Red)或ExoSparkler Exosome Membrane Labeling Kit-Red(产品名称:EX02,Mem Dye-Red)染色的外泌体添加到HeLa细胞中,通过与溶酶体染色试剂(绿色)共染确认了外泌体在细胞内的定位。结果证实,用蛋白质或膜染色的外泌体均位于溶酶体中。
观察条件
Protein Dye-Deep Red(紫):Ex:640 nm / Em:640-760 nm
Mem Dye-Red(红色):Ex:561 nm / Em:570-640 nm
溶酶体染色试剂(绿):Ex:488 nm / Em:490-540 nm
实验条件
将用超速离心法提取的外泌体(蛋白质量为5 µg)用每个外泌体染色试剂盒染色,添加到HeLa细胞(0.75×104cells)中,孵育3.5小时后对溶酶体进行染色,观察洗涤后的荧光图像。
| 产品名称 | 容量 | 货号 | |||
| 外泌体膜荧光染色试剂盒 | |||||
| (绿色)ExoSparkler Exosome Membrane Labeling Kit-Green | 5 samples | EX01 | |||
| (红色)ExoSparkler Exosome Membrane Labeling Kit-Red | 5 samples | EX02 | |||
| (深红色)ExoSparkler Exosome Membrane Labeling Kit-Deep Red | 5 samples | EX03 | |||
| 外泌体蛋白荧光染色试剂盒 | |||||
| (绿色)ExoSparkler Exosome Protein Labeling Kit-Green | 5 samples | EX04 | |||
| (红色)ExoSparkler Exosome Protein Labeling Kit-Red | 5 samples | EX05 | |||
| (深红色)ExoSparkler Exosome Protein Labeling Kit-Deep Red | 5 samples | EX06 | |||
| *纯化的外泌体(超离心法),蛋白质:1-10 µg/sample,粒子数:10-100×10^8个/sample | |||||
常见问题Q&A
| Q1:纯化外泌体建议用什么方法? |
| A1:一般我们推荐使用超速离心法纯化外泌体。但是,免疫沉淀法和磁珠法纯化的外泌体也有过成功染色的实例。 目前,聚合物沉淀法纯化的外泌体由于有聚合物的残留会影响外泌体的染色,所以无法使用本试剂盒。 |
| Q2:细胞摄取外泌体时使用的是哪种培养基? |
| A2:我们公司在做染色后外泌体进入细胞的实验时,使用过MEM(Minimum Essential Medium)和DMEM(Dulbecco’s Modified Eagle’s Medium)。目前我们公司一直采用的含血清培养基进行外泌体实验,暂时无法推荐无血清培养基。 |
| Q3:染色后的外泌体可以长期保存吗? |
| A3:染色后的外泌体不建议长期保存。染色后的外泌体最好尽快进行后续实验。 |
| Q4:标记后的纯化操作时,过滤膜上有颜色残留,能否确定未反应的染料彻底分离了? |
| A5:虽然在过滤膜上可以观察到颜色的残留,但是我们公司通过下面的实验验证了过滤膜上的回收产物里不含未反应的染料。 <实验条件> 超速离心法纯化的①含有外泌体(蛋白质含量10 µg)的缓冲液和②单纯缓冲液,分别按照试剂盒说明书记载的步骤进行染色操作。染色后的产物加入到HeLa细胞中(1.25×104 cells),4小时后进行荧光观察。 结果显示,单纯缓冲液染色后的回收产物加入到细胞后,没有观察到荧光,进而可证明回收产物中没有残留的染料。 |
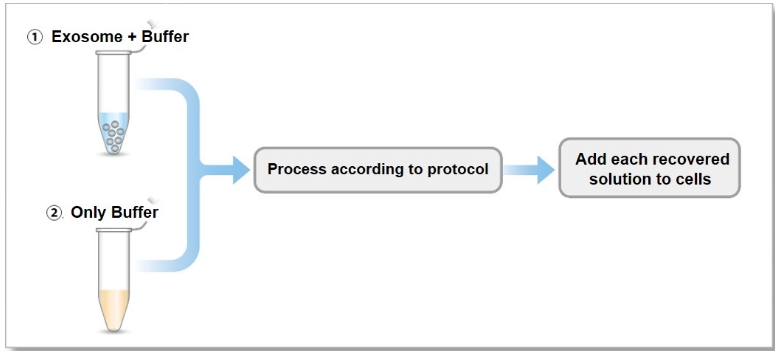
① Exosome + Buffer

② Only Buffer

Fluorescent images at 4 h incubation
Detection conditions
Green:Ex 488 nm / Em 490 – 540 nm
Red :Ex 561 nm / Em 570 – 640 nm
Deep Red:Ex 640 nm / Em 640 – 760 nm
