特点:
● APC标记的产品可以在大约2.5小时内制备。
● 可以标记分子量为50,000或更高的蛋白质。
● 可以标记50-200μg的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● 还可以通过使用附着的还原剂标记不具有游离SH基团的蛋白质。
● 可以使用随附的保存溶液保存APC标签。
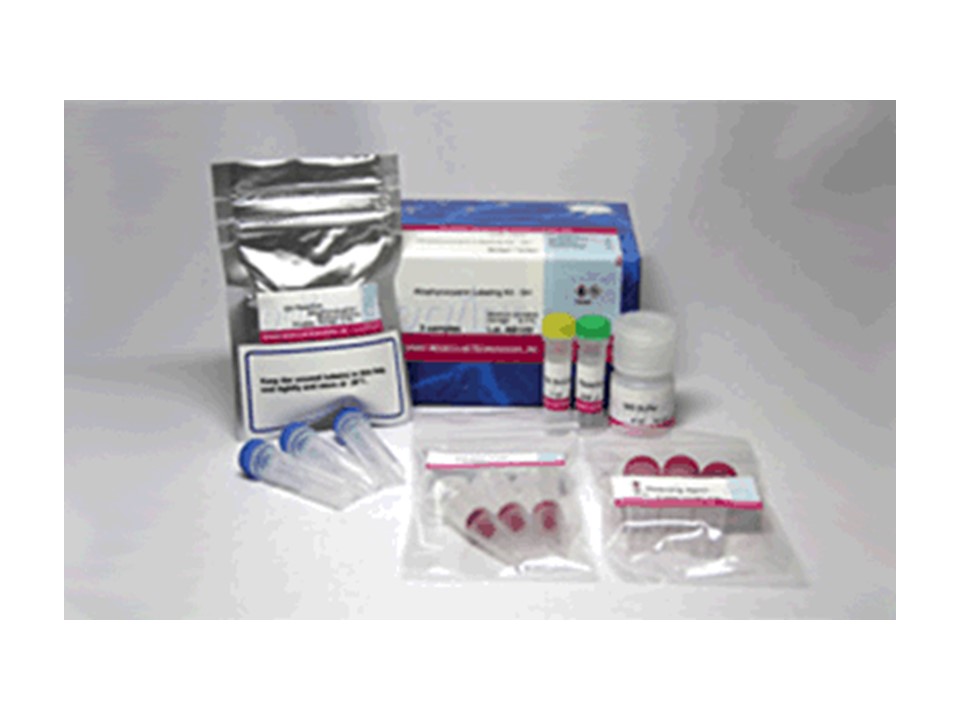
试剂盒内含

产品概述
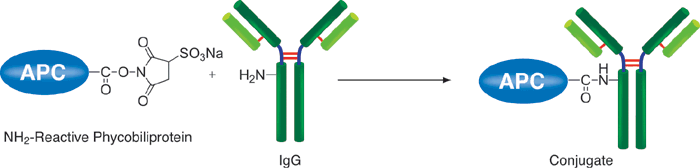
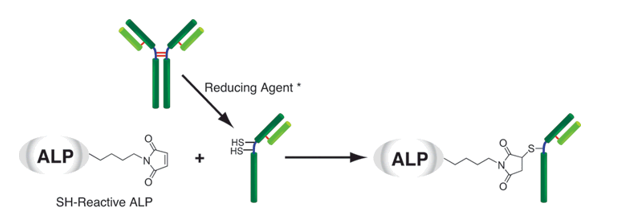
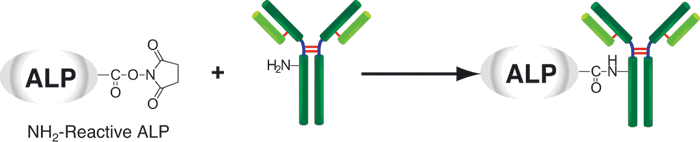
藻胆蛋白是一种从蓝藻和真核藻类中得到的荧光蛋白,它的荧光强度要比化学荧光探针,如荧光素和罗丹明高得多。因此,用藻胆蛋白标记的抗体和其他分子在做流式细胞术和免疫染色时具有很高的灵敏度。别藻蓝蛋白(APC)是一种藻胆蛋白,它在660nm附近有红色荧光,激发波长为488nm。Allophycocyanin Labeling Kit-SH能够简便快速地制备被APC标记的IgG,SH-reactive APC(该试剂盒的成分之一)具有一个马来酰亚胺基,不需任何活化就能够轻易地与靶分子中的巯基形成共价键。试剂盒中的Filtration tube能够快速交换缓冲液和浓缩样品IgG溶液。该试剂盒中包含了标记所需的全部溶液,包括制备带有SH的还原型IgG所需的还原剂以及储存标记产物的Storage buffer。
*APC: Allophycocyanin (别藻蓝蛋白)
原理
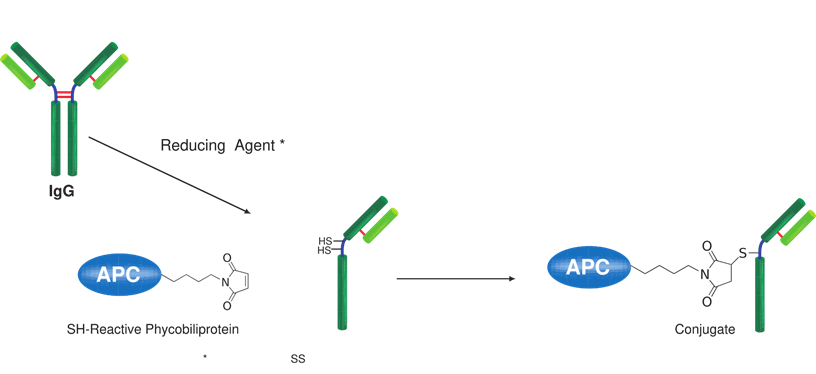
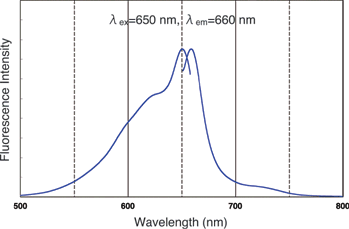
荧光特性
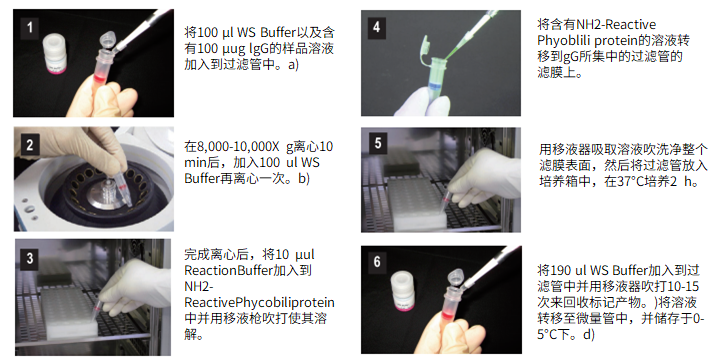
操作步骤
使用注意事项:
1. 用该试剂盒标记的蛋白质的分子量应当>50,000。
2. 在标记过程中,IgG或者Phycobiliprotein-IgG标记物始终在过滤管的滤膜上。
3. 如果IgG溶液中含有分子量>10,000的其他蛋白质,如BSA或明胶时,在使用该试剂盒标记前,先要纯化IgG溶液。IgG溶液能够用IgG Purification Kits (不包含于本试剂盒中) 来纯化。
4. 如果IgG溶液含有小的不溶物,离心后取上清液来进行标记。
标记IgG操作步骤:
(1)将100μl WS buffer以及含有100μg IgG的样品溶液加入到过滤管中。a)
(2)用移液器使溶液混合,然后8,000-10,000g离心10分钟。b)
(3)将150μl WS buffer加入到Reducing agent中并用移液器吹打数次使其溶解。
(4)从步骤3所得的溶液中,取100μl转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吹打数次后,37℃培养30分钟。
(6)将100μl RA solution加入到管中,8,000-10,000g离心10分钟。弃滤液,加入200μl RA solution,再离心一次。b)
(7)将50μl Reaction buffer加入到SH-reactive APC并吹打其溶解。
(8)将所得的SH-reactive APC溶液转移到被还原的IgG所集中的过滤管的膜上。
(9)用移液器吹打数次后,37℃培养1小时。
(10)加入150μl WS buffer并吹打10-15次来回收标记产物。c)将该溶液转移至0.5ml试管中,在0-5℃下保存。d)

a)样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到100μg。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记后产物的浓度为1.4-1.8mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个IgG分子上会被标记上1-2个APC分子。没有被结合的APC可能会干扰正常的免疫试验。如果需要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常APC标记后的IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以添加等量的丙三醇(终浓度:50%),并在-20℃下存放。但是,还要注意样品自身是否稳定。
产品优势
1)APC标记的产品可以在大约2.5小时内制备。
2)可以标记分子量为50,000或更高的蛋白质。
3)可以标记50-200μg的蛋白质。
4)可以通过使用过滤管的分离操作以高回收率获得标记物质。
5)还可以通过使用附着的还原剂*标记不具有游离SH基团的蛋白质。
6)可以使用随附的保存溶液保存APC标签。
*还原剂针对减少IgG的制备而优化。当使用带有除IgG以外的S-S键的样品时,由于S-S键的断裂,可能会失去待标记分子的活性。请在确认不会发生因还原引起的失活后使用。
常见问题Q&A
| Q1:能够用这个试剂盒标记其他蛋白质吗? |
| A:可以。只要标记分子的分子量>50,000且具有活性氨基结构。参照IgG的标记操作说明,可以标记0.5-1 nmol的蛋白样品。 |
| Q2:在与IgG反应后,未标记的NH2-reactive APC是否仍含有活性酯基? |
| A:没有。反应过程中,活性酯基完全被水解了 |
| Q3:标记小分子蛋白质(分子量50,000或以下)的方法 |
| A:由于该试剂盒中包含的过滤管是分子量截断值为30K的超滤过滤器,因此我们建议使50,000或分子量更大的蛋白质,并留有余量。
当标记分子量为50,000或更小的蛋白质时,可以通过更换为分子量分数较小的超滤过滤器来标记甚至很小的蛋白质,如下所示。 —————————————— PALL Nanocep 3K产品编号OD003C33 PALL Nanocep 10K产品编号OD010C33 —————————————— 离心所需的时间可能比试剂盒中随附的过滤器要长,因此请注意离心时间。 |
|
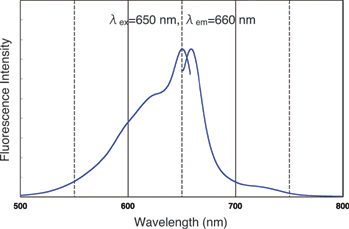
Q4:荧光蛋白分为三种,每种的波长特征是什么? |
| A:别藻蓝蛋白(缩写:APC)激发波长:650nm发射波长:660nm
B-藻红蛋白(缩写:B-PE)激发波长:564nm发射波长:575nm R-藻红蛋白(缩写:R-PE)激发波长:564nm发射波长:575nm |
| Q5:标记反应过程中,NH2-reactive APC是否会形成一些低聚物 |
| A:不会。由于NH2-reactive APC中的所有氨基都被阻断,因此不会有低聚物生成。 |
|
Q6:能够用这个试剂盒标记其他蛋白质或者多肽吗? |
|
A:可以,只要标记分子的还原型分子量>50,000且具有活性巯基结构或者可被还原且不会失活的二硫化物。参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品。 |
|
Q7:能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
|
A:不行。寡核苷酸或者寡肽可能因为分子量太小而不能存在于滤膜上。 |
| Q8:每个IgG能够标记多少个APC分子 |
| A:每个IgG平均能标记上1-2个APC分子。 |
|
Q9:是否必须要使用试剂盒所包含的WS Buffer? |
| A:是的,要用WS Buffer来制备标记产物的储存液。但是,可以选择任何适合于该实验的缓冲液来稀释储存液。 |
|
Q10:标记产物能保存多久? |
| A:在4℃下能够保存2个月。如果需要保存更久,可以添加等量的丙三醇,并在-20℃下存放。但是,还要注意样品自身是否稳定。 |