特点:
● 荧光法高敏检测胞内二价铁
● 适合于多种检测仪器
● 铁死亡常见指标之一

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Liperfluo 细胞脂质过氧化物检测
NO.2. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.3. Cell Counting Kit-8 细胞增殖毒性检测
NO.4. Mito-FerroGreen 线粒体内亚铁离子检测
NO.5. ROS Assay Kit 活性氧检测
规格性状
性状:可溶于乙腈,甲醇和二甲基亚砜。
纯度(HPLC):92.0%以上
荧光光谱:符合一致性
产品概述
铁是生物体内最丰富的过渡金属元素,它参与各种生理过程活动。 近年来,活细胞中的游离铁受到广泛关注, 游离铁最常以其稳定的氧化还原态存在,即亚铁离子 (Fe2+) 和铁离子 (Fe3+)。对研究者来说,在研究细胞内的还原环境,金属转运蛋白和Fe2+的水溶性时,了解Fe2+的行为比了解Fe3+的行为更为重要。FerroOrange作为一种新型的荧光探针,可对活细胞内的Fe2+进行荧光成像。
原理
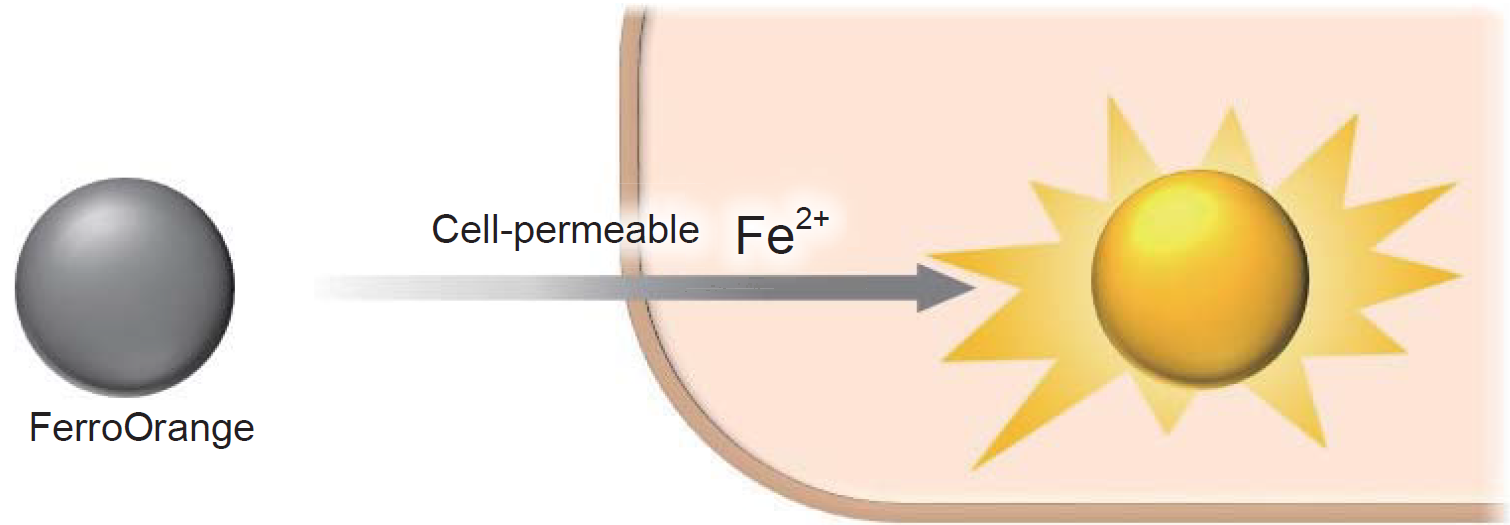
FerroOrange检测胞内Fe2+
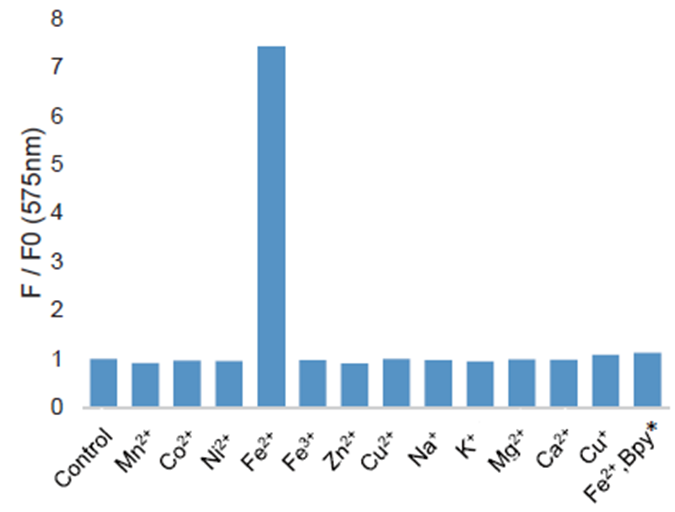
图为将2 μl的1 mmol/l FerroOrange和2 μl的10 mmol/l的各种金属离子添加到1 ml的50 mmol/l HEPES缓冲液(pH 7.4)中,并在室温下反应1小时后测量的荧光强度。
荧光特性
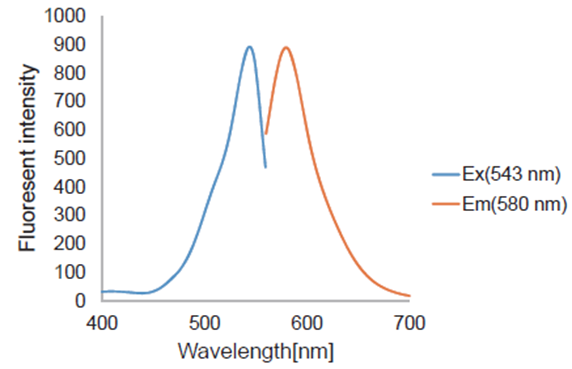
Ex:543 nm Em:580 nm
铁离子试剂的选择
| FerroOrange | Mito-FerroGreen | |
| 存在部位 | 细胞内 | 线粒体 |
| 荧光特性 | λex : 543 nm、λem : 580 nm | λex : 505 nm、λem : 535 nm |
| 检测仪器 | 荧光显微镜、荧光酶标仪(Cy3) | 荧光显微镜(FITC、GFP) |
| 测定对象 | 活细胞 | 活细胞 |
| 检测次数 | 24μg可染色17次35mm dish (终浓度为1μmol/l) |
50μg可染色5次35mm dish (终浓度为5μmol/l) |
与其他染料共染
FerroOrange与各种细胞内的染色试剂共染
用各种染色试剂染色HeLa细胞,清洗细胞。然后将FerroOrange添加到细胞中,并用荧光显微镜观察。
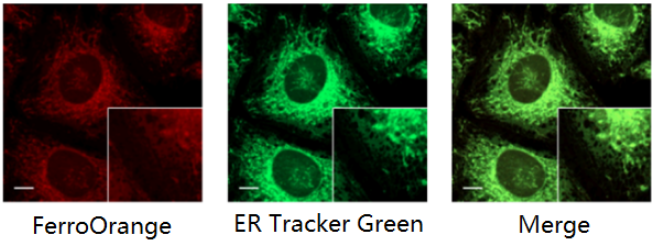
与ER染色试剂共染
<检测条件>
FerroOrange: Ex: 561 nm、Em: 570-620 nm
ER Tracker Green(ER染色试剂): Ex: 488 nm、Em: 510-555 nm
标尺: 10 μm
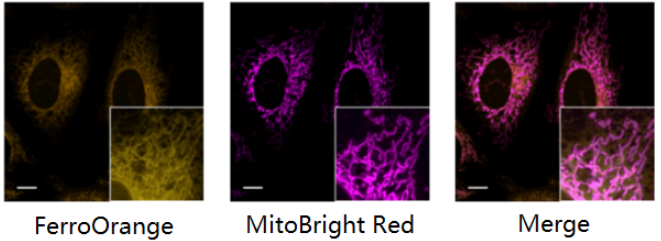
与线粒体染色试剂共染
<检测条件>
FerroOrange: Ex: 561 nm、Em: 570-620 nm
MitoBright Deep Red(线粒体染色试剂): Ex: 640 nm、Em: 650-700 nm
标尺: 10 μm
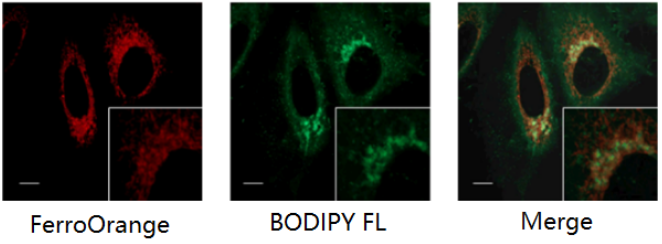
与高尔基体染色试剂的共染
<检测条件>
FerroOrange: Ex: 561 nm、Em: 570-620 nm
BODIPY FL(高尔基体染色试剂): Ex: 488 nm、Em: 510-555 nm
标尺: 10 μm
操作步骤
1.细胞接种于荧光培养皿中,在37℃,5% CO2培养箱中孵育过夜。
2.弃去上清液,并用HBSS或无血清培养基洗涤细胞3次。
3.更换含有药物的培养基,在37℃,5% CO2培养箱中孵育。
* 请根据药物特性优化孵育时间。
4.加入浓度为1 μmol/l的FerroOrange工作液,在37℃,5% CO2培养箱中孵育。
* 加入FerroOrange染色剂后请立即观察,不要洗涤。
5.在荧光显微镜下观察细胞。
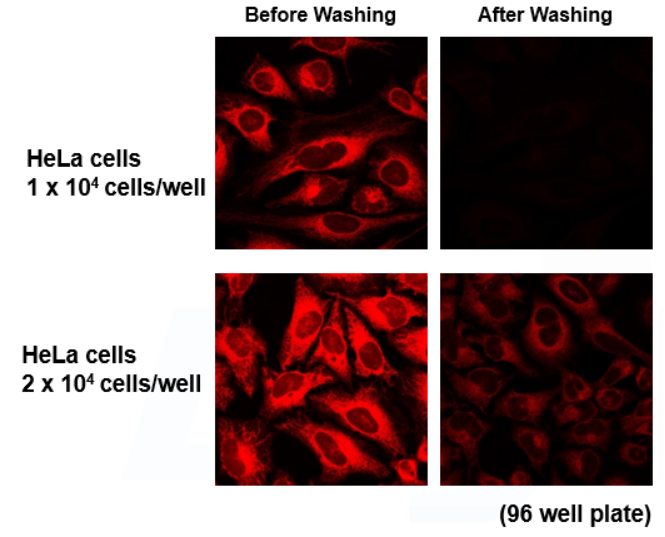
高灵敏度检测胞内铁离子
使用HeLa细胞,通过FerroOrange确认细胞内Fe2+的变化
与对照组的细胞相比,用硫酸亚铁 (II) 铵处理的HeLa细胞的FerroOrange荧光强度增加。 相反,在用Bpy处理的细胞中,其荧光强度降低。
因此,证明FerroOrange与细胞内Fe2+反应。
A: 对照组
B: 铁剂·硫酸亚铁(II) 铵(终浓度100umol/l)处理
C: 铁螯合剂·2,2′-Bipyridyl (Bpy)(终浓度100umol/l)处理

检测条件 Ex/Em = 561 nm/570-620 nm 比例尺:20 μm
使用流式细胞仪检测
通过流式细胞仪进行定量分析
——FerroOrange的荧光强度可能受细胞密度和细胞种类的影响
——培养基的更换和清洗可能使染料从细胞内泄露
——进行流式定量分析时,需优化实验步骤

<Usage Example>
1. HeLa cells (1 x105 cells/well) in MEM (10% fetal bovine serum, 1% penicillin-streptomycin) were seeded on a 6 well plate and were cultured at 37oC in a 5% CO2 incubator overnight.
2. The cells were washed with serum-free medium (2 mL) three times. Then, serum-free medium (1 mL) was added to the cells.
3. 10 mmol/L Ammonium iron (II) sulfate (10 μL) was added to wells (The final concentration: 100 μmol/L).
4. To mix Ammonium iron(II) sulfate and serum-free medium, the entire medium was pipetted up from wells and then immediately pipetted back one time.
5. The cells were incubated for 20 min in a 37oC incubator equilibrated with 95% air and 5% CO2, and the cells were washed with HBSS (1 mL) three times.
6. After trypsinization (250 µL), stop the reaction with serum medium (1 mL), 1.25 ml of the cell suspension was transferred to a microcentrifuge tube.
7. The cells suspension was centrifuged at 1,500 rpm for 3 minutes.
8. The supernatant was discarded and HBSS (1 mL) was added to the microcentrifuge tube and suspended by pipetting.
9. The cells suspension was centrifuged at 1,500 rpm for 3 minutes and the supernatant was discarded.
10. 1 μmol/L FerroOrange in MEM (serum-free medium) (300 μL) was added to the cells.
11. The cells were incubated for 15 -30 min in a 37oC incubator equilibrated with 95% air and 5% CO2.
12. The stained cells were passed through a cell strainer and analyze samples using a flow cytometer.
<注意点>
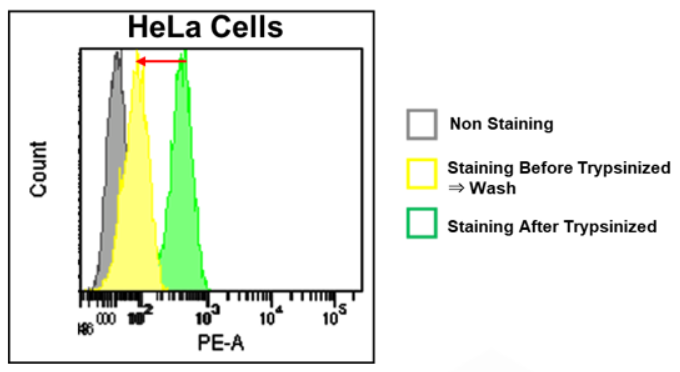
1.清洗对于结果分析的影响
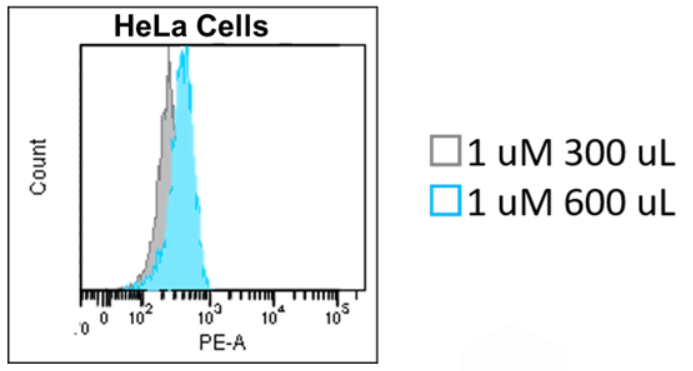
2.染料体积对于结果分析的影响
常见问题Q&A
| Q1:FerroOrange由于是活细胞荧光探针,如果铁死亡发生,导致细胞膜破裂后,荧光是否存在? |
| A1:由于FerroOrange是活细胞探针,对死细胞无法发挥出探针的正常性能。 |
| Q2: FerroOrange只会检测游离铁吗?还是某些如铁硫蛋白里的结合铁,都可以检测吗? |
| A2:FerroOrange只检测游离的二价铁 |
| Q3: 有哪些帮助实验成功的技巧? |
| A3:(1)染色后不要清洗工作液,因为这样可能会让细胞内的FerroOrange泄露出来。
(2)为了获得更加可靠的实验数据,我们建议准备Bpy(2,2`联吡啶,抑铁剂)或硫酸亚铁铵(增铁剂)处理的细胞作为对照组,以便于FerroOrange的数据进行比较。 |
| Q4: FerroOrange能否用于固定处理之后的样本? |
| A4:不能用于石蜡切片。
试剂能尝试于温和条件下固定处理之后的样本,如多聚甲醛(PFA,终浓度3%)在4°C中培养10 min。与未固定的样本相比,固定20 min以上或室温固定后的样本的荧光强度会明显降低。请注意本探针可能很难于固定样本中使用,必须先进行染色,然后做尝试。 |
| Q5:本探针适合于什么检测方式? |
| A5:见表格
我们建议使用绿色激光(Ex:532 nm)激发FerroOrange |
| Q6:染色时需要注意什么? |
| A6:注意如下,
1.FerroOrange染色后的对培养基的更换。 染色后无需清洗工作液,通常血清中含有铁离子,请注意使用不含血清的培养基,所以染色后即使细胞外有残留的FerroOrange,但是因为细胞外没有血清中铁离子的影响,也不会产生背景荧光的问题。 2.细胞难以染色(灵敏度低)时的办法。 根据细胞种类的不同,染色程度也有差异。 使FerroOrange working solution浓度高于推荐的1 µmol/l进行染色。建议在1-5 µmol/l范围内染色。 |
| Q7:使用荧光酶标仪的操作步骤 |
| A7:请参考下面的实验例子进行测量。
<测定样品>。 样品A:无添加剂(仅HeLa细胞)。 样品B:添加了铁螯合试剂2,2`-bipyridyl(Bpy)的HeLa细胞。 样品C:添加铁(硫酸铵铁)的HeLa细胞。 <测量操作>。 1.在96孔黑板(透明底)上接种100 µl HeLa细胞悬液,使其达到10,000 cells/well,在37℃ 5%CO2 培养箱中过夜培养。 2.样品C的细胞用MEM(不含FBS)100 µl洗涤3次。 3.向样品C中添加100 μl硫酸铵铁(II)/MEM(不含FBS) (最终浓度: 100 µmol/l),在37℃ 5%CO2培养箱中静置30分钟。 4.用100 µl HBSS洗涤所有孔的细胞3次。 5.向样品A和C中添加100 μl的1 µmol/l FerroOrange working solution ,向样品B中添加100 μl含有FerroOrange(最终浓度:1 µmol/l)和Bpy(最终浓度:100 µmol/l)的HBSS溶液,在37℃ 5%CO2培养箱中培养30分钟。 6.用多功能读板器检测各样品的荧光强度(Ex:543 nm,Em:580 nm)。 |
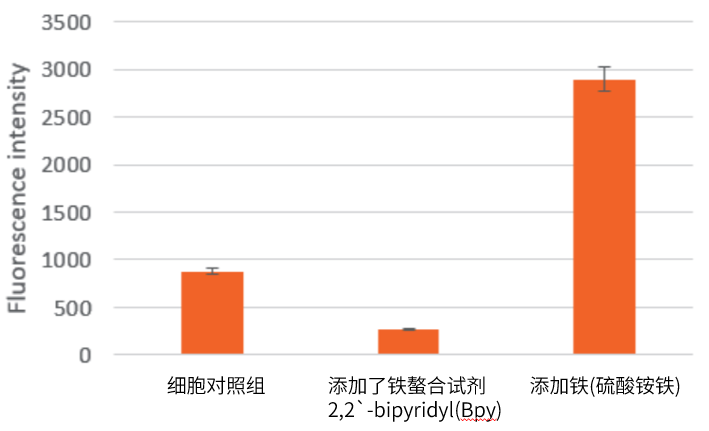
| Q8:推荐的滤光片 |
| A8: 激发滤光片:530-565 nm
发射滤光片:570-620 nm |
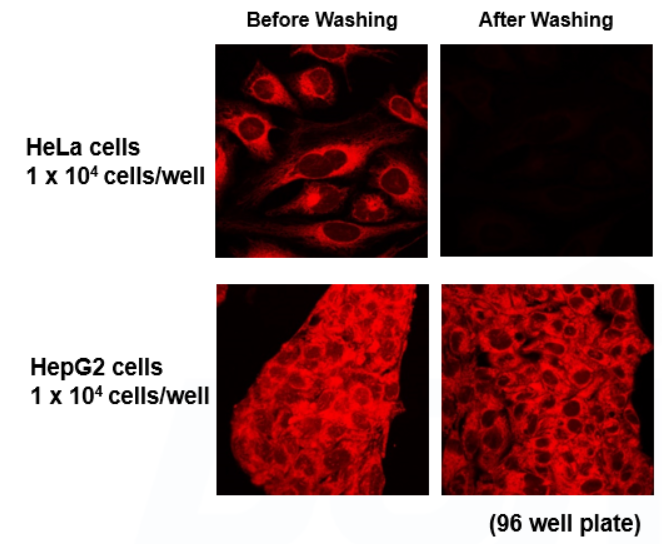
| Q9: FerroOrange染色后是否有必要洗掉工作液? |
| A9:我们建议染色后不要清洗,因为这样可能会导致细胞中的FerroOrange泄露出来。
以下有关于不同细胞密度和细胞种类确认的情况, <不同细胞密度>
<不同细胞种类>
|
参考文献
1.K. Tomita, M. Fukumoto, K. Itoh, Y. Kuwahara, K. Igarashi, T. Nagasawa, M. Suzuki, A. Kurimasa and T. Sato, “MiR-7-5p is a key factor that controls radioresistance via intracellular Fe2+ content in clinically relevant radioresistant cells.”, Biochem. Biophys Res Commun., 2019,DOI: 10.1016/j.bbrc.2019.08.117
2.Y. Wang and M. Tang, “PM2.5 induces ferroptosis in human endothelial cells through iron overload and redox imbalance”, Environ. Pollut., 2019, 264,DOI: 10.1016/j.envpol.2019.07.105
3.S Guo, X Yao, Q Jiang, K Wang, Y Zhang, H. Peng, J. Tang and W. Yang , “Dihydroartemisinin-Loaded Magnetic Nanoparticles for Enhanced Chemodynamic Therapy”, Front Pharmacol,2020,11,226.DOI: 10.3389/fphar.2020.00226
4.R. A. Weber, F. S. Yen, S.P.V. Nicholson, H. Alwaaseem, E.C. Bayraktar,M. Alam, R. C. Timson, K. La, M. Abu-Remaileh, H. Molina and K. Birsoy, “Maintaining Iron Homeostasis Is the Key Role of Lysosomal Acidity for Cell Proliferation”, Mol. Cell, 2020, 77, 1-11.DOI: 10.1016/j.molcel.2020.01.003
5.X. Li, T. Wang, X. Huang, Y. Li, T. Sun, S. Zang, K. Guan, Y. Xiong, J. Liu and H. Yuan , “Targeting ferroptosis alleviates methionine‐choline deficient (MCD)‐diet induced NASH by suppressing liver lipotoxicity”, Liver Int., 2020,DOI: 10.1111/liv.14428
6.T. Hirayama, M. Niwa, S. Hirosawa and H. Nagasawa, “High-Throughput Screening for the Discovery of Iron Homeostasis Modulators Using an Extremely Sensitive Fluorescent Probe”, ACS Sens., 2020,DOI: 10.1021/acssensors.0c01445
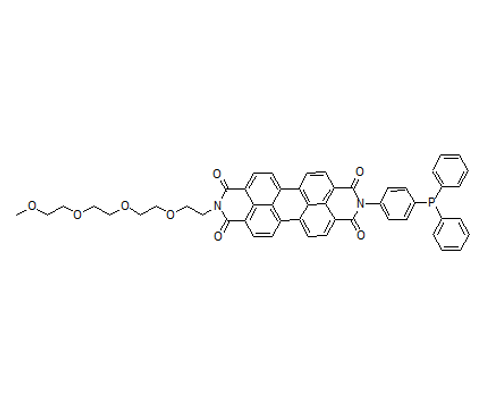
论文6中记载的 “RhoNox-4”的化合物就是“FerroOrange”。
关联产品