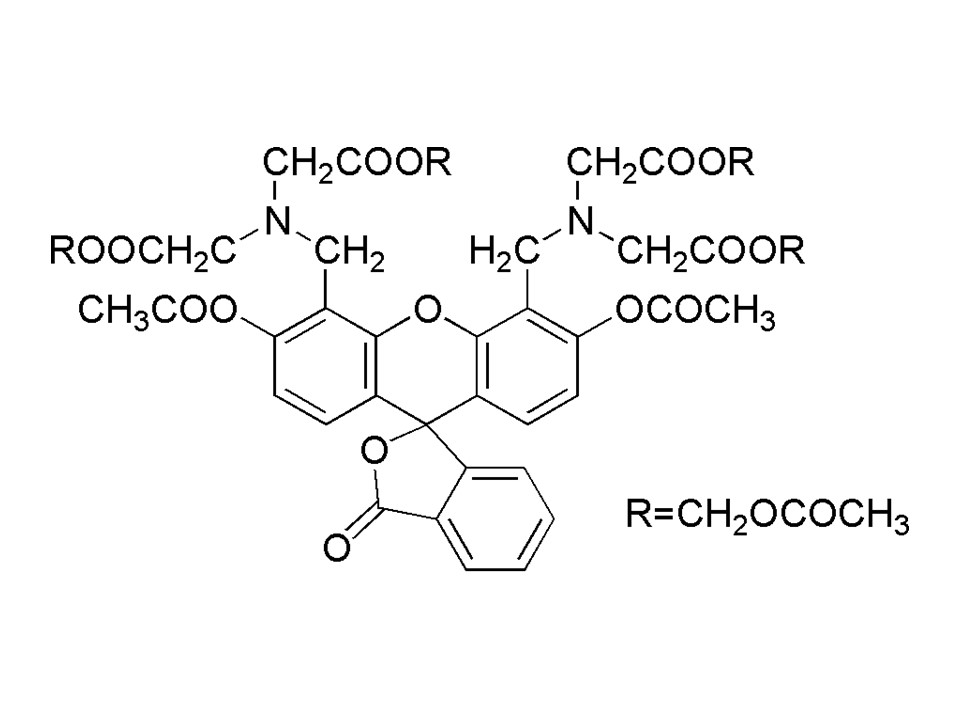
C46H46N2O23
994.86
特点:
● 活细胞和死细胞可同时染色
● 490 nm激发波长,515 nm发射波长

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. Cellstain- PI 细胞核染色
NO.5. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
规格性状
规格
特性:该产物为无色至微黄色固体,可溶于二甲基亚砜和乙腈。
可溶于二甲基亚砜:试验成功
NMR光谱:试验成功
产品概述
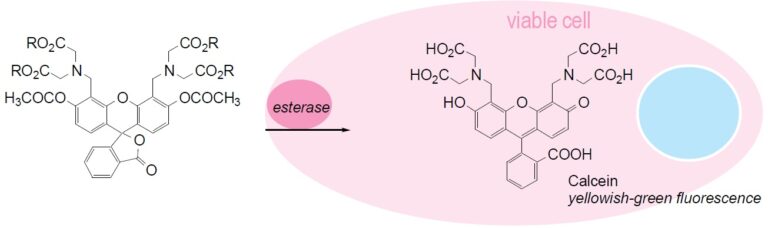
Calcein-AM是一种可对活细胞进行荧光标记的细胞染色试剂,由于它在Calcein的基础上加强了疏水性,因此能够轻易穿透活细胞膜。当其进入到细胞质后,酯酶会将其水解为Calcein留在细胞内,发出强绿色荧光。与其它同类试剂 (如BCECF-AM和Carboxy-fluorescein diacetate) 相比,Calcein-AM是最适合作为荧光探针去染活细胞的,因为它的细胞毒性很低。Calcein不会抑制任何的细胞功能如增殖或淋巴球的趋化性。使用了Calcein的活性检测的实验结果是十分可信并且与标准的51Cr-释放法所得结果相一致的。Calcein的激发和发射波长分别为490nm和515nm。
Calcein-AM可与PI结合使用,分别对活细胞和死细胞染色,可用于同时对活细胞和死细胞进行荧光染色。
*Caution*
Please tap the tube before opening, and open it with care. The content may have relocated from the bottom of the tube during the shipping.
*警告*
打开前请先轻敲试管,并小心打开。 在运输过程中,内装物可能已从试管底部移开。

原理
Fig. 1 Cell staining mechanism
产品特性
钙黄绿素-AM通过钙黄绿素的四个羧基的乙酰氧基甲基酯化(AM转化)而使其可透过细胞膜。钙黄绿素-AM本身几乎不显示荧光,但通过细胞内酯酶水解变成钙黄绿素。该钙黄绿素是不透膜的化合物,表现出强的黄绿色荧光(λex= 490 nm,λem= 515 nm)。羧基荧光素二乙酸盐(CFDA)和荧光素二乙酸盐(FDA)与荧光素-AM具有相同的荧光素骨架,被称为染色活细胞的染料。但是,这些化合物在显色后容易从细胞膜泄漏,这已成为使用中的问题之一。与这些染料相比,钙黄绿素-AM越来越多地用作显色后从细胞泄漏较少的染料。还已知它不抑制细胞功能,例如淋巴细胞增殖和白细胞趋化性。另外,钙黄绿素-AM在利用杀伤性T细胞和NK细胞的细胞毒性活性的测定中,与使用广泛使用的放射性同位素的51Cr释放方法得到相同的结果,因此细胞毒性较小。钙黄绿素-AM对活细胞染色,并用于在荧光显微镜和流式细胞仪下观察,但是当与死细胞染色染料组合使用时,常用于活细胞和死细胞的双重荧光染色。Papadopoulus等人使用Calcein-AM和Ethidium homodimer(EthD-1)进行双重染色,并使用两种染料的荧光波长差异通过流式细胞术研究细胞毒性。钙黄绿素-AM目前是用于染色活细胞的最有用的染料,因为它的细胞毒性较小,荧光后细胞泄漏较少。如上所述,目前正在使用放射性同位素的测量方法,但是从安全性和便利性的角度出发,期望使用荧光化合物的细胞研究的分析将继续进行。
荧光特性
λex=490 nm, λem=515 nm
操作说明
1. 用1ml无水DMSO溶解1 mg Calcein-AM,制备成1 mmol/l的Calcein-AM母液,-20℃下密闭冷冻保存。
2. 用PBS将Calcein-AM母液稀释制成1-50 µM的Calcein-AM溶液(现配现用)。
3. 吸掉预培养好的细胞中的培养基,用合适的缓冲液清洗2-3次。a)
4. 加入适量的Calcein-AM溶液,在37℃培养细胞15-30分钟。
5. 用PBS或适当的缓冲液洗涤细胞两次。
6. 用490 nm激发波长,515 nm发射波长的滤光片的荧光显微镜观察细胞。
a) 如果Calcein-AM很难进入细胞,可以使用表面活性剂,如Pluronic® F127。
参考文献
1) K. McGinnes, G.Chapman, R.Marks and R.Penny, “A Fluorescence NK Assay Using Flow Cytometry”, J.Immunol.Methods,1986,86,7.
2) S.J.Morris,”Real-time Multi-wavelength Fluorescence Imaging of Living Cells”, BioTechniques,1990,8(3),296.
3) S.A.Weston and C.R.Parish,”New Fluorescent Dyes for Lymphocyte Migration Studies Analysis by Flow Cytometry and Fluorescent Microscopy”, J.Immunol.Methods,1990,133,87.
4) D.M.Callewaert,G.Radcliff,R.Waite,J.Lefevre and D.Poulik,”Characterization of Effector-Target Conjugates for Cloned Human Natural Killer and Human Lymphokine Activated Killer Cells by Flow Cytometry”,Cytometry,1991,12,666.
5) Han-Qing Xie, R.Huang and V.W.Hu, “Intercellular Communication Through Gap Junctions Is Reduced in Senescent Cell”, Biophys.J,1992,62,45.
6) S.A.Weston and C.R.Parish,”Calcein: a Novel Marker for Lymphocytes Which Enter Lymph Nodes”,Cytometry,1992,13,739.
7) X.M.Wang, P.I.Terasaki,G.W. Rankin Jr. ,D.Chia,H.P.Zhong and S.Hardy,”A New Microcellular Cytotoxicity Test Based on Calcein AM Release”, Hum. Immunol.,1993,37,264.
8) N.G.Papadopoulos,G.V.Dedoussis,G.Spanakos,A.D.Gritzapis, C.N.Baxevanis and M.Papamichail,”An Improved Fluorescence Assay for the Determination of Lymphocyte-Mediated Cytotoxicity Using Flow Cytometry”, J.Immunol.Methods,1994,177,101.
9) L.S.De Clerck,C.H.Bridts,A.M.Mertens,M.M.Moens and W.J.Stevens,”Use of Fluorescent Dyes in the Determination of Adherence of Human Leucocytes to Endothelial Cells and the Effects of Fluorochromes on Cellular Function”, J.Immunol. Methods,1994,172,115.
10) H.Ohata,Y.Ujiki and K.Momose,”Confocal Imaging Analysis of ATP-Induced Ca2+ Response in Individual Endothelial Cells of the Artery in Situ”, Am.J.Physiol. ,1997,272(6),1980.
常见问题Q&A
| Q1:与51Cr释放方法有关吗 |
|
A1: “钙黄绿素-AM与51Cr释放方法之间存在相关性。 以下文件中有一份报告。N.G.Papadopoulos, et.al., J.Immunol.Methods, 177,101-111(1994)” |
|
Q2:细胞染料的激发波长和发射波长是多少。 |
| A2: |
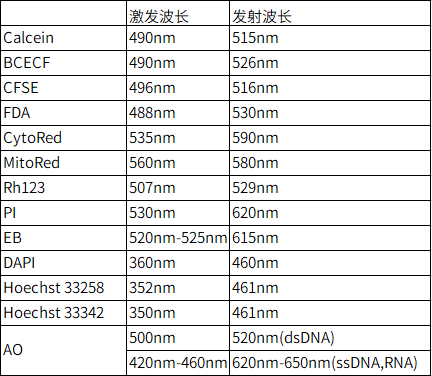
|
Q3:细胞染色试剂Cellstain的哪些活细胞染色染料可以在细胞中长时间停留? |
|
A3: “就细胞内保留而言,“ CFSE”可以在细胞中停留最长时间。尽管荧光强度降低,但是已经证实细胞中存在荧光染料达8周。用“ Calcein-AM”和“ BCECF-AM”观察到荧光达3天。也有报道称“钙蛋白-AM”在6小时内在细胞中保留了90%” ・S.A.Weston, et.al., J.Immunol.Methods, 133, 87-97(1990) ・H.P.Zhong, et.al., Hum.Immunol., 37, 264-270(1993)” 但是,“钙调蛋白-AM”和“ BCECF-AM”对细胞毒活性没有影响。 ・L.S.D.Clerck, et.al., J.Immunol.Methods, 172, 115-124(1994) 还要注意的一点是,原始的基本骨架是荧光素,因此由于激发光而褪色由于容易发生,因此可能难以通过长期激发来观察荧光。 (尽管最好使用防褪色剂等) |
| Q4:如何使用Calcein-AM。 |
|
A4:下面以HeLa细胞的情况为例进行介绍。 根据细胞类型和观察条件考虑并固定试剂浓度。 【试剂】 溶液A:将1 mg钙黄绿素-AM溶于1 ml DMSO→1 mmol / L溶液 *将溶液存放在-20°C的阴凉处,以防止变质。 溶液B:用PBS(-)将溶液A稀释500倍(用5 mL PBS稀释10μl溶液A得到2μmol/ L)。 * Calcein-AM在水溶液中分解,因此在使用前请准备溶液B。 【操作】 1)用胰蛋白酶-EDTA收集HeLa细胞并制备细胞悬液。 2)离心细胞悬液(1,000 rpm,3分钟) 3)除去上清液并添加PBS(-)(此时,准备细胞数为105至106细胞/ mL)。 4)用移液器充分分散。 *由于培养液中的血清可能会升高背景,请执行操作2)至4)。 重复并彻底清洗。 5)将30μl在4)中获得的细胞悬液添加至1.5ml微管中。 6)向其中加入15μL[液体B]。 7)盖上微管并在37°C下孵育15分钟。 8)将10μL7)的溶液放在盖玻片上,从上方堆叠盖玻片,然后将染色的细胞悬液夹在中间。 9)将盖玻片放在荧光显微镜下,用490 nm的滤光片激发,观察发出黄绿色荧光的活细胞。 (对于滤光片,如果是490±10 nm,则可以观察到) *排除血清和酚红,因为它们是背景。 *如果背景很高,请清洁它。 *在载玻片上培养的细胞可以用相同的方式染色和观察。 *有关使用PI的双重染色方法,请参阅方案“我要分别对活细胞和死细胞进行染色”。 |
|
Q5:我已经购买了钙黄绿素-AM(粉末),并希望将其制成溶液。 我该怎么办? |
|
A5:溶于DMSO。 分子量几乎为1000,因此,如果将1 mg溶于1 mL DMSO,它将是1 mM的溶液。 请使用尽可能干燥的DMSO。 |
