特点:
● 只需添加小分子量荧光试剂即可轻松检测线粒体
● 可以使用荧光显微镜进行活细胞成像
● 可以与附着的溶酶体染色剂同时染色
关联产品





特点:
● 只需添加小分子量荧光试剂即可轻松检测线粒体
● 可以使用荧光显微镜进行活细胞成像
● 可以与附着的溶酶体染色剂同时染色
关联产品





特点:
● 固定后仍可检测
● 荧光滞留性强
● 灵敏度高


产品解说
产品概述
线粒体利用氧气合成ATP,从而产生细胞所需的能量,是重要的细胞器之一。线粒体活性低下和机能障碍与癌症、老化、阿尔茨海默病、帕金森病等神经变性疾病密切相关。因此,线粒体膜电位(MMP)作为线粒体相关疾病的一个有希望的靶点已被广泛研究。
产品特点
解决传统试剂的三个问题
观察线粒体膜电位时,使用JC-1、TMRE、TMRM,但由于PFA不可固定、容易淬灭,数据的再现性等问题。MT-1 MitoMP Detection Kit是克服了这些问题的线粒体膜电位的检测试剂。
并且,通过本试剂盒中包含的Imaging Buffer,可以在抑制了荧光背景和对细胞的损伤的状态下进行观察。
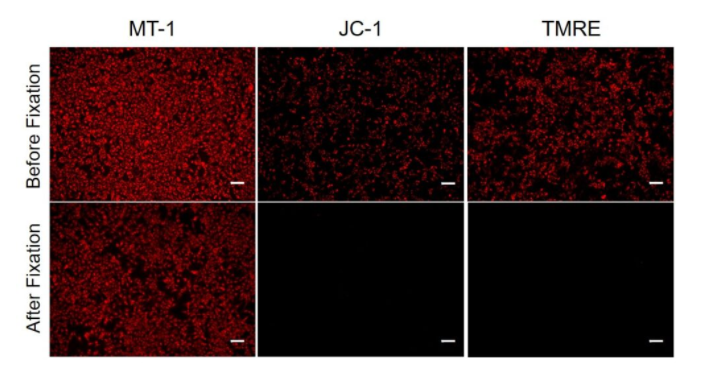
①固定后也可检测
由于微小的细胞状态的变化,也会造成线粒体膜电位发生变化,所以取得数据的重现性需要特别注意。通用的线粒体膜电位检测试剂(JC-1、TMRE)如果对细胞进行固定处理的话会失去荧光,所以需要使用活细胞进行迅速的测定。MT-1即使进行染色后进行PFA固定操作,也能保持荧光,因此可以进行高重复性的实验。
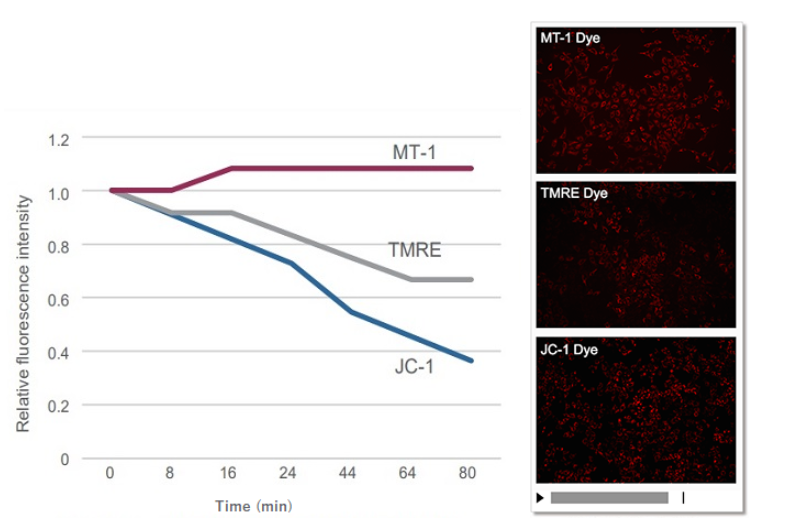
②可监控
没有进行药物刺激的细胞通过各种试剂染色,确认了荧光强度的变化。结果,JC-1和TMRE在染色后约10分钟左右荧光强度下降,MT-1仍保持了一定的荧光强度
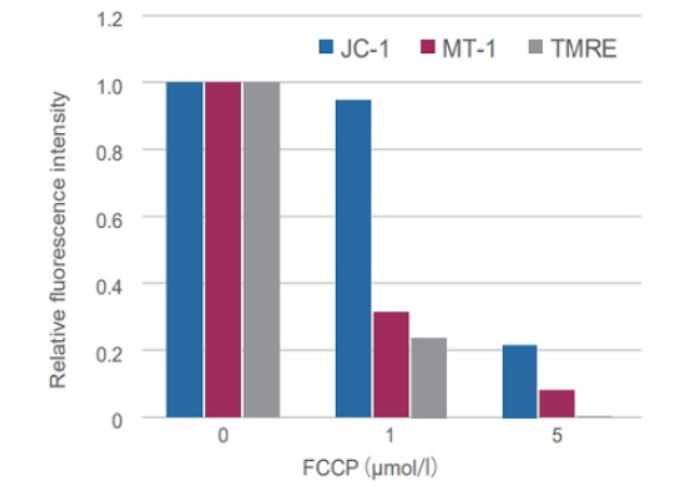
③高灵敏度
线粒体膜电位的细微变化在JC-1中有难以检测的情况,在这种情况下,使用四甲基罗丹明乙酯(TMRE)监测MMP。MT-1可提供与TMRE同等的检测灵敏度。
与各种试剂的比较
| Features | Sensitivity | Fixation | Monitoring | Fluorescence change (upon loss of mitochondrial membrane potential) | Detection (ex/em) |
|
| JC-1 (JC-1 MitoMP Detection Kit) |
Recomended for starting-up | ✓ | Color change from red to green | Green: 450-490 nm / 500-550 nm Red: 530-560 nm / 570-640 nm
|
||
| MT-1 (MT-1 MitoMP Detection Kit) |
Recommended for more detailed analysis | ✓ (High) |
✓ | ✓ | Decrease in fluorescence intensity | 530-560 nm / 570-640 nm |
| TMRE | Widely used | ✓ (High) |
Decrease in fluorescence intensity | 530-560 nm / 570-640 nm |
实验例
1.通过去极化的实验例
通过线粒体去极化剂的cyanide-p-trifluoromethoxyphenylhydrazone (FCCP)处理HeLa细胞,用该试剂观察膜电位的变化。
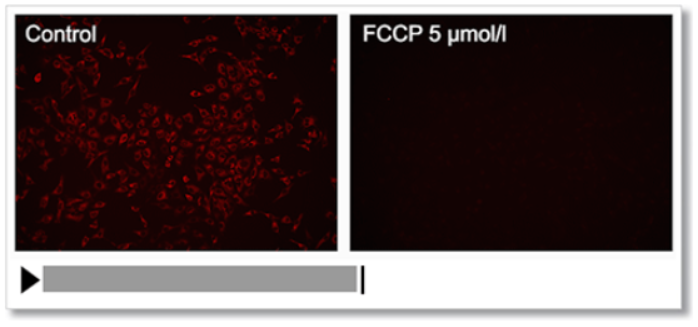
结果,确认了FCCP处理的细胞线粒体膜电位下降的情况。
2.凋亡诱导细胞线粒体膜电位的变化
预先在MT-1中染色的HL60细胞中添加Etoposide,诱导凋亡后,与Annexin V、FITC Conjugate一同染色,并通过流式细胞仪检测。
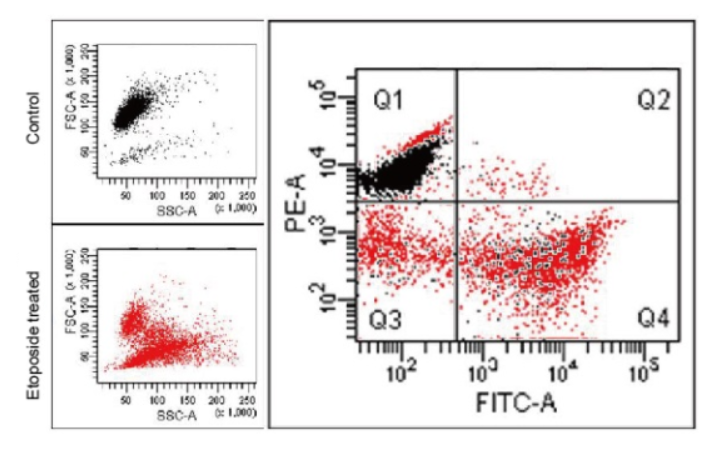
结果发现Annexin V-FITC产生的荧光强度变化(绿色荧光强度的增加)确认了凋亡的发生,以及从MT-1产生的荧光强度变化(红色荧光强度的降低)发现了线粒体膜电位的变化。
3.同时评估线粒体超氧化物和膜电位
用 HBSS 冲洗 HeLa 细胞后,用 MT-1 线粒体氧化酶检测试剂盒和线粒体超氧化物检测染料((mtSOX Deep Red: MT14)共同染色,同时观察线粒体 ROS 和膜电位的产生情况。因此,线粒体膜电位的降低和线粒体 ROS 的产生是同时观察到的。
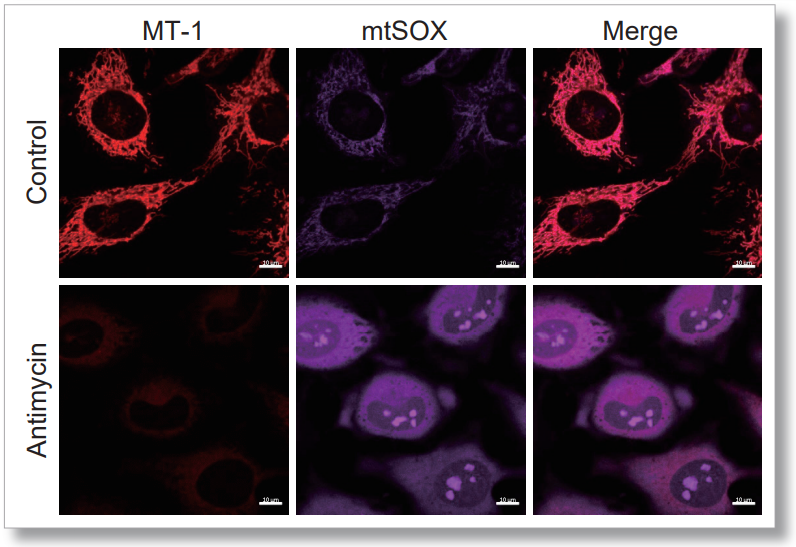
<成像条件>(共聚焦显微镜)
MT-1: Ex=561, Em=560-600 nm
mtSOX: Ex=633 nm, Em=640-700 nm
Scale bar: 10 μm
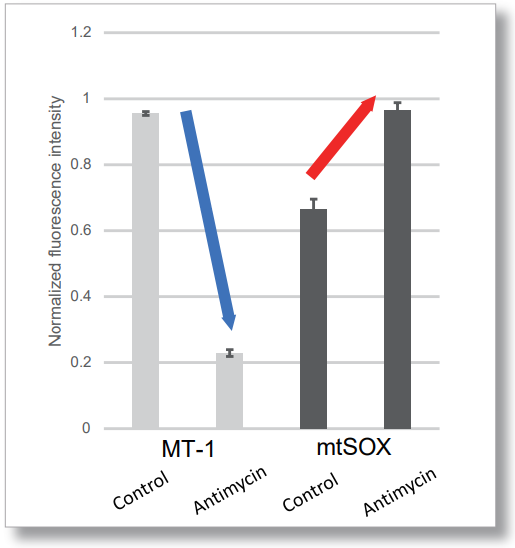
<检测条件>(酶标仪)Tecan,Infinite M200 Pro
MT-1: Ex=540-550 nm, Em=590-610 nm (Gain=200)
mtSOX: Ex=545-555 nm, Em = 665-685 nm
常见问题Q&A
| Q1:使用荧光显微镜检测时需要注意什么? |
| A1:请尽量减少激发光照射时间并提高检测灵敏度。
细胞长期暴露于激发光内可能导致细胞损伤和荧光染料降解,请优化检测时间。 |
| Q2:MT-1检测后可以固定吗? |
| A2:应使用4%多聚甲醛(PFA)固定,且不能与(Triton X-100、NP-40等)一起使用,因为这可能导致染泄漏。 |
| Q3:固定后可以对细胞染色吗? |
| A3:由于MT-1在线粒体中的积累取决于线粒体膜电位,因此固定后不适用于染色。 |
| Q4:是否需要做阳性对照? |
| A4:作为阳性对照,可在技术手册中找到使用FCCP(羰基氰化物-对三氟甲氧基苯腙)的实验例。 |
|
Q5:优化染色条件时,应使用何种浓度的MT-1染料 |
|
A5:MT-1染料的浓度建议稀释1000倍。但在优化染色条件时,请参考以下内容。 <荧光强度弱> 请优化以下浓度:稀释500-1000倍。 <观察到非特异性吸附> 请优化以下浓度:稀释1000至2000倍。 |
| Q6:我可以使用缓冲液来制备MT-1工作溶液吗? |
| A6:可以使用Hanks的HEPES和HBSS。也可以使用MEM、RPMI和含10%FBS的MEM制备。 |
| Q7:添加MT-1工作液后,可以不清洗直接上机检测吗? |
| A7:染色后,无需清洗即可观察样品。但我们不建议在不清洗的情况下长期观察它们,因为它们可能具有细胞毒性。
我们建议去除上清液并用培养基替换。 |
| Q8:MT-1染色后,是否可以用PBS代替HBSS来清洗? |
| A8:我们建议使用HBSS来减少细胞损伤。如果您没有HBSS,我们建议使用培养基来代替清洗。 |
参考文献
| No. | Sample | Instrument | Reference |
|---|---|---|---|
| 1 | STHdh Cells | Microscope | N. Okada, T. Yako, S. Nakamura, M. Shimazawa, H. Hara, “Reduced mitochondrial complex II activity enhances cell death via intracellular reactive oxygen species in STHdhQ111 striatal neurons Q1 with mutant huntingtin”, J. Pharmacol. Sci., 2021, doi:10.1016/j.jphs.2021.09.001. |
| 2 | Panc-1 Cells | Microscope | N. Okuni, Y. Honma, T. Urano, K. Tamura, “Romidepsin and tamoxifen cooperatively induce senescence of pancreatic cancer cells through downregulation of FOXM1 expression and induction of reactive oxygen species/lipid peroxidation”, Mol. Biol. Rep., 2022, doi:10.1007/s11033-022-07192-9. |
| 3 | BM Cells | Microscope | Y. Aoyagi, Y. Hayashi, Y. Harada, K. Choi, N. Matsumura, D. Sadato, Y. Maemoto, A. Ito, S. Yanagi, D. Starczynowski, H. Harada, “Mitochondrial Fragmentation Triggers Ineffective Hematopoiesis in Myelodysplastic Syndromes”, Cancer Discovery, 2022, doi:10.1158/2159-8290.CD-21-0032. |
| 4 | Flies indirect flight muscle Cells | Microscope | N. Nozawa, M. Noguchi, K. Shinno, M. Tajima, S. Aizawa, T. Saito, A. Asada, T. Ishii, M. Ishizuka, K. Iijima and K. Ando, “5-Aminolevulinic acid and sodium ferrous citrate ameliorate muscle aging and extend healthspan in Drosophila”, FEBS Open Bio, 2022, doi:10.1002/2211-5463.13338. |
| 5 | HBME Cells | Microscope | Y. Sakai, M. Taguchi, Y. Morikawa, H. Miyazono, K. Suenami, Y. Ochiai, E. Yanase, T. Takayama, A. Ikari, T. Matsunaga, “Apoptotic mechanism in human brain microvascular endothelial cells triggered by 40-iodo-α-pyrrolidinononanophenone: Contribution of decrease in antioxidant properties”, Toxicol. Lett., 2022, doi:10.1016/j.toxlet.2021.11.018. |
| 6 | MIN6-M9 Cells | Microscope | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, “Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER”, 2022, iScience, doi:10.1016/j.isci.2022.104603. |
| 7 | SH-SY5Y Cells | Flow Cytometer | M. Hashimoto, M. Fujimoto, K. Konno, M. L. Lee, Y. Yamada, K. Yamashita, C. Toda, M. Tomura, M. Watanabe, O. Inanami and H. Kitamura, “Ubiquitin-Specific Protease 2 in the Ventromedial Hypothalamus Modifies Blood Glucose Levels by Controlling Sympathetic Nervous Activation”, J. Neurosci., 2022, doi:10.1523/JNEUROSCI.2504-21.2022. |
| 8 | Fibroblasts, ciBAs | Microscope | Y. Takeda and P. Dai, “Chronic Fatty Acid Depletion Induces Uncoupling Protein 1 (UCP1) Expression to Coordinate Mitochondrial Inducible Proton Leak in a Human-Brown-Adipocyte Model”, 2022, doi:10.3390/cells11132038. |
| 9 | Sperm cells from C. osakensis queens | Microscope | A. Gotoh, M. Takeshima and K Mizutani, “Near-anoxia induces immobilization and sustains viability of sperm stored in ant queens”, Sci. Rep., 2023, doi:10.1038/s41598-023-29705-7. |
| 10 | Nucleus Pulposus Cells | Microscope | K. Suyama, D. Sakai, S. Hayashi, N. Qu, H. Terayama, D. Kiyoshima, K. Nagahori and M. Watanabe, “Bag-1 Protects Nucleus Pulposus Cells from Oxidative Stress by Interacting with HSP70”, Biomedicines, 2023, doi:10.3390/biomedicines11030863. |
| 11 | HL60 Cells, KG1a Cells | Flow Cytometer | K. Kamachi, H. Ureshino, T. Watanabe, N. Y. Sakai, Y. F. Kurahashi, K. Kawasoe, T. Hoshiko, Y. Yamamoto, Y. Kurahashi, and S. Kimura , “Combination of a New Oral Demethylating Agent, OR2100, and Venetoclax for Treatment of Acute Myeloid Leukemia”, Cancer Res Commun., 2023, doi:10.1158/2767-9764.CRC-22-0259. |
| 12 | RAW264 Cells | Microscope | H. Gu, Y. Zhu, J. Yang, R. Jiang, Y. Deng, A. Li, Y. Fang, Q. Wu, H. Tu, H. Chang, J. Wen and X. Jiang, “Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration”, Adv sci, 2023, doi:10.1002/advs.202302136. |
关联产品





线粒体
| 品名 | 货号 | 用途 |
|---|---|---|
| 线粒体膜电位检测试剂盒 | MT13 | 线粒体膜电位检测 |
| 线粒体膜电位检测试剂盒—JC-1 MitoMP Detection Kit | MT09 | 线粒体膜电位检测 |
| Cellstain- MitoRed试剂 | R237 | 线粒体ATP检测-红色 |
| Cellstain- Rh123试剂(罗丹明123) | R233 | 线粒体ATP检测-绿色 |
| 品名 | 货号 | 用途 |
|---|---|---|
| Mtphagy Dye试剂 | MT02 | 线粒体自噬 |
| 线粒体自噬—Mitophagy Detection Kit | MD01 | 线粒体自噬检测 |
| 品名 | 货号 | 用途 |
|---|---|---|
| mtSOX Deep Red – Mitochondrial Superoxide Detection | MT14 | 线粒体超氧化物检测 |
| 铁离子荧光探针—Mito-FerroGreen | M489 | 线粒体内二价铁离子检测 |
| Si-DMA for Mitochondrial Singlet Oxygen Imaging试剂 | MT05 | 线粒体内单线态氧检测 |
| MitoPeDPP试剂 | M466 | 线粒体内脂质过氧化物检测 |
| 品名 | 货号 | 用途 |
|---|---|---|
| MitoBright IM Red for Immunostaining试剂 | MT15 | 免疫荧光用线粒体荧光染料Red |
| MitoBright LT Green试剂 | MT10 | 线粒体长效荧光染色(绿色) |
| MitoBright LT Red试剂 | MT11 | 线粒体长效荧光染色(红色) |
| MitoBright LT Deep Red试剂 | MT12 | 线粒体长效荧光染色(深红色) |
线粒体功能研究

线粒体简要通路图海报下载
![]() 同仁化学 线粒体简要通路图.pdf
同仁化学 线粒体简要通路图.pdf
线粒体相关检测试剂
线粒体自噬检测
| 线粒体自噬 | ||
| 试剂 | Mtphagy Dye | Keima-Red |
| 原理 | 线粒体自噬染料是一种PH敏感的荧光探针,该染料聚集在线粒体中,并由溶酶体的酸性条件而发出荧光 | 这是一种基于PH感应比值的荧光蛋白。该蛋白在溶酶体中具有比较高的荧光比值(如550 nm/440 nm)。 |
| 固定细胞染色 | – | – |
| 活细胞染色 | Yes | Yes |
| 活细胞染色后固定 | – | – |
| 染色时间 | >30 min | – |
| Ex/Em | 530/700 | 440,550/620 |
| 产品货号 | MD01 , MT02 | – |
线粒体膜电位检测
| Membrane potential
线粒体膜电位 |
||
| 试剂 | JC-1 | TMRM, TMRE |
| 原理 | JC-1是一种被广泛使用的小分子线粒体膜电位探针,依赖于线粒体膜电位在线粒体中聚集,染料伴随聚集过程,荧光从绿色 (530 nm) 变为红色 (590 nm)。当线粒体发生去极化,红/绿荧光强度比值降低。 | 该试剂是细胞渗透性荧光染料,由于膜电位在完整的线粒体中积累。探针扩散发生在膜电位降低的受损线粒体中。 |
| 固定细胞染色 | – | – |
| 活细胞染色 | Yes | Yes |
| 活细胞染色后固定 | – | – |
| 染色时间 | 10- 60 min | 30- 60 min |
| Ex/Em | Monomer:514/529 | 550/575 |
| J-aggregation: 585/590 | ||
| 产品货号 | MT09 | – |
线粒体金属离子检测
| Iron ion (Fe2+)
亚铁离子 |
Calcium ion (Ca2+)
钙离子 |
|
| 试剂 | Mito-FerroGreen | Rhod 2-AM |
| 原理 | 该试剂是一种细胞通透性探针,其积累在线粒体中,并与线粒体中的亚铁离子发生特异性反应,发出绿色荧光。 | 该试剂是一种细胞通透性探针,该探针积聚在线粒体中,并与线粒体中的钙离子发生特异性反应,发出红色荧光。 |
| 固定细胞染色 | – | – |
| 活细胞染色 | Yes | Yes |
| 活细胞染色后固定 | – | – |
| 染色时间 | 30 min | 30-60 min |
| Ex/Em | 505/535 | 553/576 |
| 产品货号 | M489 | R002 |
线粒体荧光染色
| Mitochondria staining
线粒体染色 |
||
| 试剂 | MitoBright LT series | MitoTracker series |
| 原理 | 细胞渗透性荧光染料,基于线粒体膜电位而在完整的线粒体中积累。 | 细胞渗透性荧光染料,基于线粒体膜电位而在完整的线粒体中积累。 |
| 固定细胞染色 | – | – |
| 活细胞染色 | Yes | Yes |
| 活细胞染色后固定 | – | – |
| 染色时间 | >10 min | 15 -45 min |
| Ex/Em | 493/508,547/563, 643/663 | 490/516~644/665 |
| 产品货号 | MT10、MT11、MT12 | – |
| Mitochondria staining
线粒体染色 |
|||
| 试剂 | DsRed | MitoRed | Rh123 |
| 原理 | 一种红色荧光蛋白染料,通过转染试剂与完整的线粒体结合。 | 细胞渗透性荧光染料,基于线粒体膜电位而在完整的线粒体中积累。 | 细胞渗透性荧光染料,基于线粒体膜电位而在完整的线粒体中积累。 |
| 固定细胞染色 | – | – | – |
| 活细胞染色 | Yes | Yes | Yes |
| 活细胞染色后固定 | – | – | – |
| 染色时间 | Expression in 8 -12 hrs. | >15 min | >15 min |
| Ex/Em | 558/583 | 560/580 | 507/529 |
| 产品货号 | – | R237 | R233 |
线粒体氧化应激
| Lipophilic peroxide
脂质过氧化物 |
Singlet oxygen
单线态氧 |
Superoxide
超氧化物 |
|
| 试剂 | MitoPeDPP | Si-DMA | MitoSOX |
| 原理 | MitoPeDPP是一种新型荧光染料,由于其具有三苯基膦结构,因此可以穿过细胞膜并在线粒体中聚集。聚集在线粒体内膜上的MitoPeDPP可以被脂质过氧化物氧化而释放出强荧光。 | 该试剂是一种细胞渗透性荧光探针,积聚在线粒体中,与线粒体中产生的单线态氧发生反应,发出红色荧光。 | 该试剂是一种细胞渗透荧光探针,积聚在线粒体中,与线粒体中产生的超氧化物反应,发出红色荧光。 |
| 固定细胞染色 | – | – | – |
| 活细胞染色 | Yes | Yes | Yes |
| 活细胞染色后固定 | – | – | – |
| 染色时间 | > 15 min | > 45 min | > 10 min |
| Ex/Em | 452/ 470 | 644/ 670 | 510/ 590 |
| 产品货号 | M466 | MT05 | – |
引用论文
① H. Tanaka, S. Takebayashi, A. Sakamoto, N. Saitoh, S. Hino and M. Nakao, “The SETD8/PR-Set7 Methyltransferase Functions as a Barrier to Prevent Senescence-Associated Metabolic Remodeling.”, Cell Reports, 2017, 18(9), 2148.
② L. Garcia-Prat, M. Martinez-Vicente and P. Munoz-Canoves, “Autophagy: a decisive process for stemness”, Oncotarget, 2016, 7(11), 12286.
③ M. Bitar, S. Abdel-Halim and F. Al-Mulla, “Caveolin-1/PTRF upregulation constitutes a mechanism for mediating p53-induced cellular senescence: implications for evidence-based therapy of delayed wound healing in diabetes”, Am J Physiol Endocrinol Metab., 2013, 305(8), E951.
④ C. Wiley, M. Velarde, P. Lecot, A. Gerencser, E. Verdin, J. Campisi, et. al., “Mitochondrial Dysfunction Induces Senescence with a Distinct Secretory Phenotype”, Cell Metab., 2016, 23(2), 303.
⑤ E. Liao, Y. Hsu, Q. Chuah, Y. Lee, J. Hu, T. Huang, P-M Yang & S-J Chiu, “Radiation induces senescence and a bystander effect through metabolic alterations.”, Cell Death Dis., 2014, 5, e1255.
⑥ K. Nishimura, T. Kumazawa, T. Kuroda, A. Murayama, J. Yanagisawa and K. Kimura, “Perturbation of Ribosome Biogenesis Drives Cells into Senescence through 5S RNP-Mediated p53 Activation”, Cell Rep. 2015, 10(8), 1310.
⑦ M. J. Son, Y. Kwon, T. Son and Y. S. Cho, “Restoration of Mitochondrial NAD+ Levels Delays Stem Cell Senescence and Facilitates Reprogramming of Aged Somatic Cells”, Stem Cells. 2016, 34(12), 2840.