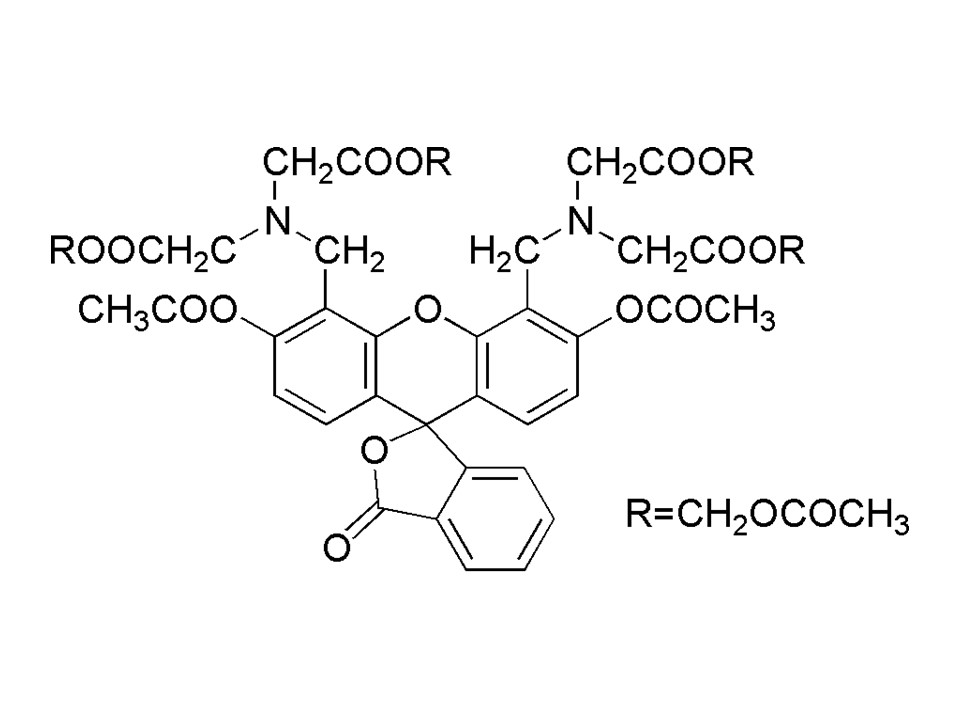
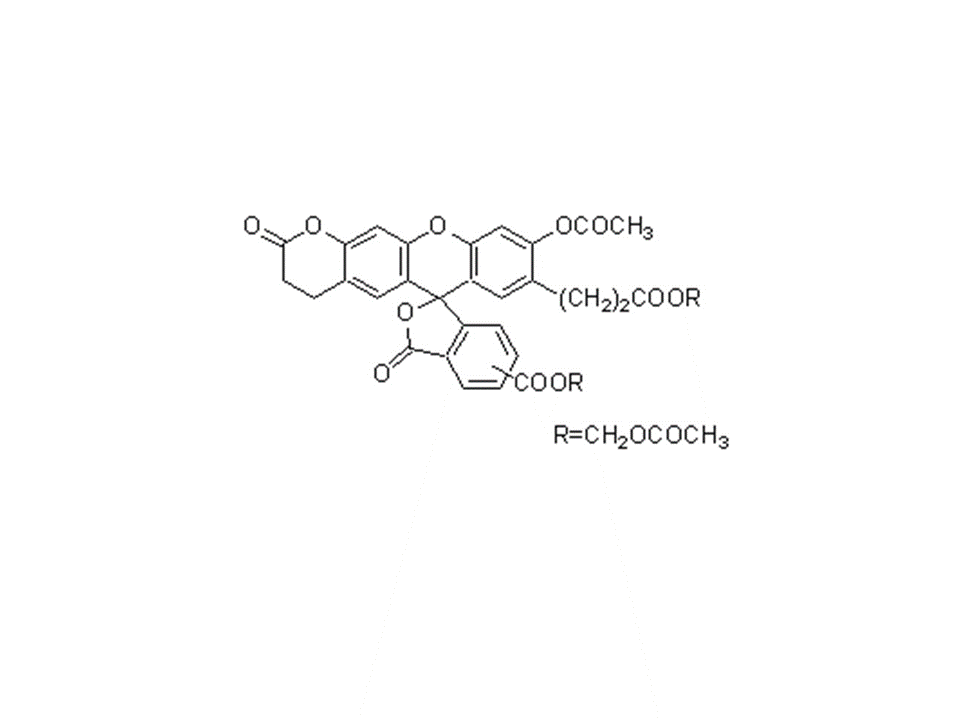
产品特性
细胞膜起着分隔细胞内和细胞外的作用,并且与细胞的移动和生长、神经信号的传达等细胞功能密切相关。因此,细胞膜的异常与各种细胞状态异常所造成的疾病(如离子通道病Channelopathy)有很密切的关联,被认为是非常重要的生物标记物之一。
由于操作简便并且可用于活细胞染色,小分子荧光探针是最常用的细胞膜染色方法。但是小分子荧光探针普遍存在细胞内停留时间短、水溶性差的问题。而PlasMem Bright是一种克服了现有小分子荧光探针问题的产品。 用PlasMem Bright观察细胞膜时,可以在染色后的1天以上进行长时间的荧光观察。

与其他公司产品的比较
PlasMem Bright系列产品克服了现有市面上的细胞膜染色试剂的诸多缺点(细胞毒性高、停留时间短、不同实验系的兼容性差)。并且分别有Green/ Red两种产品,方便多重染色时自由选择。
| 产品名 | 细胞
毒性 |
染色后
的清洗 |
含血清
培养基 |
停留
时间 |
染色后
的固定 |
| PlasMem Bright | 低 | 不需要 | 可使用 | 24 h | 可以(PFA) |
| S公司 产品P | – | 需要 | 不可使用 | – | 可以 |
| T公司 产品D | – | 需要 | 可使用 | – | 不可以 |
| T公司 产品C | – | 需要 | 可使用 | 1.5 h | 可以(PFA) |
*通过细胞核染色试剂染色后,神经细胞的形态变化(凝集)的比较得出的结论
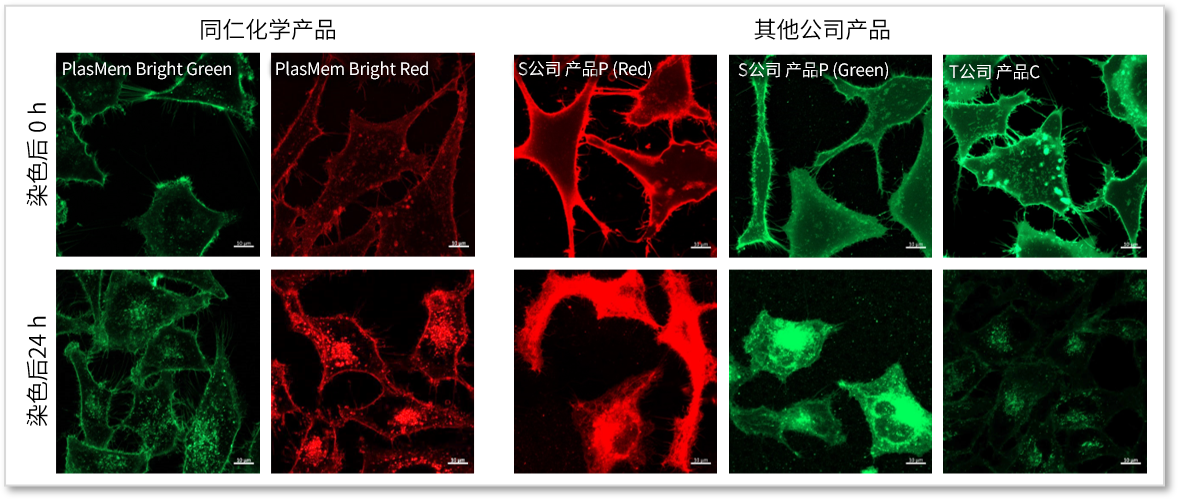
细胞膜上的停留时间
使用各种细胞膜染色试剂进行染色HeLa细胞,经过24 h培养后对各染色试剂的荧光图像进行比较。结果发现,与其他公司的细胞膜染色试剂相比,PlasMem Bright系列产品的染色时间更长,膜上的停留时间也更长。
实验例
实验例:ES细胞群内部的细胞膜染色
将小鼠ES细胞在涂有明胶的玻璃底皿中培养4天,并将获得的细胞群,用PlasMem Bright Green(200倍稀释)染色15分钟,并使用共聚焦显微镜(Zeiss:LSM710)中观察。
结果,细胞群内部的细胞膜也可以用PlasMem Bright Green可视化观察。
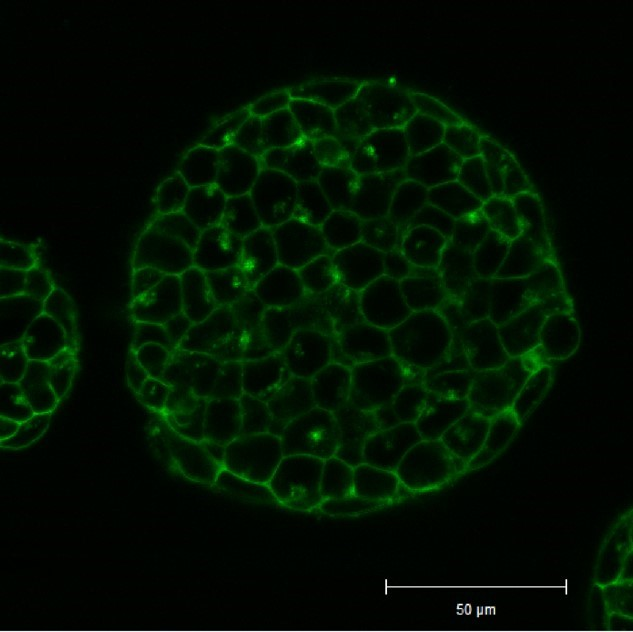
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm.
*此实验例由庆应义塾大学医学院的石津 大嗣老师提供。
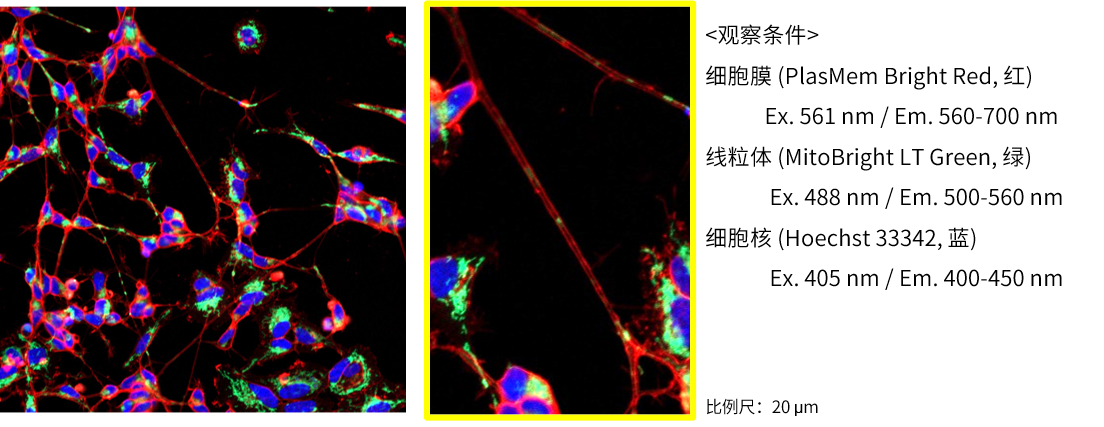
实验例:轴突神经细胞形态和线粒体定位的观察
由神经母细胞瘤细胞SH-SY5Y分化诱导的神经细胞,分别用PlasMem Bright Green (绿)、MitoBright LT Red (红)、Hoechst 33342 (蓝) 进行染色。可以鲜明的观察到细胞的形状以及轴突内的线粒体。

(比例尺:200 μm)
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm。
线粒体(MitoBright LT Red【红】):Ex.561 nm/Em.560-620 nm。
细胞核(Hoechst33342【蓝】):Ex.405 nm/Em.400-450 nm。
<实验步骤>
(1)诱导神经芽细胞(SH-SY5Y)为神经细胞。
(2)去除上清液,添加使用培养基中稀释200倍的PlasMem Bright Green、Hoechst 33342(终浓度:5μg/ml)以及MitoBright LT Red(终浓度0.1 μmol/l)。
(3)培养30分钟。
(4)去除上清液,添加HBSS。
(5)使用荧光显微镜观察。
实验例:神经芽细胞(SH-SY5Y)中的线粒体检测
分别用PlasMem Bright Green (绿)、MitoBright LT Red (红)、Hoechst 33342 (蓝) 对神经母细胞瘤细胞SH-SY5Y进行染色,用共聚焦显微镜获得3D图像。可以鲜明的观察到细胞形态以及线粒体和细胞核的情况。
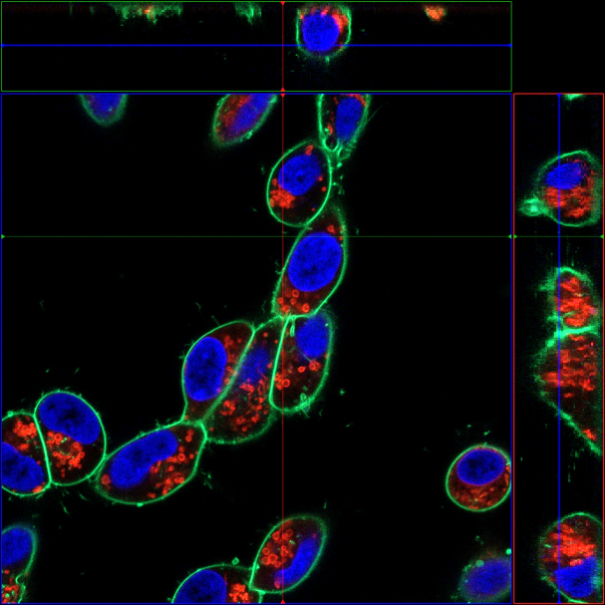
(比例尺:10 μm)
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm。
线粒体(MitoBright LT Red【红】):Ex.561 nm/Em.560-620 nm。
细胞核(Hoechst33342【蓝】):Ex.405 nm/Em.400-450 nm。
<实验步骤>
(1)使用HBSS清洗SH-SY5Y细胞。
(2)添加使用培养基中稀释200倍的PlasMem Bright Green、Hoechst 33342(终浓度:5μg/ml)以及MitoBright LT Red(终浓度0.1 μmol/l)。
(3)培养10分钟。
(4)使用HBSS清洗细胞2次
(5)使用荧光显微镜观察。
实验例:脑源性小鼠神经母细胞瘤的延时成像
使用培养基中稀释200倍的PlasMem Bright Green,染色N1E-115细胞30分钟并进行延时成像时,可以清楚地观察到神经细胞内树突和突起中的变化。
<培养条件>
・细胞:N1E-115细胞(脑源性小鼠神经母细胞瘤)
・培养基:5%FBS,1%含谷氨酰胺的D-MEM(低葡萄糖)
・培养设备:35 mm 玻璃底皿
<拍摄条件>
・成像设备:带培养箱的荧光显微镜
・拍摄时间:1小时,拍摄间隔:2分钟
*此实验例由芝浦理工大学系统科学与工程学院的涌澤 充 様、福井 浩二教授提供。
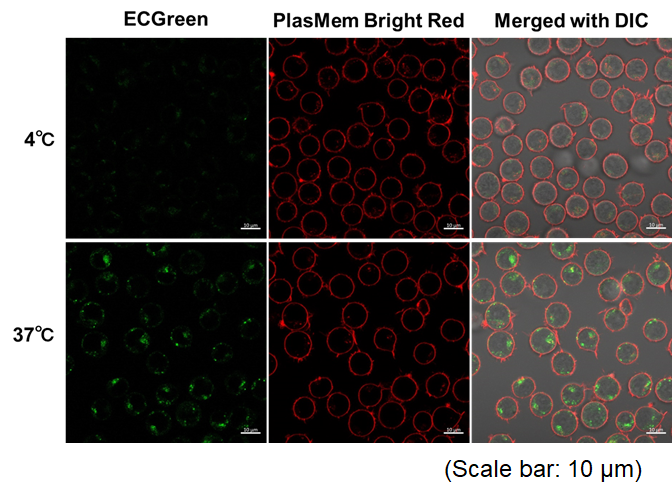
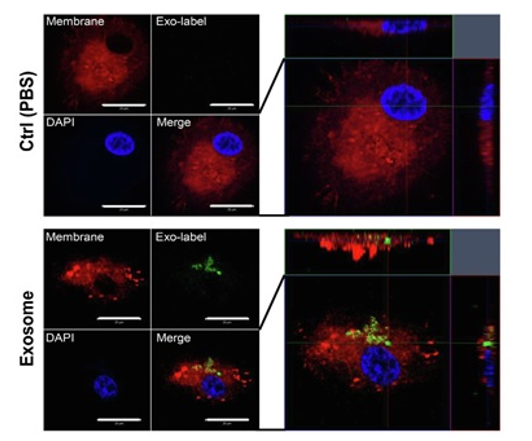
实验例:与外泌体共染色
向PlasMem Bright Green染色的HeLa细胞中加入外泌体膜荧光染色试剂盒(ExoSparkler Exosome Membrane Labeling Kit-Red)染色的外泌体。可以观察到,由活细胞的细胞膜产生的内体(Endosome)中的外泌体,以及没有摄入外泌体的内体。另外,即使在固定染色的细胞之后,也可以像活细胞一样使存在于细胞膜来源的囊泡(内体)中的外泌体可视化。


(比例尺:5 μm)

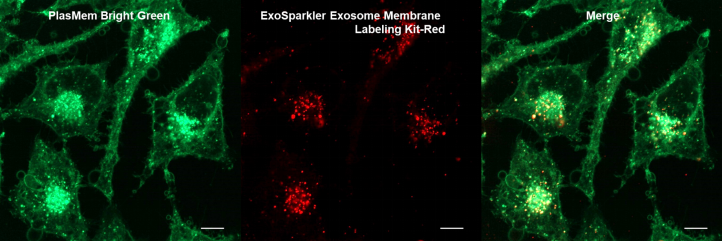
(比例尺:10 μm)
<观察条件>
细胞膜 (PlasMem Bright Green, 绿) Ex. 488 nm / Em. 500-560 nm。
外泌体 (ExoSparkler Exosome Membrane Labeling Kit-Red, 红) Ex. 561 nm / Em. 560-620 nm。
<实验步骤>
(1)接种Hela细胞,24小时培养。
(2)去除上清液,添加使用培养基稀释的PlasMem Bright Green(100倍稀释)。
(3)培养10分钟。
(4)使用HBSS清洗细胞3次。
(5)添加175 μlMEM培养基与ExoSparkler Exosome Membrane Labeling Kit-Red染色过的Exosome溶液25 μl。
(6)在CO2培养箱中过夜培养。
(固定情况下)细胞使用HBSS清洗2次后添加4%PFA,培养15分钟后,使用HBSS清洗细胞2次。
(7)使用共聚焦显微镜观察
实验例:烟草BY2细胞的膜染色
用PlasMemBright Green (200倍稀释)染色烟草BY2细胞5分钟,清洗后每5分钟拍摄一次并进行长时间观察。实验中可以清晰的观察到BY2细胞膜的荧光以及细胞分裂所形成的细胞板。
(数据由名古屋大学栗原大辅老师友情提供)
<检测条件>
・转盘式共聚焦显微镜观察
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
・图中的时间按照00:00 (小时:分钟)表示
实验例:拟南芥根的染色
用PlasMemBright Green (200倍稀释)染色拟南芥根15分钟,采用Z轴景深连续拍照的方法进行荧光观察,可以清晰的观察到立体的细胞膜分布情况。
(数据由名古屋大学栗原大辅老师友情提供)
<检测条件>
・转盘式共聚焦显微镜观察,Z轴摄影
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
关联产品
常见问题Q&A
| Q1: 是否可以用固定化细胞? |
| A: 可以用4% 多聚甲醛(PFA)进行固定。
但是请注意不可以改变细胞膜的渗透性,否则会操造成没有荧光。 |
| Q2: 是否可以进行动态荧光成像? |
| A:可以。 但是请注意将激发光保持在最低水平并提高检测灵敏度。另外,长时间的激发光照射可能会对细胞造成伤害,也更容易使荧光染料分解,请考虑采用时间间隔等方法尽量避免。 |
| Q3: 在配制Working solution的时候是否可以用无血清培养基或Buffer进行稀释? |
| A: 可以。 |
| Q1: 染色后清洗细胞时建议使用什么? |
| A: 无血清培养基、PBS、HBSS等各种缓冲液均可以使用。 |
| Q4: 添加Working solution后,是否可以马上观察? |
| A:添加后马上观察也可以。操作手册上的步骤是加入试剂后培养5 min再观察。 |
| Q5: 细胞膜以外的地方也有被染色的情况,请问是什么原因? |
| A: 感觉观察到细胞膜以外也被染色的情况,可能有如下两个原因
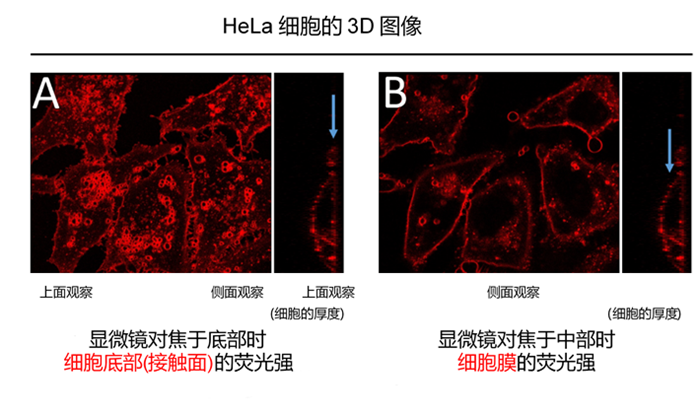
1) 细胞膜上的试剂,随着时间的推移,通过细胞内吞作用进入细胞内。 请参考本产品网页上“细胞膜上的停留时间”的部分,有染色后24 h的照片。 2)荧光成像时的焦点在底面(细胞底部的接触面)上,如下图A。 荧光成像时的焦点请尽量像下图B那样调整Z轴的高度。
|
产品文献
| 编号 | 文献 | 年 | IF |
| 1 | The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells,
Nature Cell Biology,2023 ,25(8):1173-1184. |
2023 | 21 |