C29H19NO11
557.46
关联产品

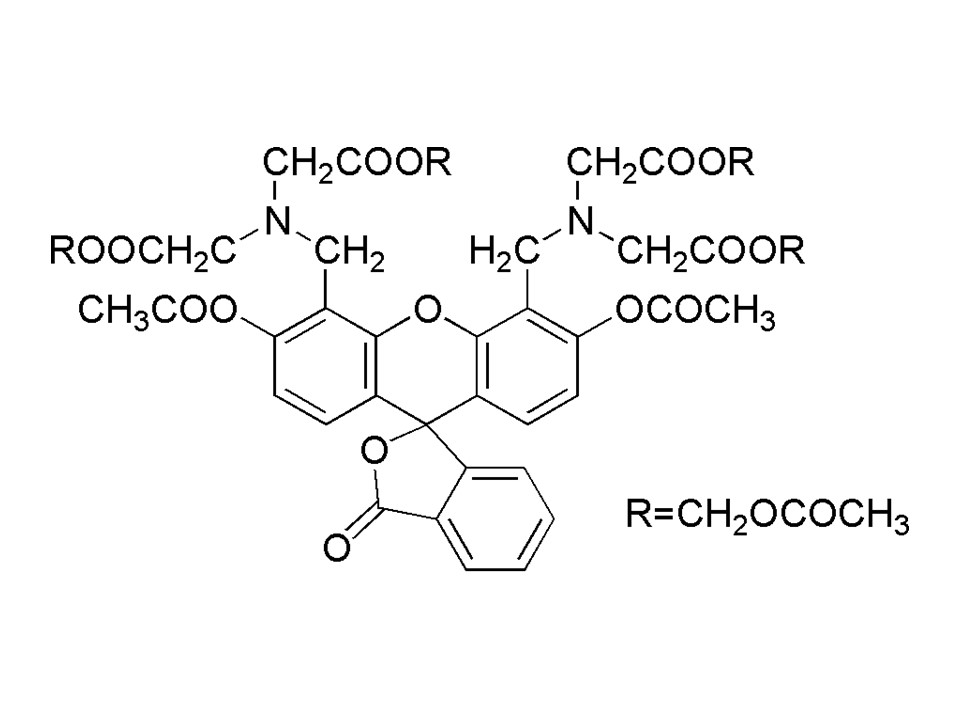


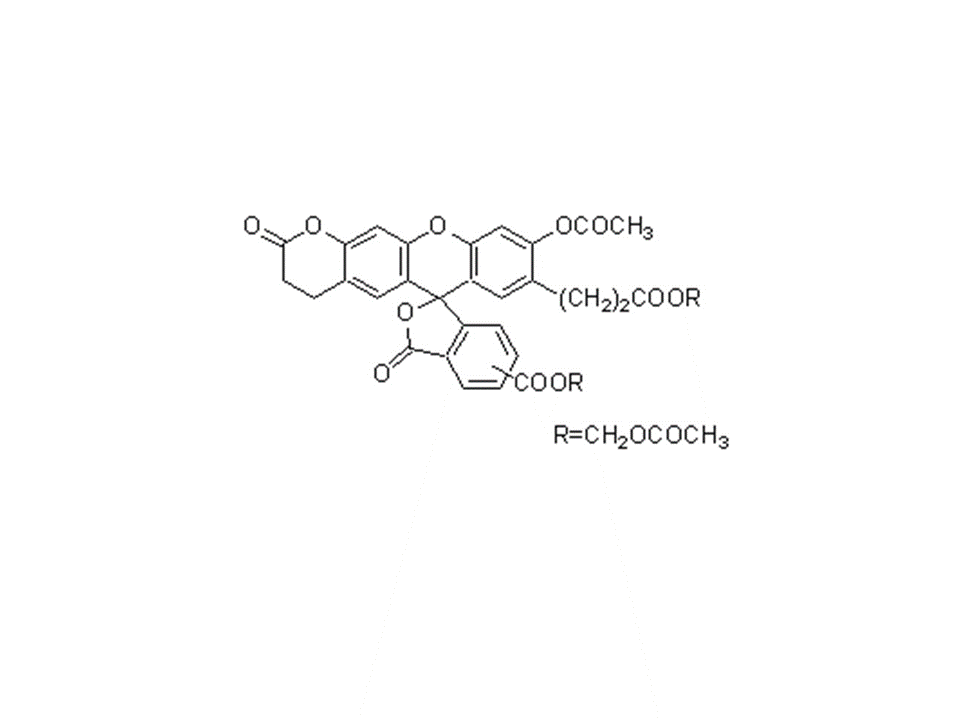

C29H19NO11
557.46
关联产品





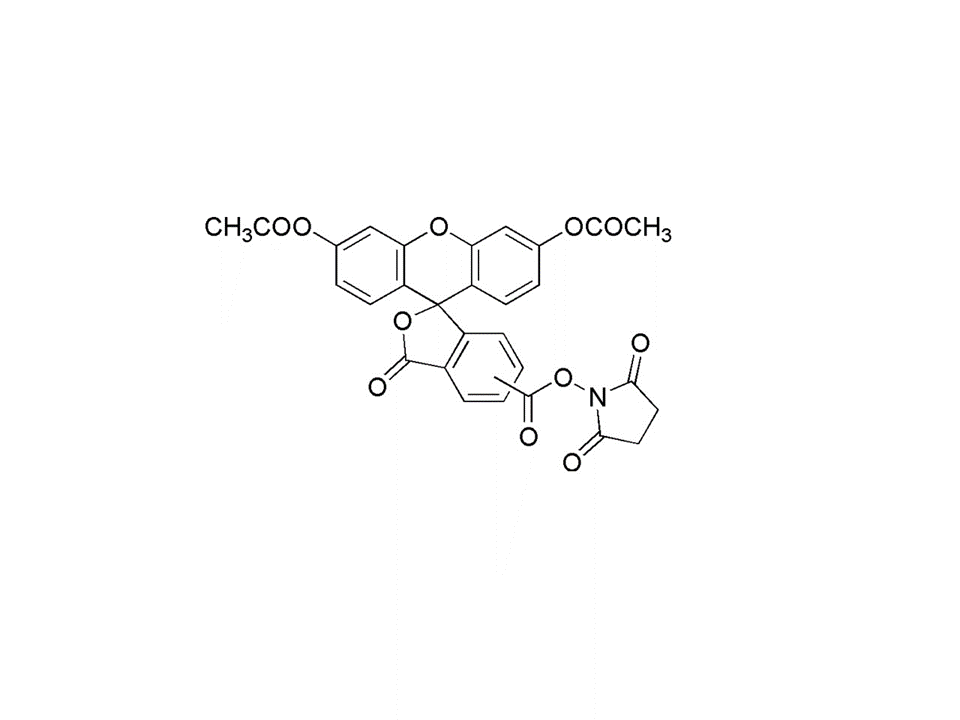
C29H19NO11
557.46
特点:
● 可用于细胞增殖检测
● 长效荧光染色,最长三周可见
● 可用于流式细胞仪检测

活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.2. Annexin V, 633 Apoptosis Detection Kit 细胞凋亡检测
NO.3. Calcein-AM 细胞质染色
NO.4. Cell Viability Assay Kit 细胞增殖/毒性检测
NO.5. FerroOrange 细胞亚铁离子检测
规格性状
规格
特性:该产物为无色至微黄色固体,可溶于二甲基亚砜和乙腈。
可溶于二甲基亚砜:试验成功
NMR光谱:试验成功
产品概述
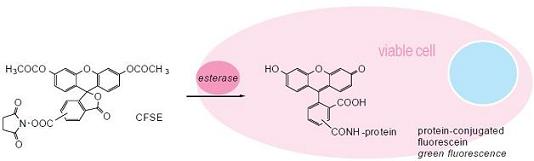
荧光染料 CFSE(CFDA-SE),是一种可对活细胞进行荧光标记的新型染料,可以标记活体细胞。其基本原理如下:CFSE 是一种带有琥珀酰亚胺(NHS)的荧光染料,可以结合细胞内的蛋白质。CFSE 在结构上将酚羟基部位改造成 AM 体,所以自身不发荧光,荧光背景低,脂溶性高,能够轻易穿透细胞膜,在活细胞内与胞内蛋白共价结合,进入细胞内的 CFSE 的 AM 部位能被细胞内酯酶水解发出绿色荧光。CFSE 的琥珀酰亚胺(NHS)和细胞内蛋白质的氨基部位结合,固定在细胞内,不会漏出细胞外。CFSE 进入细胞后定位于细胞膜、细胞质和细胞核,在细胞核的荧光最强。
在细胞分裂增殖过程中,CFSE 的荧光强度会随着细胞的分裂而逐级递减,标记荧光可平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半,根据这一特性,它可被用于检测细胞增殖,细胞周期的估算及细胞分裂等方面。另外,CFSE 标记的细胞用于体内观察可以长达数周之久,它常被用来做活体细胞检测实验和用荧光电镜观察细胞长期活动的实验。有报道证实 CFSE 毒性小,不影响细胞的增殖能力。此方法操作简单,且不用放射性同位素,不存在安全隐患。可以更快速,更准确和更安全地得到想要的实验数据。


原理
荧光特性
荧光波长:λex=496 nm, λem=516 nm
操作说明
*建议您在正式实验前先摸索一下细胞量、CFSE的终浓度、培养时间等,找到最佳实验条件。
配制试剂:
1、从冰箱中取出CFSE试剂,放至室温后再打开。盛放CFSE的管子开盖前请轻弹管壁几次,让粉末充分落入管底,必要时可采用离心的方法。
2、取0.9 ml DMSOa)加到CFSE管中溶解,配制成2 mM的CFSE母液b)(加入DMSO后请先盖上盖子,反复颠倒把盖子和管壁上的试剂洗到底部,并用移液器反复吹打使溶解完全)。
3、用PBS(-)或适当的缓冲液将其稀释成100 μM或其它浓度(如果采用载玻片观察法,建议浓度为20 μM的工作液c))。
a) DMSO需要保证新鲜无水,否则将会导致AM体水解,使荧光染料无法进入细胞,影响实验效果。
b) 由于CFSE母液遇水极易分解,所以建议分装保存,例如分装成5 μl/管。
方法:分装后用封口膜密封管口,再用锡箔纸包裹,最后和干燥剂一起用塑料袋密封,≦-20℃冷冻保存。
c) CFSE工作液应现配现用,因为CFSE吸水会分解,影响染色效果。
* PBS(-):不含钙和镁离子的PBS。
细胞染色(仅供参考):
例1 培养板观察法
1、准备细胞悬液,用PBS(-)等合适的培养基a)调整细胞浓度至约107个/ml。
2、取1ml细胞悬液至试管中,加入适量CFSE工作液,轻轻搅拌混匀(建议CFSE的终浓度参考相关论文或做个预实验:分别设定终浓度为0.5,1,2,5,10,20 μM…,以确定最佳染色浓度b))。
3、在37℃培养箱中培养15-30分钟。
4、离心后去上清,加入2 ml PBS溶液,再离心后去上清,重复此操作一次。
5、加入合适的培养基制成细胞悬液。
6、取500 μl的细胞悬液加在培养孔中,用荧光显微镜观察,看到荧光后,根据自己实验的要求调整细胞数量c)进行实验。
例2 载玻片观察法
1、准备1 ml细胞悬液,用PBS(-)等合适的培养基a)调整细胞浓度至约107个/ml。
2、取30 μl细胞悬液至试管中,加入10 μl浓度为20 μM的CFSE工作液(终浓度为5μM),轻轻搅拌混匀b)。
3、在37 ℃培养箱中培养15-30分钟。
4、滴10 μl的细胞悬液在载玻片上,用荧光显微镜观察,看到荧光后,根据自己实验的要求调整细胞数量C)进行实验。
*如果背景高的话,第3步之后需要洗去多余的CFSE:
离心后去上清,加入90 μl PBS溶液,再离心后去上清,重复此操作一次。
a)尽可能用不含血清的培养基,血清中的酶和蛋白质会分解CFSE,可能会影响染色效果。
b)如果荧光强度弱,可以适当提高CFSE的终浓度。如果细胞毒性大或背景太高,可以适当降低CFSE的终浓度,请摸索条件找到最佳浓度。
c)根据不同的实验目的和要求,采用稀释的方法调整细胞数量。
文献
1) M. Bronner-Fraser, “Alterations in Neural Crest Migration by a Monoclonal Antibody That Affects Cell Adhesion”, J. Cell Biol., 1985, 101, 610.
2) A. Nose and M. Takeichi, “A Novel Cadherin Cell Adhesion Molecule:Its Expression Patterns Associated WithImplantation and Organogenesis of Mouse Embryos”, J. Cell Biol., 1986, 103, 2649.
3) S. A. Weston and C. R. Parish, “New Fluorescent Dyes for Lymphocyte Migration Studies Analysis by Flow Cytometry and Fluorescent Microscopy”, J. Immunol. Methods, 1990, 133, 87.
4) C. K. Raymond, P. J. O’hara, G. Eichinger, J. H. Rothman and T. H. Stevens, “Molecular Analysis of the Yeast VPS3 Gene and the Role of Its Product in Vacuolar Protein Sorting and Vacuolar Segregation during the Cell Cycle”, J. Cell Biol., 1990, 111, 877.
5) G. Radcliff, R. Waite, J. Lefevre, M. D. Poulik and D. M. Callewaert, “Quantification of Effector/Target Conjugation Involving Natural Killer(NK) or Lymphokine Activated Killer(LAK) Cells by Two-color Flow Cytometry”, J. Immunol. Methods, 1991, 139, 281.
6) S. A. Weston and C. R. Parish, “Calcein: a Novel Marker for Lymphocytes Which Enter Lymph Nodes”, Cytometry, 1992, 13, 739.
7) L. S. D. Clerck, C. H. Bridts, A. M. Mertens, M. M. Moens and W. J. Stevens, “Use of Fluorescent Dyes in the Determination of Adherence of Human Leucocytes to Endothelial Cells and the Effects of Fluorochromes on Cellular Function”, J. Immunol. Methods, 1994, 172, 115.
常见问题Q&A
|
Q1 请告诉我如何使用CFSE。
|
|
A1:参考文献[1]中的描述如下所示。 杀死7-10周大的CBA / H小鼠,去除脾脏(或其他目标器官),然后浸入F15培养基(1%FCS)中。 然后,通过金属网获得细胞悬液,并通过离心除去红细胞,死细胞等。 将纯化的淋巴细胞悬浮在pH 7.0的PBS中至50,000,000细胞/ mL。 加入5.0μM浓度的CFSE,并在37°C下标记15分钟。悬浮在冰冷却的F15培养基(1%FCS)中并离心 用(350g,5分钟,20℃)洗涤两次。悬浮在F15培养基中。 静脉注射到CBA / H小鼠中。一定时间后,杀死鼠标并去除脾脏(或其他目标器官)。 切除淋巴细胞并分离并通过流式细胞仪分析。 参考文献[2]是关于钙黄绿素-AM的,但也通过与[1]相同的步骤将其与CFSE进行了比较。 【参考文献】 1. Susan A. Weston, Christopher R. Parish, J. Immunol. Methods, 133, 87 (1990). 2. Susan A. Weston, Christopher R. Parish, Cytometry, 13, 739 (1992). |
|
Q2:细胞染料的激发波长和发射波长是多少。 |
| A2: |
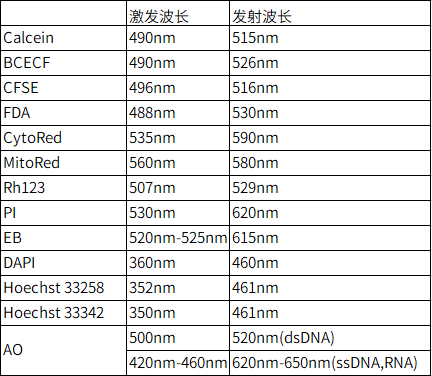
|
Q3:细胞染色试剂Cellstain的哪些活细胞染色染料可以在细胞中长时间停留? |
|
A3: “就细胞内保留而言,“ CFSE”可以在细胞中停留最长时间。尽管荧光强度降低,但是已经证实细胞中存在荧光染料达8周。用“ Calcein-AM”和“ BCECF-AM”观察到荧光达3天。也有报道称“钙蛋白-AM”在6小时内在细胞中保留了90%” ・S.A.Weston, et.al., J.Immunol.Methods, 133, 87-97(1990) ・H.P.Zhong, et.al., Hum.Immunol., 37, 264-270(1993)” 但是,“钙调蛋白-AM”和“ BCECF-AM”对细胞毒活性没有影响。 ・L.S.D.Clerck, et.al., J.Immunol.Methods, 172, 115-124(1994) 还要注意的一点是,原始的基本骨架是荧光素,因此由于激发光而褪色由于容易发生,因此可能难以通过长期激发来观察荧光。 (尽管最好使用防褪色剂等) |
关联产品





C46H46N2O23
994.86
特点:
● 活细胞和死细胞可同时染色
● 490 nm激发波长,515 nm发射波长


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. Cellstain- PI 细胞核染色
NO.5. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
规格性状
规格
特性:该产物为无色至微黄色固体,可溶于二甲基亚砜和乙腈。
可溶于二甲基亚砜:试验成功
NMR光谱:试验成功
产品概述
Calcein-AM是一种可对活细胞进行荧光标记的细胞染色试剂,由于它在Calcein的基础上加强了疏水性,因此能够轻易穿透活细胞膜。当其进入到细胞质后,酯酶会将其水解为Calcein留在细胞内,发出强绿色荧光。与其它同类试剂 (如BCECF-AM和Carboxy-fluorescein diacetate) 相比,Calcein-AM是最适合作为荧光探针去染活细胞的,因为它的细胞毒性很低。Calcein不会抑制任何的细胞功能如增殖或淋巴球的趋化性。使用了Calcein的活性检测的实验结果是十分可信并且与标准的51Cr-释放法所得结果相一致的。Calcein的激发和发射波长分别为490nm和515nm。
Calcein-AM可与PI结合使用,分别对活细胞和死细胞染色,可用于同时对活细胞和死细胞进行荧光染色。
*Caution*
Please tap the tube before opening, and open it with care. The content may have relocated from the bottom of the tube during the shipping.
*警告*
打开前请先轻敲试管,并小心打开。 在运输过程中,内装物可能已从试管底部移开。

原理
Fig. 1 Cell staining mechanism
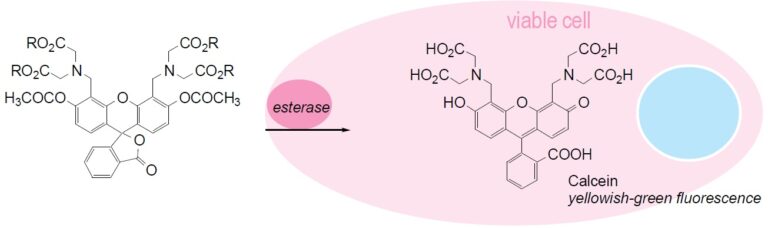
产品特性
钙黄绿素-AM通过钙黄绿素的四个羧基的乙酰氧基甲基酯化(AM转化)而使其可透过细胞膜。钙黄绿素-AM本身几乎不显示荧光,但通过细胞内酯酶水解变成钙黄绿素。该钙黄绿素是不透膜的化合物,表现出强的黄绿色荧光(λex= 490 nm,λem= 515 nm)。羧基荧光素二乙酸盐(CFDA)和荧光素二乙酸盐(FDA)与荧光素-AM具有相同的荧光素骨架,被称为染色活细胞的染料。但是,这些化合物在显色后容易从细胞膜泄漏,这已成为使用中的问题之一。与这些染料相比,钙黄绿素-AM越来越多地用作显色后从细胞泄漏较少的染料。还已知它不抑制细胞功能,例如淋巴细胞增殖和白细胞趋化性。另外,钙黄绿素-AM在利用杀伤性T细胞和NK细胞的细胞毒性活性的测定中,与使用广泛使用的放射性同位素的51Cr释放方法得到相同的结果,因此细胞毒性较小。钙黄绿素-AM对活细胞染色,并用于在荧光显微镜和流式细胞仪下观察,但是当与死细胞染色染料组合使用时,常用于活细胞和死细胞的双重荧光染色。Papadopoulus等人使用Calcein-AM和Ethidium homodimer(EthD-1)进行双重染色,并使用两种染料的荧光波长差异通过流式细胞术研究细胞毒性。钙黄绿素-AM目前是用于染色活细胞的最有用的染料,因为它的细胞毒性较小,荧光后细胞泄漏较少。如上所述,目前正在使用放射性同位素的测量方法,但是从安全性和便利性的角度出发,期望使用荧光化合物的细胞研究的分析将继续进行。
荧光特性
λex=490 nm, λem=515 nm
操作说明
1. 用1ml无水DMSO溶解1 mg Calcein-AM,制备成1 mmol/l的Calcein-AM母液,-20℃下密闭冷冻保存。
2. 用PBS将Calcein-AM母液稀释制成1-50 µM的Calcein-AM溶液(现配现用)。
3. 吸掉预培养好的细胞中的培养基,用合适的缓冲液清洗2-3次。a)
4. 加入适量的Calcein-AM溶液,在37℃培养细胞15-30分钟。
5. 用PBS或适当的缓冲液洗涤细胞两次。
6. 用490 nm激发波长,515 nm发射波长的滤光片的荧光显微镜观察细胞。
a) 如果Calcein-AM很难进入细胞,可以使用表面活性剂,如Pluronic® F127。
参考文献
1) K. McGinnes, G.Chapman, R.Marks and R.Penny, “A Fluorescence NK Assay Using Flow Cytometry”, J.Immunol.Methods,1986,86,7.
2) S.J.Morris,”Real-time Multi-wavelength Fluorescence Imaging of Living Cells”, BioTechniques,1990,8(3),296.
3) S.A.Weston and C.R.Parish,”New Fluorescent Dyes for Lymphocyte Migration Studies Analysis by Flow Cytometry and Fluorescent Microscopy”, J.Immunol.Methods,1990,133,87.
4) D.M.Callewaert,G.Radcliff,R.Waite,J.Lefevre and D.Poulik,”Characterization of Effector-Target Conjugates for Cloned Human Natural Killer and Human Lymphokine Activated Killer Cells by Flow Cytometry”,Cytometry,1991,12,666.
5) Han-Qing Xie, R.Huang and V.W.Hu, “Intercellular Communication Through Gap Junctions Is Reduced in Senescent Cell”, Biophys.J,1992,62,45.
6) S.A.Weston and C.R.Parish,”Calcein: a Novel Marker for Lymphocytes Which Enter Lymph Nodes”,Cytometry,1992,13,739.
7) X.M.Wang, P.I.Terasaki,G.W. Rankin Jr. ,D.Chia,H.P.Zhong and S.Hardy,”A New Microcellular Cytotoxicity Test Based on Calcein AM Release”, Hum. Immunol.,1993,37,264.
8) N.G.Papadopoulos,G.V.Dedoussis,G.Spanakos,A.D.Gritzapis, C.N.Baxevanis and M.Papamichail,”An Improved Fluorescence Assay for the Determination of Lymphocyte-Mediated Cytotoxicity Using Flow Cytometry”, J.Immunol.Methods,1994,177,101.
9) L.S.De Clerck,C.H.Bridts,A.M.Mertens,M.M.Moens and W.J.Stevens,”Use of Fluorescent Dyes in the Determination of Adherence of Human Leucocytes to Endothelial Cells and the Effects of Fluorochromes on Cellular Function”, J.Immunol. Methods,1994,172,115.
10) H.Ohata,Y.Ujiki and K.Momose,”Confocal Imaging Analysis of ATP-Induced Ca2+ Response in Individual Endothelial Cells of the Artery in Situ”, Am.J.Physiol. ,1997,272(6),1980.
常见问题Q&A
| Q1:与51Cr释放方法有关吗 |
|
A1: “钙黄绿素-AM与51Cr释放方法之间存在相关性。 以下文件中有一份报告。N.G.Papadopoulos, et.al., J.Immunol.Methods, 177,101-111(1994)” |
|
Q2:细胞染料的激发波长和发射波长是多少。 |
| A2: |

|
Q3:细胞染色试剂Cellstain的哪些活细胞染色染料可以在细胞中长时间停留? |
|
A3: “就细胞内保留而言,“ CFSE”可以在细胞中停留最长时间。尽管荧光强度降低,但是已经证实细胞中存在荧光染料达8周。用“ Calcein-AM”和“ BCECF-AM”观察到荧光达3天。也有报道称“钙蛋白-AM”在6小时内在细胞中保留了90%” ・S.A.Weston, et.al., J.Immunol.Methods, 133, 87-97(1990) ・H.P.Zhong, et.al., Hum.Immunol., 37, 264-270(1993)” 但是,“钙调蛋白-AM”和“ BCECF-AM”对细胞毒活性没有影响。 ・L.S.D.Clerck, et.al., J.Immunol.Methods, 172, 115-124(1994) 还要注意的一点是,原始的基本骨架是荧光素,因此由于激发光而褪色由于容易发生,因此可能难以通过长期激发来观察荧光。 (尽管最好使用防褪色剂等) |
| Q4:如何使用Calcein-AM。 |
|
A4:下面以HeLa细胞的情况为例进行介绍。 根据细胞类型和观察条件考虑并固定试剂浓度。 【试剂】 溶液A:将1 mg钙黄绿素-AM溶于1 ml DMSO→1 mmol / L溶液 *将溶液存放在-20°C的阴凉处,以防止变质。 溶液B:用PBS(-)将溶液A稀释500倍(用5 mL PBS稀释10μl溶液A得到2μmol/ L)。 * Calcein-AM在水溶液中分解,因此在使用前请准备溶液B。 【操作】 1)用胰蛋白酶-EDTA收集HeLa细胞并制备细胞悬液。 2)离心细胞悬液(1,000 rpm,3分钟) 3)除去上清液并添加PBS(-)(此时,准备细胞数为105至106细胞/ mL)。 4)用移液器充分分散。 *由于培养液中的血清可能会升高背景,请执行操作2)至4)。 重复并彻底清洗。 5)将30μl在4)中获得的细胞悬液添加至1.5ml微管中。 6)向其中加入15μL[液体B]。 7)盖上微管并在37°C下孵育15分钟。 8)将10μL7)的溶液放在盖玻片上,从上方堆叠盖玻片,然后将染色的细胞悬液夹在中间。 9)将盖玻片放在荧光显微镜下,用490 nm的滤光片激发,观察发出黄绿色荧光的活细胞。 (对于滤光片,如果是490±10 nm,则可以观察到) *排除血清和酚红,因为它们是背景。 *如果背景很高,请清洁它。 *在载玻片上培养的细胞可以用相同的方式染色和观察。 *有关使用PI的双重染色方法,请参阅方案“我要分别对活细胞和死细胞进行染色”。 |
|
Q5:我已经购买了钙黄绿素-AM(粉末),并希望将其制成溶液。 我该怎么办? |
|
A5:溶于DMSO。 分子量几乎为1000,因此,如果将1 mg溶于1 mL DMSO,它将是1 mM的溶液。 请使用尽可能干燥的DMSO。 |


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. Liperfluo 细胞脂质过氧化物检测
NO.5. ROS Assay Kit 活性氧检测
试剂盒内含
500 次 3000 次
・Calcein-AM Reagent 200 μg x 1 1 mg x 1
・PI Stock Solution (1.5 mmol/l) 200 μl x 1 1 ml x 1
・DMSO 200 μl x 1 1 ml x 1
产品概述
Calcein-AM/PI细胞双染试剂盒内含两种染料:Calcein-AM和Propidium Iodide (PI)。这个试剂盒可在荧光显微镜下同时观察在同一个细胞培养皿中的活细胞和死细胞。Calcein-AM可透过细胞膜,通过活细胞内的酯酶作用脱去AM基团,产生的Calcein (钙黄绿素) 发出强绿色荧光,因此活细胞在荧光显微镜下可被检测到绿色荧光。另一方面PI可以通过受损的细胞膜进入到死细胞内并嵌入细胞的DNA双螺旋从而产生红色荧光,因此死细胞会被检测到红色荧光。除了用荧光显微镜外,也有报道可以用流式细胞仪和荧光酶标仪来进行定量检测。
荧光特性
Calcein-AM : λex=490 nm , λem=515 nm
PI : λex=530 nm , λem=580 nm
染色例
细胞染色实例
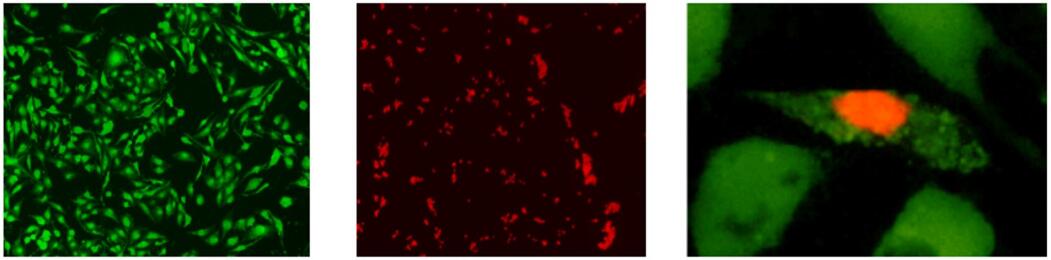
(a) (b) (c)
a) Calcein-AM染FTC细胞(活细胞单染)
b) PI染HCT116细胞(死细胞单染)
c) Calcein-AM、PI染MHD-1 细胞(活死细胞双染)
最佳浓度摸索
由于不同细胞种类、细胞浓度的染色条件不同,我们建议自行摸索一下Calcein-AM和PI的最适浓度。
Calcein-AM和PI的最佳浓度是根据不同的细胞种类而定,通过以下的操作,我们可以找到不同细胞染色试剂的最佳浓度:
1. 通过在0.1%皂苷或0.1-0.5%毛地黄皂苷中培养10 min或通过在70%乙醇中培养30 min制备死细胞。
2. 用0.1-10 μM PI溶液染死细胞,以便找到仅针对细胞核染色而不对细胞质染色的PI浓度。
3. 用0.1-10 μM Calcein-AM溶液染死细胞,以便找到不对细胞质染色的Calcein-AM浓度,再以此浓度的Calcein-AM对活细胞染色以检验活细胞是否被染色。
操作步骤
以HeLa细胞为例
制备1 mmol/l的Calcein-AM储存液
【500 次】
将200 μl DMSO加入到含200 μg Calcein-AM粉末的管中,用移液器吹打溶解。
【3000 次】
将1 ml DMSO加入到含1 mg Calcein-AM粉末的管中,用移液器吹打溶解。
※Calcein-AM储存液需要避光,在-20℃密封保存。
制备染色工作液
将Calcein-AM储存液和PI储存液恢复至室温后使用。
在5 ml的PBS(-)中加入10 μl Calcein-AM储存液和15 μl PI储存液,混匀制成工作液。此时Calcein-AM的浓度为2 μmol/l,而PI的浓度为4.5 μmol/l。
染色步骤
1、 用Trypsin-EDTA消化细胞。
2、 通过离心收集细胞(1,000 rpm,3 min)。
3、 去除上清液,加入PBS(-)制备细胞悬液(105 – 106 cells/ml为宜)。
4、 重复步骤2和步骤3数次以消除培养基中的酯酶活性。
5、 取100 μl 染色工作液与200 μl 细胞悬液混合,在37℃培养15 min。
6、 在490±10 nm激发波长下同时观察黄绿色荧光的活细胞和红色荧光的死细胞。另外用545 nm激发波长单独观察死细胞。
注意事项
1、 由于本试剂盒中的Calcein-AM Reagent 粉末和PI Stock Solution量很少,有可能会粘在盖子或管壁上,开封前请先涡旋以使其振落下来。
2、 由于Calcein-AM储存液对潮气敏感,请在使用后密闭Calcein-AM储存液的盖子。如果不能一次用完,建议分装保存,例如分装成10 μl/管,用封口膜封口,并用铝箔纸包裹,放在一个密闭性能好的塑料袋中,并放入一包干燥剂,在≤-20℃密封避光保存。
3、 配制好的染色工作液请在当天使用。
4、 PI有疑似致癌性,使用前应注意以下几点:
1) 使用时请带好手套,口罩,防护眼镜等,不要接触到或呼吸到。
2) 当PI不慎接触到皮肤时,请立刻用大量的水冲洗。
3) 处理方法
清洗容器的清洗液和废液请按照实验室的有毒有害物质的处理方法进行处理,或按照以下方法处理:
・用UV照射的方法进行分解
・用次氯酸钠氧化分解后,进行中和处理
参考文献
1. A novel photothermally controlled multifunctional scaffold for clinical treatment of osteosarcoma and tissue regeneration,
Materials Today, 2020, doi.org/10.1016/j.mattod.2019.12.005
2. Mitochondria-Targeted Artificial “Nano-RBCs” for Amplified Synergistic Cancer Phototherapy by a Single NIR Irradiation,
Advanced Science, 2018, 5, 1800049
3. 4D-Printed Biodegradable and Remotely Controllable Shape Memory Occlusion Devices,
Advanced Functional Materials, 2019, 29(51), 1906569
4. Magnetic Hyperthermia-Synergistic H2O2 Self-Sufficient Catalytic Suppression of Osteosarcoma with Enhanced Bone-Re
generation Bioactivity by 3D-Printing Composite, Advanced Functional Materials, 2019, 1907071
5. A Substitution-Dependent Light-Up Fluorescence Probe for Selectively Detecting Fe3+ Ions and Its Cell Imaging Application,
Advanced Functional Materials, 2018, 28(35), 1802833
6. An Extendable Star-Like Nanoplatform for Functional and Anatomical Imaging-Guided Photothermal Oncotherapy,
ACS Nano, 2019, 13(4), 4379-4391
7. Near-Infrared Light-Triggered Sulfur Dioxide Gas Therapy of Cancer, ACS Nano, 2019, 13(2), 2103-2113
8. Nanoenzyme-Augmented Cancer Sonodynamic Therapy by Catalytic Tumor Oxygenation,
ACS Nano, 2018, 12(4), 3780-3795
9. Terrylenediimide-Based Intrinsic Theranostic Nanomedicines with High Photothermal Conversion Efficiency for Photoacoustic
Imaging-Guided Cancer Therapy, ACS Nano, 2017, 11(4), 3797-3805
10. Two-Dimensional Graphene Augments Nanosonosensitized Sonocatalytic Tumor, ACS Nano, 2017, 11(9), 9467-9480
11. Multifunctional Bismuth Selenide Nanocomposites for Anti-Tumor Thermo-Chemotherapy and Imaging,
ACS Nano, 2016, 10(1), 984-97
12. Molecular Responses of Human Lung Epithelial Cells to the Toxicity of Copper Oxide Nanoparticles Inferred from Whole
Genome Expression Analysis, ACS Nano, 2011, 5(12), 9326–9338
13. Living functional hydrogels generated by bioorthogonal cross-linking reactions of azidemodified cells with alkyne-modified
polymers, Nature Communications, 2018, 9, 2195
14. A strongly adhesive hemostatic hydrogel for the repair of arterial and heart bleeds,
Nature Communications, 2019, 10(1), 2060
15. Magnetic-responsive and targeted cancer nanotheranostics by PA/MR bimodal imaging-guided photothermally triggered
immunotherapy, Biomaterials, 2019, 219, 119370
16. Oriented collagen fiber membranes formed through counter-rotating extrusion and their application in tendon regeneration,
Biomaterials, 2019, 207, 61-75
17. Triple-functional polyetheretherketone surface with enhanced bacteriostasis and anti-inflammatory and osseointegrative
properties for implant application, Biomaterials, 2019, 212, 98-114
18. Ultrasmall Cu2-xS nanodots as photothermal-enhanced Fenton nanocatalysts for synergistic tumor therapy at NIR-II
biowindow, Biomaterials, 2019, 206, 101-114
19. Theranostic 2D ultrathin MnO2 nanosheets with fast responsibility to endogenous tumor microenvironment and exogenous
NIR irradiation, Biomaterials, 2018, 155, 54-63
20. Cooption of heat shock regulatory system for anhydrobiosis in the sleeping chironomid Polypedilum vanderplanki,
Proc. Natl. Acad. Sci., 2018, 115(10), E2477-E2486
21. Wnt Inhibitor Dickkopf-1 as a Target for Passive Cancer Immunotherapy,
Cancer Research, 2010, 70(13), 5326-36
22. Gadolinium polytungstate nanoclusters: a new theranostic with ultrasmall size and versatile properties for dual-modal MR/CT
imaging and photothermal therapy/radiotherapy of cancer, NPG Asia Material, 2016, 8, e273
23. 2D Superparamagnetic Tantalum Carbide Composite MXenes for Efficient Breast-Cancer Theranostics,
Theranostics, 2018, 8(6), 1648-1664
24. Connexin43 Hemichannels Contribute to Cadmium-Induced Oxidative Stress and Cell Injury,
Antioxidants & Redox Signaling, 2011, 14(12), 2427-39
25. Synthesis and characterization of hierarchically macroporous and mesoporous CaO-MO-SiO2-P2O5(M=Mg,Zn,Sr) bioactive
glass scaffolds, Acta Biomaterialia, 2011, 7(10), 3638-3644
特点:
● 流式细胞仪检测
● 可固定细胞
● 荧光不会泄露

产品概述
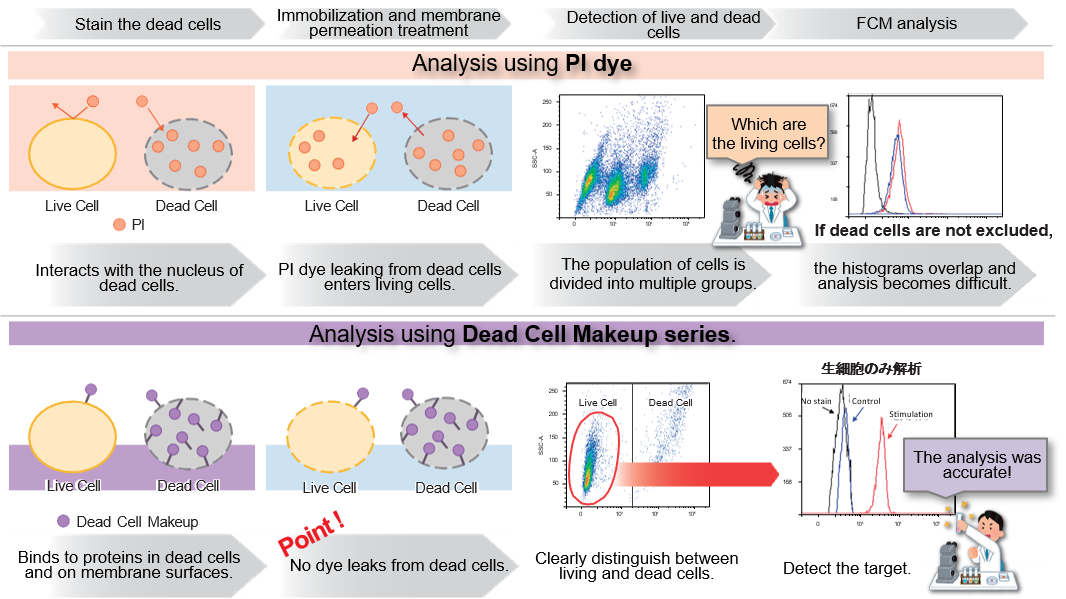
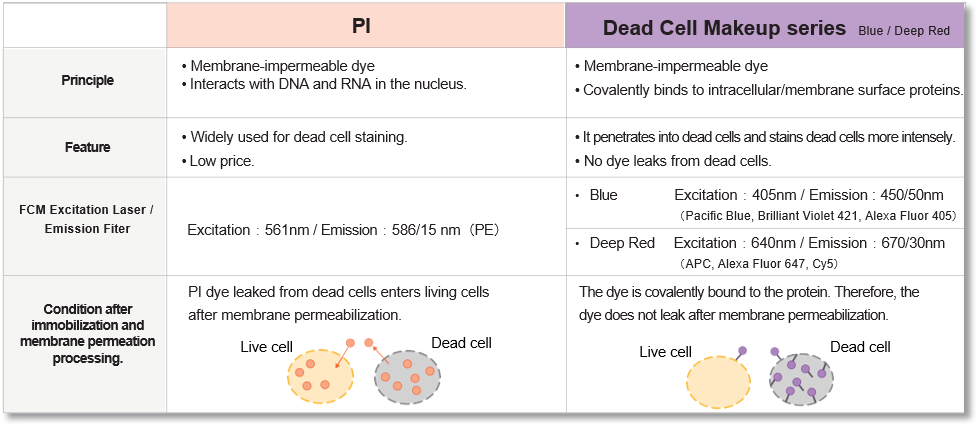
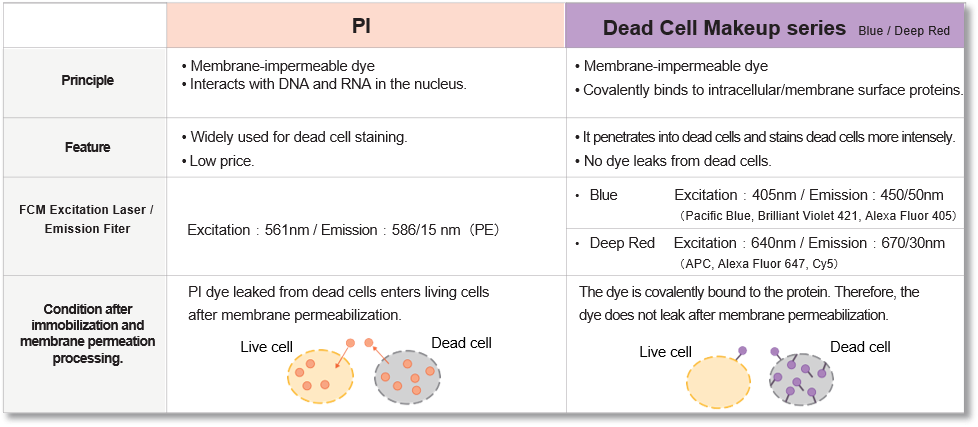
该试剂可与细胞表面和细胞内的蛋白质共价结合,对膜受损的死亡细胞进行强染色。此外,染色剂在固定和渗透细胞后不会渗漏。染色后,活细胞和死细胞的荧光强度差异显著,通过流式细胞仪分析,死细胞很容易区分和排除。
技术信息
区分和排除死细胞对使用流式细胞仪 (FCM) 获得准确数据至关重要,近年来,这一过程已成为发表论文时越来越常见的要求。碘化丙啶(PI)可用于区分死细胞,但细胞膜的固定或渗透会导致 PI 从细胞中渗出,从而难以获得准确的数据。这种试剂具有与细胞表面和细胞内部蛋白质共价结合的特性,因此即使细胞被固定或渗透后,染料也不会渗出。此外,染色后活细胞和死细胞的荧光强度差异很大,因此 FCM 可以轻松区分死细胞并将其排除在分析之外。
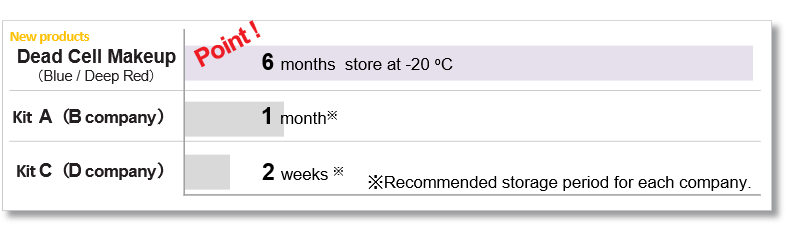
DMSO 储存溶液的保质期
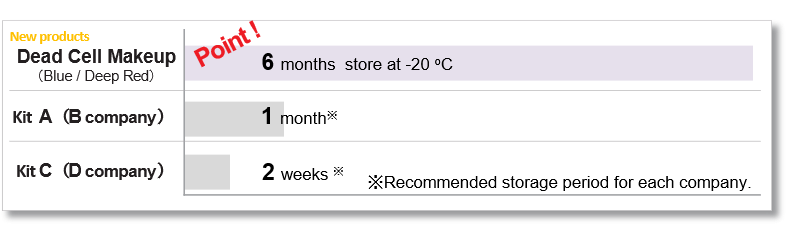
本产品的 DMSO 储备溶液可冷冻保存六个月。
与现有 PI 方法的比较
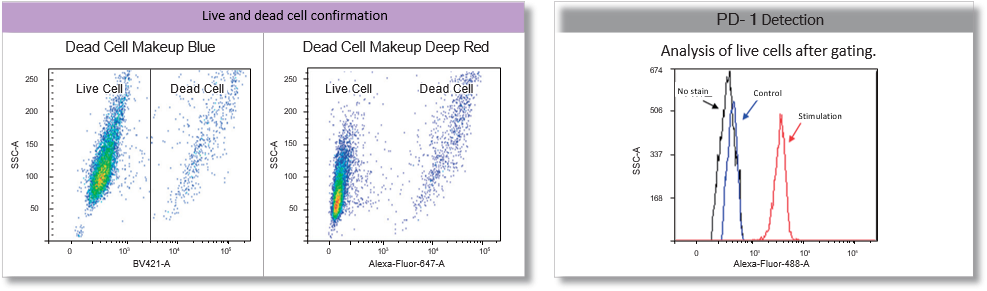
实验案例: 诱导 MOLT-4 细胞衰竭后的 PD-1 检测
MOLT-4 细胞在含有 Ionomycin(500 ng/ml)和 PMA(Phorbol 12-myristate 13-acetate,50 ng/ml)的 RPMI 培养基中刺激 48 小时。死细胞用本品染色,PD-1 表达用免疫染色法检测(一抗:抗 PD-1 小鼠抗体,二抗:抗小鼠抗体-Alexa488)。结果表明,死细胞和活细胞可以清楚地区分开来,而且在只选取活细胞的情况下,受刺激细胞组的 PD-1 表达升高。
实验步骤

试验结果
常见问题Q&A
| Q1:能否测量贴壁细胞? |
| A1:可对贴壁细胞进行检测。用胰蛋白酶消化细胞或用刮板收集细胞,以制备细胞悬液。 |
| Q2:胰蛋白酶会干扰测量吗? |
| A2:通过以下实验证实胰蛋白酶对 HeLa 细胞的影响。我们将胰蛋白酶处理与使用刮板进行了比较,确认两种情况下的分析结果没有区别。
|
| Q3:是否可以用显微镜进行观察? |
| A3:我们已经证实,可以对染色后的 HeLa 细胞进行成像。用这种染料染色的 HeLa 细胞在固定和膜渗透后的成像结果如下。
|
| Q4:染色是否会产生细胞毒性? |
| A4:使用CCK-8 来评估染色对 HeLa 细胞的细胞毒性,结果显示几乎没有细胞毒性。 |
| Q5:染色后能否保存固定的细胞? |
| A5:不建议保存。由于荧光强度在固定后会随着时间的推移而降低,因此染色后的样本应在当天进行检测。 |
| Q6:DMSO stock solution的稳定性如何? |
| A6:该产品在 -20°C 下冷冻保存 6 个月是稳定的。本品受潮后会降解;如果考虑长期储存超过 6 个月,请使用未开封且含水量低的DMSO。
此外,如有必要,可将产品分成小份储存 |
| Q7:如何对细胞进行栅极化? |
| A7:以下是使用 Becton Dickinson (BD) 流式细胞仪的方法。
|
特点:
● 染料不会从死细胞中泄漏
● 储备溶液可以冷冻保存6个月
● 有两种不同的颜色可供选择

产品概述
该试剂可与细胞表面和细胞内的蛋白质共价结合,对膜受损的死亡细胞进行强染色。此外,染色剂在固定和渗透细胞后不会渗漏。染色后,活细胞和死细胞的荧光强度差异显著,通过流式细胞仪分析,死细胞很容易区分和排除。
技术信息
区分和排除死细胞对使用流式细胞仪 (FCM) 获得准确数据至关重要,近年来,这一过程已成为发表论文时越来越常见的要求。碘化丙啶(PI)可用于区分死细胞,但细胞膜的固定或渗透会导致 PI 从细胞中渗出,从而难以获得准确的数据。这种试剂具有与细胞表面和细胞内部蛋白质共价结合的特性,因此即使细胞被固定或渗透后,染料也不会渗出。此外,染色后活细胞和死细胞的荧光强度差异很大,因此 FCM 可以轻松区分死细胞并将其排除在分析之外。

DMSO 储存溶液的保质期
本产品的 DMSO 储备溶液可冷冻保存六个月。
与现有 PI 方法的比较
实验案例: 诱导 MOLT-4 细胞衰竭后的 PD-1 检测
MOLT-4 细胞在含有 Ionomycin(500 ng/ml)和 PMA(Phorbol 12-myristate 13-acetate,50 ng/ml)的 RPMI 培养基中刺激 48 小时。死细胞用本品染色,PD-1 表达用免疫染色法检测(一抗:抗 PD-1 小鼠抗体,二抗:抗小鼠抗体-Alexa488)。结果表明,死细胞和活细胞可以清楚地区分开来,而且在只选取活细胞的情况下,受刺激细胞组的 PD-1 表达升高。
实验步骤

试验结果

常见问题Q&A
| Q1:能否测量贴壁细胞? |
| A1:可对贴壁细胞进行检测。用胰蛋白酶消化细胞或用刮板收集细胞,以制备细胞悬液。 |
| Q2:胰蛋白酶会干扰测量吗? |
| A2:通过以下实验证实胰蛋白酶对 HeLa 细胞的影响。我们将胰蛋白酶处理与使用刮板进行了比较,确认两种情况下的分析结果没有区别。
|
| Q3:是否可以用显微镜进行观察? |
| A3:我们已经证实,可以对染色后的 HeLa 细胞进行成像。用这种染料染色的 HeLa 细胞在固定和膜渗透后的成像结果如下。
|
| Q4:染色是否会产生细胞毒性? |
| A4:使用CCK-8 来评估染色对 HeLa 细胞的细胞毒性,结果显示几乎没有细胞毒性。 |
| Q5:染色后能否保存固定的细胞? |
| A5:不建议保存。由于荧光强度在固定后会随着时间的推移而降低,因此染色后的样本应在当天进行检测。 |
| Q6:DMSO stock solution的稳定性如何? |
| A6:该产品在 -20°C 下冷冻保存 6 个月是稳定的。本品受潮后会降解;如果考虑长期储存超过 6 个月,请使用未开封且含水量低的DMSO。
此外,如有必要,可将产品分成小份储存 |
| Q7:如何对细胞进行栅极化? |
| A7:以下是使用 Becton Dickinson (BD) 流式细胞仪的方法。
|


产品特性
细胞膜起着分隔细胞内和细胞外的作用,并且与细胞的移动和生长、神经信号的传达等细胞功能密切相关。因此,细胞膜的异常与各种细胞状态异常所造成的疾病(如离子通道病Channelopathy)有很密切的关联,被认为是非常重要的生物标记物之一。
由于操作简便并且可用于活细胞染色,小分子荧光探针是最常用的细胞膜染色方法。但是小分子荧光探针普遍存在细胞内停留时间短、水溶性差的问题。而PlasMem Bright是一种克服了现有小分子荧光探针问题的产品。 用PlasMem Bright观察细胞膜时,可以在染色后的1天以上进行长时间的荧光观察。

与其他公司产品的比较
PlasMem Bright系列产品克服了现有市面上的细胞膜染色试剂的诸多缺点(细胞毒性高、停留时间短、不同实验系的兼容性差)。并且分别有Green/ Red两种产品,方便多重染色时自由选择。
| 产品名 | 细胞
毒性 |
染色后
的清洗 |
含血清
培养基 |
停留
时间 |
染色后
的固定 |
| PlasMem Bright | 低 | 不需要 | 可使用 | 24 h | 可以(PFA) |
| S公司 产品P | – | 需要 | 不可使用 | – | 可以 |
| T公司 产品D | – | 需要 | 可使用 | – | 不可以 |
| T公司 产品C | – | 需要 | 可使用 | 1.5 h | 可以(PFA) |
*通过细胞核染色试剂染色后,神经细胞的形态变化(凝集)的比较得出的结论
细胞膜上的停留时间
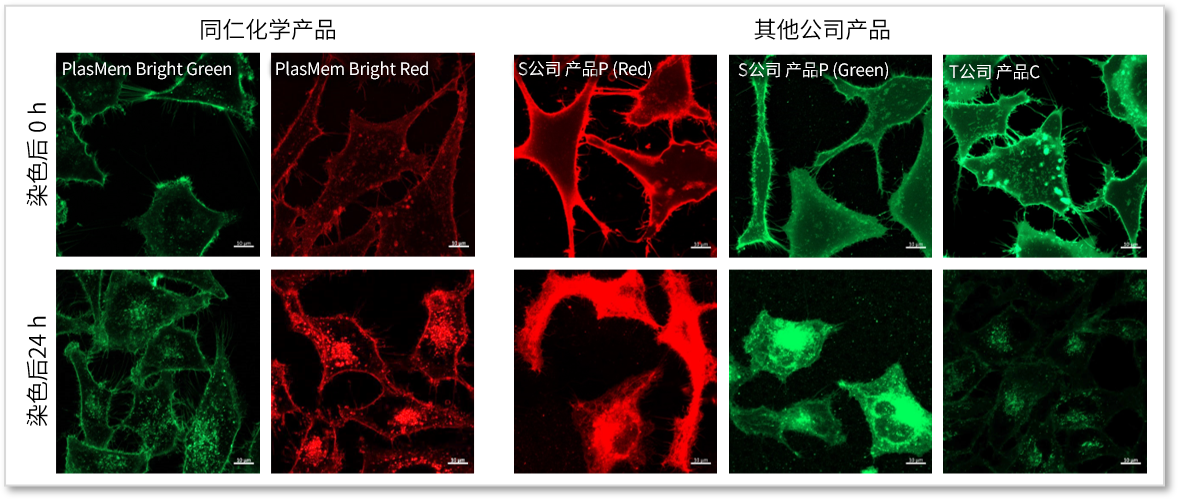
使用各种细胞膜染色试剂进行染色HeLa细胞,经过24 h培养后对各染色试剂的荧光图像进行比较。结果发现,与其他公司的细胞膜染色试剂相比,PlasMem Bright系列产品的染色时间更长,膜上的停留时间也更长。
实验例
实验例:ES细胞群内部的细胞膜染色
将小鼠ES细胞在涂有明胶的玻璃底皿中培养4天,并将获得的细胞群,用PlasMem Bright Green(200倍稀释)染色15分钟,并使用共聚焦显微镜(Zeiss:LSM710)中观察。
结果,细胞群内部的细胞膜也可以用PlasMem Bright Green可视化观察。
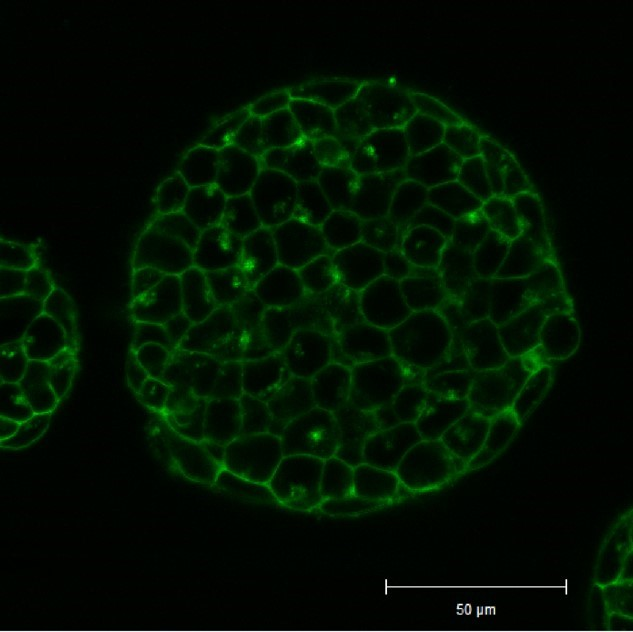
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm.
*此实验例由庆应义塾大学医学院的石津 大嗣老师提供。
实验例:轴突神经细胞形态和线粒体定位的观察
由神经母细胞瘤细胞SH-SY5Y分化诱导的神经细胞,分别用PlasMem Bright Green (绿)、MitoBright LT Red (红)、Hoechst 33342 (蓝) 进行染色。可以鲜明的观察到细胞的形状以及轴突内的线粒体。

(比例尺:200 μm)
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm。
线粒体(MitoBright LT Red【红】):Ex.561 nm/Em.560-620 nm。
细胞核(Hoechst33342【蓝】):Ex.405 nm/Em.400-450 nm。
<实验步骤>
(1)诱导神经芽细胞(SH-SY5Y)为神经细胞。
(2)去除上清液,添加使用培养基中稀释200倍的PlasMem Bright Green、Hoechst 33342(终浓度:5μg/ml)以及MitoBright LT Red(终浓度0.1 μmol/l)。
(3)培养30分钟。
(4)去除上清液,添加HBSS。
(5)使用荧光显微镜观察。
实验例:神经芽细胞(SH-SY5Y)中的线粒体检测
分别用PlasMem Bright Green (绿)、MitoBright LT Red (红)、Hoechst 33342 (蓝) 对神经母细胞瘤细胞SH-SY5Y进行染色,用共聚焦显微镜获得3D图像。可以鲜明的观察到细胞形态以及线粒体和细胞核的情况。
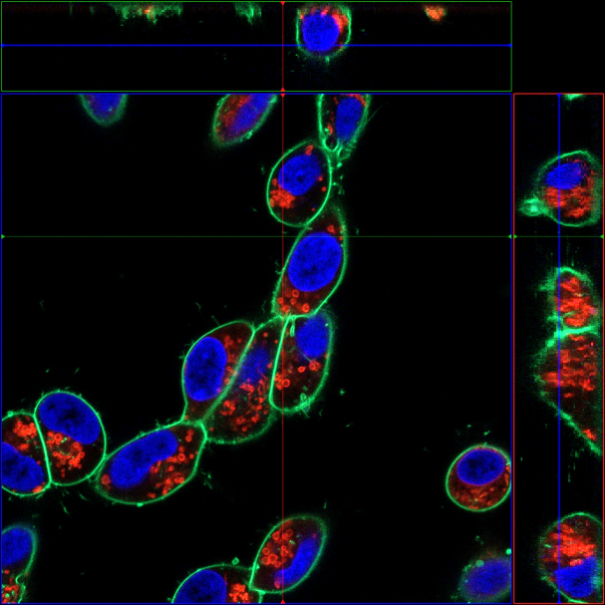
(比例尺:10 μm)
<观察条件>
细胞膜(PlasMem Bright Green【绿】):Ex.488 nm/Em.500-560 nm。
线粒体(MitoBright LT Red【红】):Ex.561 nm/Em.560-620 nm。
细胞核(Hoechst33342【蓝】):Ex.405 nm/Em.400-450 nm。
<实验步骤>
(1)使用HBSS清洗SH-SY5Y细胞。
(2)添加使用培养基中稀释200倍的PlasMem Bright Green、Hoechst 33342(终浓度:5μg/ml)以及MitoBright LT Red(终浓度0.1 μmol/l)。
(3)培养10分钟。
(4)使用HBSS清洗细胞2次
(5)使用荧光显微镜观察。
实验例:脑源性小鼠神经母细胞瘤的延时成像
使用培养基中稀释200倍的PlasMem Bright Green,染色N1E-115细胞30分钟并进行延时成像时,可以清楚地观察到神经细胞内树突和突起中的变化。
<培养条件>
・细胞:N1E-115细胞(脑源性小鼠神经母细胞瘤)
・培养基:5%FBS,1%含谷氨酰胺的D-MEM(低葡萄糖)
・培养设备:35 mm 玻璃底皿
<拍摄条件>
・成像设备:带培养箱的荧光显微镜
・拍摄时间:1小时,拍摄间隔:2分钟
*此实验例由芝浦理工大学系统科学与工程学院的涌澤 充 様、福井 浩二教授提供。
实验例:与外泌体共染色
向PlasMem Bright Green染色的HeLa细胞中加入外泌体膜荧光染色试剂盒(ExoSparkler Exosome Membrane Labeling Kit-Red)染色的外泌体。可以观察到,由活细胞的细胞膜产生的内体(Endosome)中的外泌体,以及没有摄入外泌体的内体。另外,即使在固定染色的细胞之后,也可以像活细胞一样使存在于细胞膜来源的囊泡(内体)中的外泌体可视化。


(比例尺:5 μm)

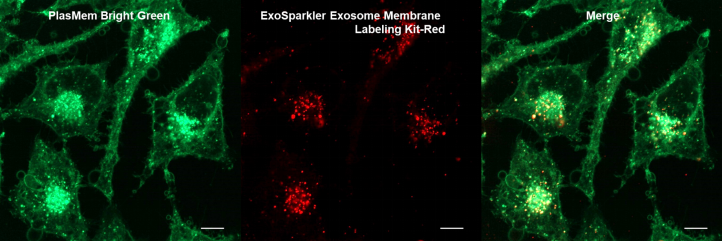
(比例尺:10 μm)
<观察条件>
细胞膜 (PlasMem Bright Green, 绿) Ex. 488 nm / Em. 500-560 nm。
外泌体 (ExoSparkler Exosome Membrane Labeling Kit-Red, 红) Ex. 561 nm / Em. 560-620 nm。
<实验步骤>
(1)接种Hela细胞,24小时培养。
(2)去除上清液,添加使用培养基稀释的PlasMem Bright Green(100倍稀释)。
(3)培养10分钟。
(4)使用HBSS清洗细胞3次。
(5)添加175 μlMEM培养基与ExoSparkler Exosome Membrane Labeling Kit-Red染色过的Exosome溶液25 μl。
(6)在CO2培养箱中过夜培养。
(固定情况下)细胞使用HBSS清洗2次后添加4%PFA,培养15分钟后,使用HBSS清洗细胞2次。
(7)使用共聚焦显微镜观察
实验例:烟草BY2细胞的膜染色
用PlasMemBright Green (200倍稀释)染色烟草BY2细胞5分钟,清洗后每5分钟拍摄一次并进行长时间观察。实验中可以清晰的观察到BY2细胞膜的荧光以及细胞分裂所形成的细胞板。
(数据由名古屋大学栗原大辅老师友情提供)
<检测条件>
・转盘式共聚焦显微镜观察
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
・图中的时间按照00:00 (小时:分钟)表示
实验例:拟南芥根的染色
用PlasMemBright Green (200倍稀释)染色拟南芥根15分钟,采用Z轴景深连续拍照的方法进行荧光观察,可以清晰的观察到立体的细胞膜分布情况。
(数据由名古屋大学栗原大辅老师友情提供)
<检测条件>
・转盘式共聚焦显微镜观察,Z轴摄影
・Ex: 488 nm; Em: 520/35 (502.5-537.5 nm)
关联产品
常见问题Q&A
| Q1: 是否可以用固定化细胞? |
| A: 可以用4% 多聚甲醛(PFA)进行固定。
但是请注意不可以改变细胞膜的渗透性,否则会操造成没有荧光。 |
| Q2: 是否可以进行动态荧光成像? |
| A:可以。 但是请注意将激发光保持在最低水平并提高检测灵敏度。另外,长时间的激发光照射可能会对细胞造成伤害,也更容易使荧光染料分解,请考虑采用时间间隔等方法尽量避免。 |
| Q3: 在配制Working solution的时候是否可以用无血清培养基或Buffer进行稀释? |
| A: 可以。 |
| Q1: 染色后清洗细胞时建议使用什么? |
| A: 无血清培养基、PBS、HBSS等各种缓冲液均可以使用。 |
| Q4: 添加Working solution后,是否可以马上观察? |
| A:添加后马上观察也可以。操作手册上的步骤是加入试剂后培养5 min再观察。 |
| Q5: 细胞膜以外的地方也有被染色的情况,请问是什么原因? |
| A: 感觉观察到细胞膜以外也被染色的情况,可能有如下两个原因
1) 细胞膜上的试剂,随着时间的推移,通过细胞内吞作用进入细胞内。 请参考本产品网页上“细胞膜上的停留时间”的部分,有染色后24 h的照片。 2)荧光成像时的焦点在底面(细胞底部的接触面)上,如下图A。 荧光成像时的焦点请尽量像下图B那样调整Z轴的高度。
|
产品文献
| 编号 | 文献 | 年 | IF |
| 1 | The formation of migrasomes is initiated by the assembly of sphingomyelin synthase 2 foci at the leading edge of migrating cells,
Nature Cell Biology,2023 ,25(8):1173-1184. |
2023 | 21 |


产品特性
细胞膜起着分隔细胞内和细胞外的作用,并且与细胞的移动和生长、神经信号的传达等细胞功能密切相关。因此,细胞膜的异常与各种细胞状态异常所造成的疾病(如离子通道病Channelopathy)有很密切的关联,被认为是非常重要的生物标记物之一。
由于操作简便并且可用于活细胞染色,小分子荧光探针是最常用的细胞膜染色方法。但是小分子荧光探针普遍存在细胞内停留时间短、水溶性差的问题。而PlasMem Bright是一种克服了现有小分子荧光探针问题的产品。 用PlasMem Bright观察细胞膜时,可以在染色后的1天以上进行长时间的荧光观察。
与其他公司产品的比较
PlasMem Bright系列产品克服了现有市面上的细胞膜染色试剂的诸多缺点(细胞毒性高、停留时间短、不同实验系的兼容性差)。并且分别有Green/ Red两种产品,方便多重染色时自由选择。
| 产品名 | 细胞
毒性 |
染色后
的清洗 |
含血清
培养基 |
停留时间 | 染色后
的固定 |
| PlasMem Bright | 低 | 不需要 | 可使用 | 24 h | 可以(PFA) |
| S公司 产品P | – | 需要 | 不可使用 | – | 可以 |
| T公司 产品D | – | 需要 | 可使用 | – | 不可以 |
| T公司 产品C | – | 需要 | 可使用 | 1.5 h | 可以(PFA) |
细胞膜上的停留时间
使用各种细胞膜染色试剂进行染色HeLa细胞,经过24 h培养后对各染色试剂的荧光图像进行比较。结果发现,与其他公司的细胞膜染色试剂相比,PlasMem Bright系列产品的染色时间更长,膜上的停留时间也更长。

实验例
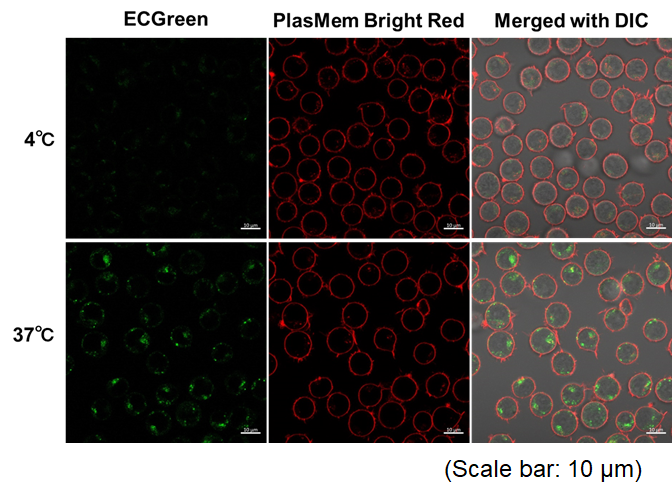
实验例:通过悬浮细胞观察内吞作用对温度依赖性的变化
本实验使用ECGreen内吞检测试剂(产品代码:E296)和PlasMem Bright Red染色,对Jurkat细胞内吞时对温度的依赖性变化
<检测条件>
内体检测(ECGreen, 绿色): Ex. 405 nm / Em. 500 – 560 nm
细胞膜检测 (PlasMem Bright Red,红色): Ex. 561 nm / Em. 560 – 700 nm
<实验步骤>
(1)在样品管中加入Jurkat细胞悬液(10%FBS,RPMI)并在4℃或37℃孵育30min。
(2) 使用步骤(1)配置的细胞悬浮液将ECGreen溶液稀释1000倍。
(3) 4℃或37℃孵育30min。
(4) 用HBSS清洗细胞两次。
(5) 加入含有PlasMem Bright Red(100倍稀释)的培养基,悬浮细胞。
(6) 将悬浮液转移到成像板上,并使用共聚焦显微镜观察细胞。
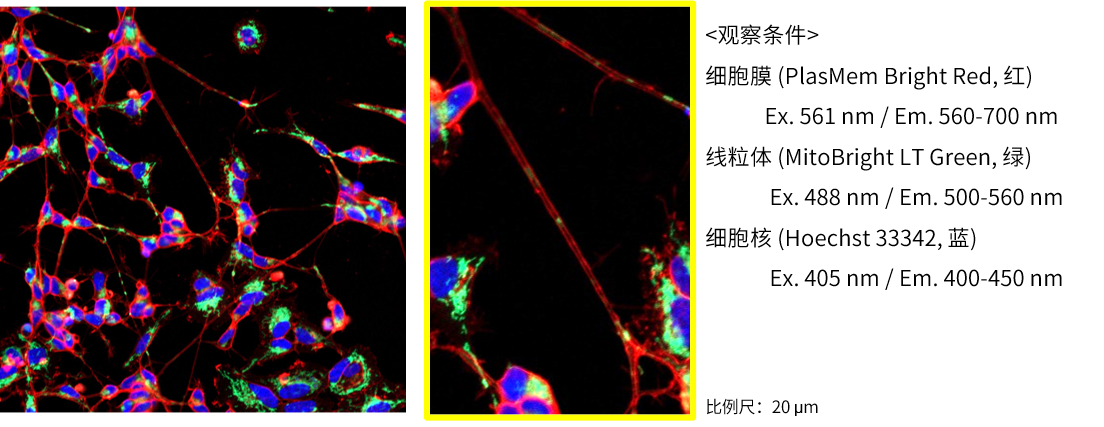
实验例:神经细胞的形态和轴突内线粒体局部观察
由神经母细胞瘤细胞SH-SY5Y分化诱导的神经细胞,分别用PlasMem Bright Red (红)、MitoBright LT Green (绿)、Hoechst 33342 (蓝) 进行染色。可以鲜明的观察到细胞的形状以及轴突内的线粒体。
实验例:观察巨噬细胞摄入外泌体
使用MagCapture™ Exosome Isolation Kit PS (Wako)提取人牙龈组织的间质干细胞(GMSC)产生的外泌体,并使用ExoSparkler Exosome Membrane Labeling Kit-Green (货号:EX01)进行染色。然后将其加入由人类外周血单核细胞(PBMC)分化的人类巨噬细胞中,用PlasMem Bright Red对巨噬细胞进行染色。
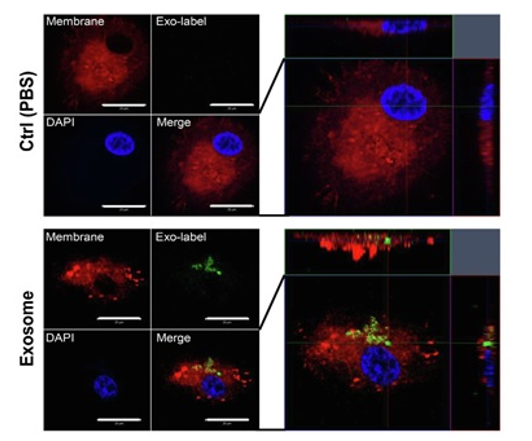
(数据由九州大学附属医院 口腔功能修复科 福田隆男老师友情提供)
<检测条件>
外泌体(Mem Dye – Green):Ex 488 nm / Em 490 – 540 nm
细胞膜(PlasMem Bright Red): Ex. 561 nm / Em. 560 – 700 nm
细胞核(DAPI):Ex. 345 nm / Em. 455 nm
<实验操作>
1. 将多聚赖氨酸包被载玻片(poly-L-lysine coated slides)放置在24 孔板中进行外周血单个核细胞(PBMC)的分化诱导(7 days)。
2. 根据ExoSparkler Exosome Membrane Labeling Kit-Green的操作说明书对10 µg的外泌体进行染色。
3. 将标记好的外泌体,按照1 µg/mL添加到24孔板中,培养3 h。
4. 用PBS清洗细胞1次。
5. 添加用培养基配置好的PlasMem Bright Red (1/100稀释),在CO2培养箱内静置15 min。
6. 用PBS清洗细胞3次。
7. 用4% PFA,室温下固定15 min。
8. 用PBS清洗细胞3次。
9. 用含DAPI的封片剂 (Invitrogen:ProLong™ Gold Antifade Mountant with DAPI)进行封片。
10. 激光共聚焦显微镜LSM 700 confocal microscope (Carl Zeiss) 观察。
关联产品


常见问题Q&A
| Q1: 是否可以用固定化细胞? |
| A: 可以用4% 多聚甲醛(PFA)进行固定。
但是请注意不可以改变细胞膜的渗透性,否则会操造成没有荧光。 |
| Q2: 是否可以进行动态荧光成像? |
| A:可以。 但是请注意将激发光保持在最低水平并提高检测灵敏度。另外,长时间的激发光照射可能会对细胞造成伤害,也更容易使荧光染料分解,请考虑采用时间间隔等方法尽量避免。 |
| Q3: 在配制Working solution的时候是否可以用无血清培养基或Buffer进行稀释? |
| A: 可以。 |
| Q1: 染色后清洗细胞时建议使用什么? |
| A: 无血清培养基、PBS、HBSS等各种缓冲液均可以使用。 |
| Q4: 添加Working solution后,是否可以马上观察? |
| A:添加后马上观察也可以。操作手册上的步骤是加入试剂后培养5 min再观察。 |
| Q5: 细胞膜以外的地方也有被染色的情况,请问是什么原因? |
| A: 感觉观察到细胞膜以外也被染色的情况,可能有如下两个原因
1) 细胞膜上的试剂,随着时间的推移,通过细胞内吞作用进入细胞内。 请参考本产品网页上“细胞膜上的停留时间”的部分,有染色后24 h的照片。 2)荧光成像时的焦点在底面(细胞底部的接触面)上,如下图A。 荧光成像时的焦点请尽量像下图B那样调整Z轴的高度。
|
关联产品





实验工具稀释计算器摩尔浓度计算器
细胞染色
品名货号用途
| 线粒体膜电位检测试剂盒—JC-1 MitoMP Detection Kit | MT09 | 线粒体膜电位检测 |
| MitoBright LT Green试剂 | MT10 | 线粒体长效荧光染色(绿色) |
| MitoBright LT Red试剂 | MT11 | 线粒体长效荧光染色(红色) |
| MitoBright LT Deep Red试剂 | MT12 | 线粒体长效荧光染色(深红色) |
| 染料名 | 检测法 | 荧光色 | λex (nm) | λem (nm) | 染色参考 |
| BCECF-AM | 荧光 | 绿 | 490 | 526 | 进入细胞内AM体分解 |
| Calcein-AM | 荧光 | 绿 | 490 | 515 | 进入细胞内AM体分解 |
| CFSE | 荧光 | 绿 | 496 | 516 | 结合细胞内的蛋白质 |
| FDA | 荧光 | 绿 | 488 | 530 | 細胞内加水分解 |
| PI | 荧光 | 红 | 530 | 620 | 只能染色死細胞(蓝色) |
| AO | 荧光 | 绿 | 502 | 526 | 细胞核染色 |
| DAPI | 荧光 | 兰 | 360 | 460 | 结合死细胞的核酸 |
| Hoechst 33258 | 荧光 | 兰 | 350 | 461 | 结合活细胞/死细胞核酸 |
| Hoechst 33342 | 荧光 | 兰 | 352 | 461 | 结合死细胞的核酸 |
| MitoRed | 荧光 | 红 | 560 | 580 | |
| Rh123 | 荧光 | 绿 | 507 | 529 | |
| MitoBright LT Green | 荧光 | 绿 | 493 | 508 | 线粒体染色 |
| MitoBright LT Red | 荧光 | 红 | 548 | 564 | 线粒体染色 |
| MitoBright LT Deep Red | 荧光 | 深红 | 644 | 666 | 线粒体染色 |
| PlasMem Bright Red细胞膜染色试剂 | P505 | 细胞膜染色试剂—红色 |
| PlasMem Bright Green细胞膜染色试剂 | P504 | 细胞膜染色试剂—绿色 |
| 死细胞标记试剂–Blue | C555 | 死细胞染色 |
| 死细胞标记试剂– Deep Red | C556 | 死细胞染色 |
| Calcein-AM/PI细胞双染试剂盒 | C542 | 细胞染色 |
| 活细胞质染色-绿色——Calcein-AM | C326 | 细胞质 |
| Cellstain- CFSE试剂 | C375 | 细胞质 |
| CFSE试剂 | C309 | 细胞质 |
| FDA试剂 | F209 | 细胞染色 |
| BCECF-AM试剂 | B262 | pH荧光探针 |
细胞核
| Nucleolus Bright Green试剂 | N511 | 核仁荧光染色试剂-绿色 |
| Nucleolus Bright Red试剂 | N512 | 核仁荧光染色试剂-红色 |
| Cellstain- PI试剂 | P346 | 细胞核 |
| Cellstain- PI solution试剂 | P378 | 细胞核 |
| Cellstain- DAPI试剂 | D212 | 细胞染色 |
| Cellstain- DAPI solution试剂 | D523 | 细胞染色 |
| Cellstain- Hoechst 33342 solution试剂 | H342 | 细胞染色 |
| -Cellstain- Hoechst 33258 solution细胞核染色试剂 | H341 | 细胞染色 |
| Cellstain- AO solution试剂 | A430 | 细胞核 |
| FSB solution试剂 | F308 | 细胞染色 |
品名货号用途
| DAB试剂 | D006 | 染色试剂 |
特点:
● 适用于普通荧光酶标仪
● 不需要昂贵的仪器、特殊介质和孔板
● 带OCR计算表的一体式试剂盒


产品解说
产品规格

OCR计算器
OCR是线粒体功能的重要指标
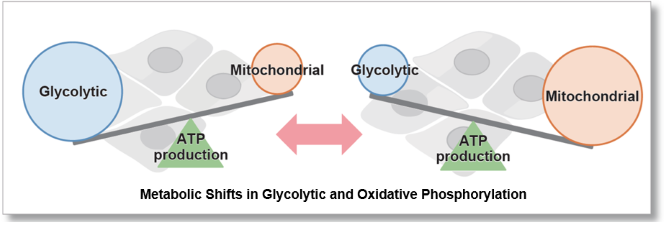
由于氧主要在线粒体氧化磷酸化产生三磷酸腺苷(ATP)的过程中消耗,因此其耗氧率(OCR)是分析线粒体功能的指标。众所周知,癌细胞通过糖酵解途径产生ATP,其效率低于氧化磷酸化。在免疫细胞中,氧化磷酸化的优势是抑制抗肿瘤,而糖酵解途径的优势促进抗肿瘤作用。因此,细胞的OCR作为能量代谢的检测指标。
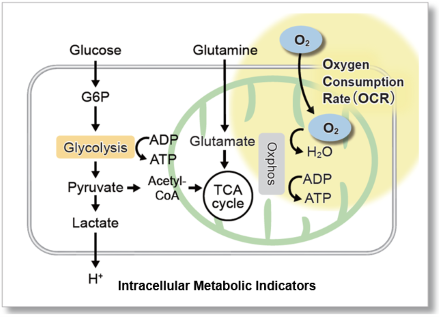
产品概述
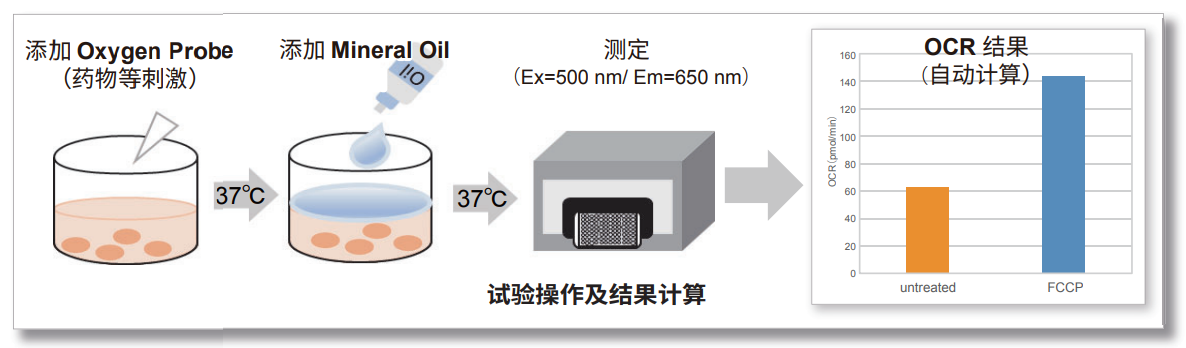
细胞外氧消耗量试剂盒包括氧气探针,其具有随着介质中氧气浓度的降低而增加荧光强度的特性,矿物油阻止氧气从空气中流入。
在用荧光酶标仪根据细胞外氧浓度测量荧光强度之后,根据Stern-Volmer方程计算细胞的OCR(自动计算表)。

*该产品在群马大学Toshitada Yoshihara博士的指导下实现了产品化。
与现有方法比较
到目前为止,OCR测量需要昂贵的设备,如通量分析仪,实时动态检测酶标仪,以及酶标仪的功能调节。该试剂盒推荐给初此使用的人,因为它可以与常规荧光酶标仪一起使用,并附带所有必要试剂的完整包装。

与石英分析仪对比
石英分析仪(XFe24)和本试剂盒在相同条件下(细胞类型、细胞数量和FCCP浓度)进行测量。
得到XFe24与本试剂盒相关氧消耗速度变化的数据。
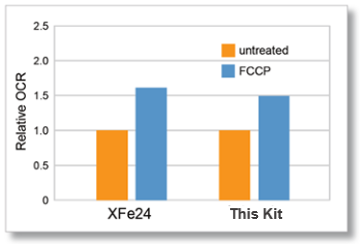
细胞种类: HepG2
细胞数: 5×10⁴ cells/well
试剂: FCCP (Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone)
FCCP 浓度: 2 μmol/l
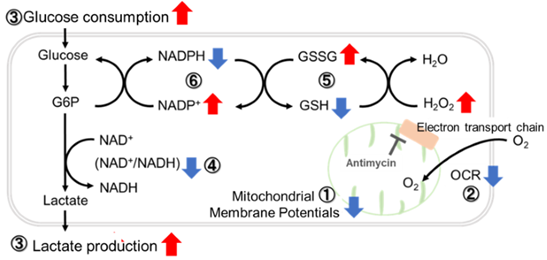
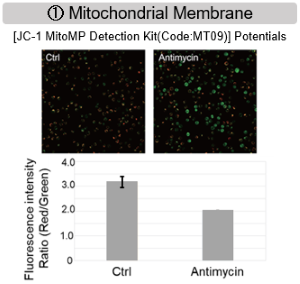
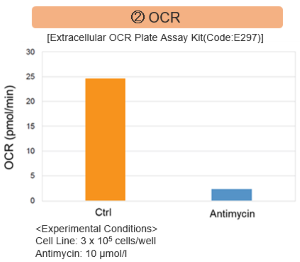
实验例:抑制线粒体电子传输链
用抗霉素刺激大鼠细胞,评估线粒体电子运输链抑制后细胞状态的变化,检测多种指标。
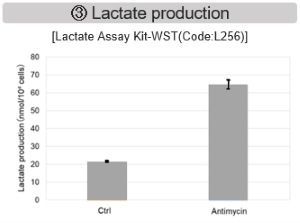
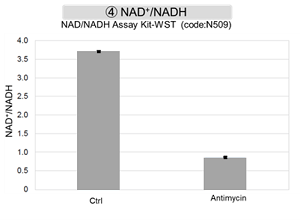
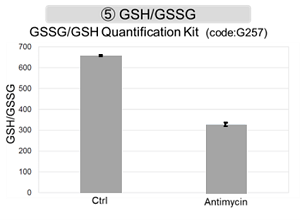
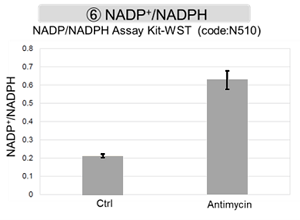
结果表明,电子传输链的抑制导致(1)线粒体膜电位的降低和(2)OCR的降低。此外,观察到(3)整个糖酵解途径的NAD+/NADH比率降低,这是由于丙酮酸到乳酸的代谢增加,以维持糖酵解通路;(4)由于活性氧(ROS)增加,GSH耗竭;(6)由于谷胱甘肽生物合成所需NADPH减少,NADP+/NADPH比率增加。
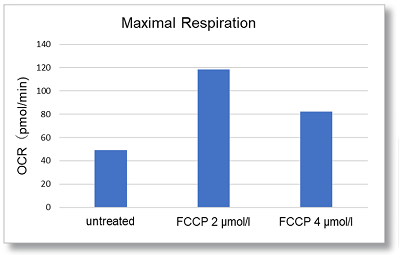
实验例:细胞最大呼吸能力评估
在HepG2细胞中,通过FCCP刺激后OCR值的变化来评估细胞的最大呼吸。
在FCCP浓度分别2µmol/l和4µmol/l 测量OCR。与2µmol/l相比,在4µmol/l时观察到OCR降低,表明在2µmol/l FCCP时最大呼吸。
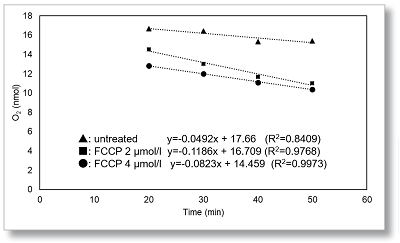
细胞: HepG2
细胞数: 5×104 cells/well
试剂: FCCP
FCCP 浓度 2, 4 μmol/l
实验例:不同细胞系代谢途径依赖性的比较
许多癌症细胞通过糖酵解途径产生ATP。另一方面,最近有报道称,糖酵解途径被抑制的癌症细胞,可通过增强线粒体功能将能量代谢转移到OXPHOS而达到存活的目的,代谢途径的依赖性因细胞系不同而异。
基于乳酸生成、ATP水平和OCR值,比较了两种癌症细胞HeLa和HepG2中OXPHOS和糖酵解的依赖性关系。
<通过乳酸生产和ATP水平进行评估>
我们证实了当寡霉素刺激和糖酵解途径中的 2-Deoxy-D-glucose(2-DG)抑制OXPHOS的ATP合成时,ATP和乳酸产生的变化。结果表明,HeLa细胞依赖于糖酵解,HepG2细胞依赖于OXPHOS合成ATP。
*有关结果的更多信息,请参下方的“所用技术和产品的补充信息”部分。
| 所用技术和产品的补充信息 |
| <通过乳酸产生和ATP的量进行评估>
当OXPHOS在HeLa细胞中被抑制时,ATP水平保持不变(①),乳酸产生增加(②)。这表明,即使OXPHOS被抑制,糖酵解也可以被进一步激活。相反,当糖酵解被抑制时,ATP水平显著降低(③),表明能量的产生依赖于糖酵解。另一方面,当OXPHOS在HepG2细胞中被抑制时,乳酸的产生增加(④),表明细胞试图通过增强糖酵解来补偿能量的产生,但ATP水平仍然降低(⑤)。这意味着,即使糖酵解增加,ATP的产生也没有得到足够的代偿。此外,当糖酵解被抑制时,ATP水平下降更多(⑥),这表明HepG2细胞的能量产生更多地依赖于OXPHOS而不是糖酵解。 |
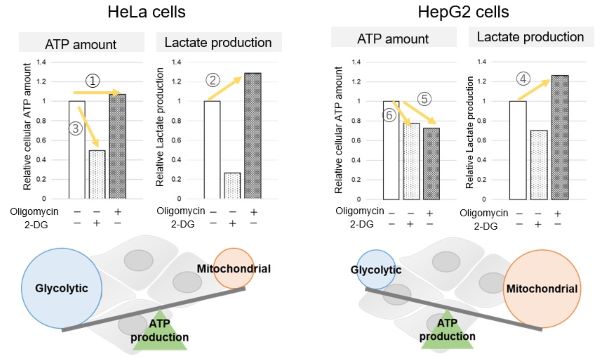
本数据同时使用了:糖酵解/氧化磷酸化检测试剂盒—Glycolysis/OXPHOS Assay Kit(G270)
<OCR值评估>
使用相同数量的细胞,我们测量了当用线粒体解偶联剂FCCP刺激细胞来促进细胞耗氧量时的OCR值。结果表明,HepG2细胞比HeLa细胞具有更高的OCR值,这表明对OXPHOS的依赖性更强,这与ATP水平和乳酸产生的结果有关。
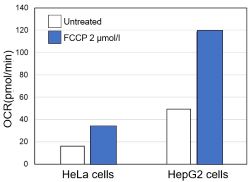
〈实验条件〉
细胞系:HeLa、HepG2
细胞数:5×104个细胞/孔
刺激:FCCP
浓度:2μmol/l
使用:Oxygen Consumption Rate(OCR) Plate Assay Kit-氧消耗量检测试剂盒(货号:E297)进行评估
Q&A
| Q:本试剂盒可以检测多少样本? |
| A:当测试一种细胞类型的相同数量的细胞时,可以测量24个样品。
*如果实验中使用了两种以上的细胞类型或多个细胞编号,则必须准备单独的空白和对照,并且可以测量的样本数量会有所不同。 有关详细信息,请参考手册中的板布局示例。 |
| Q:悬浮细胞有什么实验案例吗? |
| A:我们准备了一个大鼠细胞实验的例子。<说明>
(1) 将大鼠细胞(3.0×106细胞/ml)悬浮于RPMI培养基中作为空白3,将大鼠细胞(3.0×106细胞/ml)悬于工作溶液中作为对照或样品。将细胞接种在100µl(300000个细胞/孔)的96孔黑色透明底部微孔板中。
(2) 向空白1中加入100µl RPMI培养基,向空白2中加入100μl工作溶液。
(3) 将微孔板放置在预先设定为37°C的读板器中,孵育30分钟。
(4) 向空白1、空白2、空白3和对照品中加入10µl RPMI培养基。
(5) 将用RPMI培养基稀释的样品溶液(抗霉素或FCCP溶液)分10µl加入样品中。
(6) 加入样品溶液后,立即向每个孔中加入一滴矿物油。
(7) 将微板放置在37°C的平板读数器中,孵育5分钟。
(8) 在一个时间过程中,用荧光板读取器每10分钟测量一次强度,持续200分钟(Ex:500nm,Em:650nm,底部读数)。 (9) OCR值通过将获得的强度值输入下载的专用Excel计算表来计算。 每孔所需的样品和试剂数量。
|
| Q:如何使用此试剂盒计算OCR? |
| A:请使用Excel计算表并遵循以下说明
<OCR计算程序概述> (1) 将OCR测量获得的强度值输入计算表,使用Stern-Volmer公式自动计算氧含量(nmol)。 (2) 根据时间(min)与氧含量(nmol)的关系图,检查所有测量条件下获得的线性范围。 (3) 计算步骤(2)中确认的时间(min)和氧含量(nmol)范围内的斜率。 (4) 根据步骤(3)中计算的斜率计算OCR(pmol/min)。 有关详细信息,请参阅手册中的“分析”。 *需要计算OCR的客户请至【网站首页】-【技术支持】-【实验工具】即可找到OCR计算器 |
| Q:矿物油对细胞有细胞毒性吗? |
| A: 当通过Cell Counting Kit-8细胞毒性测定测定时,在用矿物油处理的细胞中未观察到毒性。 |
| Q:为什么使用此试剂盒需要搭配可控温的酶标仪? |
| A: 在添加试剂和矿物油后,将微孔板与培养箱(或加热块、恒温室等)一起孵育,酶标仪中的温差将影响OCR结果。这导致数据再现性下降。因此,请使用温度可控的酶标仪。
<常规操作>
步骤3、7用于悬浮细胞,步骤5、9用于贴壁细胞 <孵育环境对结果的影响>
|
| Q:OCR检测后如何测量细胞数? |
| A:使用核酸探针(代码:H342)Hoechst 33342测量每个孔的细胞数,这是该方案的一个示例。
<说明> (1) 将细胞接种到孔中进行OCR测量(液体体积:100μl/孔)。 (2) 将制备校准曲线的细胞接种到孔中(液体体积:100μl/孔)。 (3) OCR根据说明书进行测量。 (4) 向孔中加入10µl/孔的介质进行校准(使介质体积与OCR测量孔的体积对齐至110µl/孔)。 (5) 将用培养基稀释的Hoechst 33342溶液(10µg/ml)以100µl/孔的速度添加到所有孔中。 *从油的顶部添加OCR测量孔。 (6) 在37°C下培养30分钟。 (7) 用荧光板读数器(Ex:350nm,Em:461nm)测量。 (8) 制备校准曲线(X轴:细胞数量,Y轴:荧光强度),并计算用于OCR测量的孔中的细胞数量。
|
| Q:可以长期存储工作液吗 |
| A 工作液不能储存,需要现配现用。 |
| Q:氧探针或矿物油的反复冷冻和解冻是否会影响测定? |
| A 我们已经证实,氧气探针和矿物油的反复冻融循环对测定没有影响。 |
| Q:对照组与实验组之间OCR没有差异,有哪些可能得原因? |
| A请检查以下两个实验条件。
(1) 如果在测量过程中温度发生变化,可能会影响OCR结果。请确保以下两个步骤完全按照说明书执行。 ・矿物油、溶剂和稀释溶剂等溶液在使用前应预热至37°C左右。 ・加入试剂和矿物油后,请使用温度可控的酶标仪进行孵育。 请参阅Q&A“为什么使用此试剂盒需要搭配可控温的酶标仪?”。 (2) 建议在最终计算前,优化单元格数据。如果细胞数量较低,实验组和对照组之间的差异也可能并不显著。 【带有细胞数和试剂处理的OCR值(预期结果图)】
|
参考文献
| 文献 | 研究对象 | 引用文献 |
| 1 | 细胞(HepG2) | K.Saito.et al“Obesity-induced metabolic imbalance allosterically modulates CtBP2 to inhibit PPAR-alpha transcriptional activity”2023,Journal of Biological Chemistry,doi.org/10.1016/j.jbc.2023.104890 |
| 2 | 细胞(NIH3T3-L1) | S. Oki, S. Kageyama, Y. Morioka and T. Namba, “Malonate induces the browning of white adipose tissue in high-fat diet induced obesity model”, Biochem Biophys Res Commun., 2023, doi:10.1016/j.bbrc.2023.08.054. |
| 3 | 细胞
(Primary Hepatocyte) |
S. Tsuno, K. Harada, M. Horikoshi, M. Mita, T. Kitaguchi, M. Y. Hirai, M. Matsumoto and T. Tsubo , ‘Mitochondrial ATP concentration decreases immediately after glucose administration to glucose-deprived hepatocytes’, FEBS Open Bio, 2023, doi:10.1002/2211-5463.13744. |
| 4 | 精子 | “Arresting calcium-regulated sperm metabolic dynamics enables prolonged fertility in poultry liquid semen storage”, Scientific Reports , 2023 , doi: 10.1038/s41598-023-48550-2. |
| 5 | 细胞(HepG2) | Takeo Nakanishi.et al“An implication of the mitochondrial carrier SLC25A3 as an oxidative stress modulator in NAFLD“Experimental Cell Research.,2023,431,113740 |