C6H11NO
113.16
特点:
● 纯度高
● 杂质峰少


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. TEMP 单线态氧检测
NO.2. BMPO 超氧阴离子和羟自由基检测
NO.3. ROS Assay Kit 活性氧检测
NO.4. SOD Assay Kit 超氧化物歧化酶(SOD)检测
NO.5. Caspase-3 Assay Kit-Colorimetric- 细胞凋亡检测
规格性状

质量约为1.1g
产品概述
由于具有潜在的致癌风险和促进衰老的作用,生物体内的自由基已成为研究的热点。 DMPO是研究自由基最常用的自旋捕获剂。 它适用于捕获氧自由基,尤其是超氧化物,并生成具有特征的EPR信号的加合物。 但是,大多数市售的DMPO包含会引起高背景的杂质。 因此,这些DMPO需要进一步纯化才能在EPR上进行实验。 Dojindo的DMPO实行严格的质量管控,没有杂质引起的背景问题,因此不需要任何预纯化处理。
产品特点
•超高纯度
•更高的信噪比
•无需预纯化

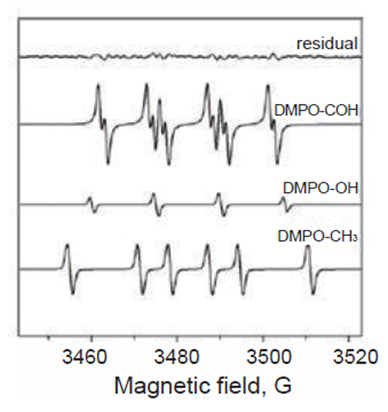
同仁化学研究所 (Dojindo) 的DMPO没有杂质 (*) 检出

以羟自由基的Fenton反应(黑色)和空白(蓝色)为例,同仁化学研究所(Dojindo)的峰更清晰,S/N比例更高
应用
自旋捕获剂,EPR(ESR)检测,超氧阴离子,羟基自由基
原理
自旋捕捉ESR技术是一种检测活性氧的最可靠的办法,它能提供具有特征的ESR信号。DMPO采用一种特殊的敏感方法,可以捕捉超氧阴离子和羟自由基等,分别产生独特的ESR光谱。因此它是探测生物系统内ROS的强有力工具。
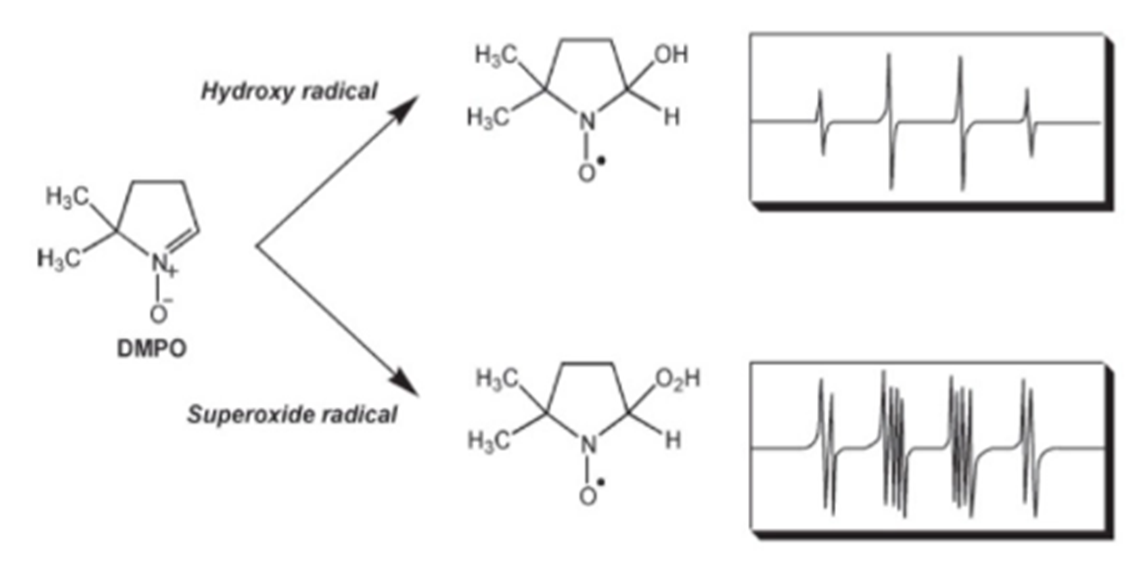
操作步骤
SOD清除超氧阴离子的活性检测
1. 将15 μl的DMPO溶液和 50 μl的5 mM的次黄嘌呤加入到35 μl的0.1 M的磷酸盐缓冲液 (pH 7.8) 中。
2. 加入50 μl的待测SOD标准品或待测样品,涡旋振荡 1-2 s。
3. 加入50 μl的0.4 U/ml的黄嘌呤氧化酶之后立即涡旋振荡。
4. 放置一段时间 (例如 1 min) 将溶液转入ESR样品管中检测。
5. 通过峰值计算相对强度(DMPO-O2-/Mn2+)。
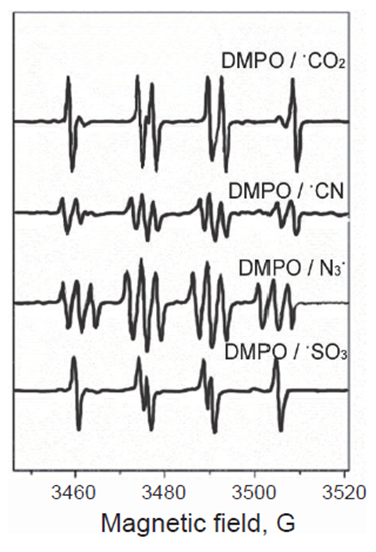
C-,N-,S-基自由基的检测
1. 制备100 mM含有25 μM Diethylenetriaminepentaacetic Acid (DTPA)的磷酸盐缓冲液 (pH 7.4),作为过渡金属螯合剂。
2. 制备以下过氧化物酶底物:A) 100 mM 甲酸钠(HCOONa);B) 100 mM氰化钾(KCN);C) 100 mM叠氮钠(NaN3);D) 含有100 mM亚硫酸钠 (Na2SO3)的100 mM磷酸盐缓冲液 (pH 7.4)。
3. 制备4.0 mg/ml(~100 μM)的辣根过氧化物酶 (HRP)溶液和1 mM H2O2溶液。
4. 制备浓度为1 M的DMPO溶液。
5. 在离心管中加入130 μl的缓冲液,加入20 μl已配好的1 M的DMPO溶液,再加入20 μl底物储存液,10 μl的1 mM H2O2溶液,最后加入20 μl HRP触发反应。
6. 涡旋振荡离心管,加入到进样系统中,检测图谱。
7. 加样后调节光谱并得到图谱。各物质的终浓度为:100 mM DMPO,10 mM的底物,50 μM H2O2,10 μM HRP。
数据和操作流程由Bruker公司友情提供
参考文献
1. Cardiac Myocyte–Specific Expression of Inducible Nitric Oxide Synthase Protects Against Ischemia/Reperfusion Injury byPreventing Mitochondrial Permeability Transition,Circulation, 2008, 118(19),1970-8.DOI: 10.1161/CIRCULATIONAHA.108.791533
2. Genetic Deficiency of Glutathione S-Transferase P Increases Myocardial Sensitivity to Ischemia-Reperfusion Injury,Circulation Research, 2015, 117(5), 437-49.DOI: 10.1161/CIRCRESAHA.114.305518
3. Prussian Blue Nanoparticles as Multienzyme Mimetics and Reactive Oxygen Species Scavengers,Journal of the American Chemical Society, 2016, 138(18), 5860-5.DOI: 10.1021/jacs.5b12070
4. Highly bioactive zeolitic imidazolate framework-8–capped nanotherapeutics for efficient reversal of reperfusion-induced injury in ischemic stroke, Science Advances, 2020, 6(12), eaay9751.DOI: 10.1126/sciadv.aay9751
5. Potentiating antibiotics in drug-resistant clinical isolates via stimuli-activated superoxide generation,Science Advances, 2017, 3(10), e1701776.DOI: 10.1126/sciadv.1701776
6. Detection and imaging of the free radical DNA in cells-Site-specific radical formation induced by Fenton chemistry and its repair in cellular DNA as seen by electron spin resonance, immuno-spin trapping and confocal microscopy,Nucleic Acids Res., 2012, 40(12), 5477-5486.DOI: 10.1093/nar/gks180
7. Ultrasmall Cu2-xS nanodots as photothermal-enhanced Fenton nanocatalysts for synergistic tumor therapy at NIR-II biowindow,Biomaterials, 2019, 206, 101-114.DOI: 10.1016/j.biomaterials.2019.03.014
8. Intelligent Nanocomposites with Intrinsic Blood-Brain-Barrier Crossing Ability Designed for Highly Specific MR Imaging and Sonodynamic Therapy of Glioblastoma, Small, 2020, e1906985.DOI: 10.1002/smll.201906985
9. Amino acid oxidation of the D1 and D2 proteins by oxygen radicals during photoinhibition of Photosystem II,Proc. Natl. Acad. Sci., 2017, 114(11), 2988-2993.DOI: 10.1073/pnas.1618922114
10. Hydrogen sulfide cytoprotective signaling is endothelial nitric oxide synthase-nitric oxide dependent,Proc. Natl. Acad. Sci., 2014, 111(8), 3182-3187.DOI: 10.1073/pnas.1321871111
11. Nonenzymatic displacement of chlorine and formation of free radicals upon the reaction of glutathione with PCB quinones,Proc. Natl. Acad. Sci., 2009, 106(24), 9725-9730.DOI: 10.1073/pnas.0810352106
12. Overexpression of Extracellular Superoxide Dismutase Attenuates Heparanase Expression and Inhibits Breast Carcinoma Cell Growth and Invasion, Cancer Research, 2009, 69(15), 6355-63.DOI: 10.1158/0008-5472.CAN-09-1195
13. Manganese Superoxide Dismutase Modulates Hypoxia-Inducible Factor-1A Induction via Superoxide,Cancer Research, 2008, 68(8), 2781-8.DOI: 10.1158/0008-5472.CAN-07-2635
14. Iron and sulfur co-doped graphite carbon nitride (FeOy/S-g-C3N4) for activating peroxymonosulfate to enhance sulfamethoxazole degradation, Chemical Engineering Journal, 2020, 382, 122836.DOI:10.1016/j.cej.2019.122836
15. Spontaneous DNA damage to the nuclear genome promotes senescence, redox imbalance and aging,Redox Biology, 2018, 17, 259-273.DOI: 10.1016/j.redox.2018.04.007
16. Switch of Mitochondrial Superoxide Dismutase into a Prooxidant Peroxidase in Manganese-Deficient Cells and Mice,Cell Chemical Biology, 2018, 25, 413-425.DOI: 10.1016/j.chembiol.2018.01.007
17. Photochemical reaction of tricresyl phosphate (TCP) in aqueous solution: Influencing factors and photolysis products,Chemosphere, 2020, 241, 124971.DOI: 10.1016/j.chemosphere.2019.124971
18. Crossover between anti- and pro-oxidant activities of different manganese oxide nanoparticles and their biological implications,Journal of Materials Chemistry B, 2020,DOI: 10.1039/c9tb02524c
