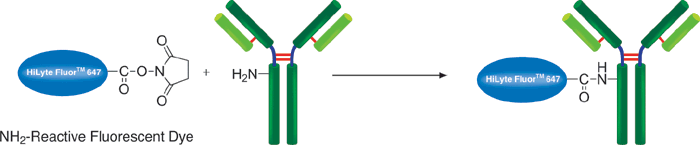
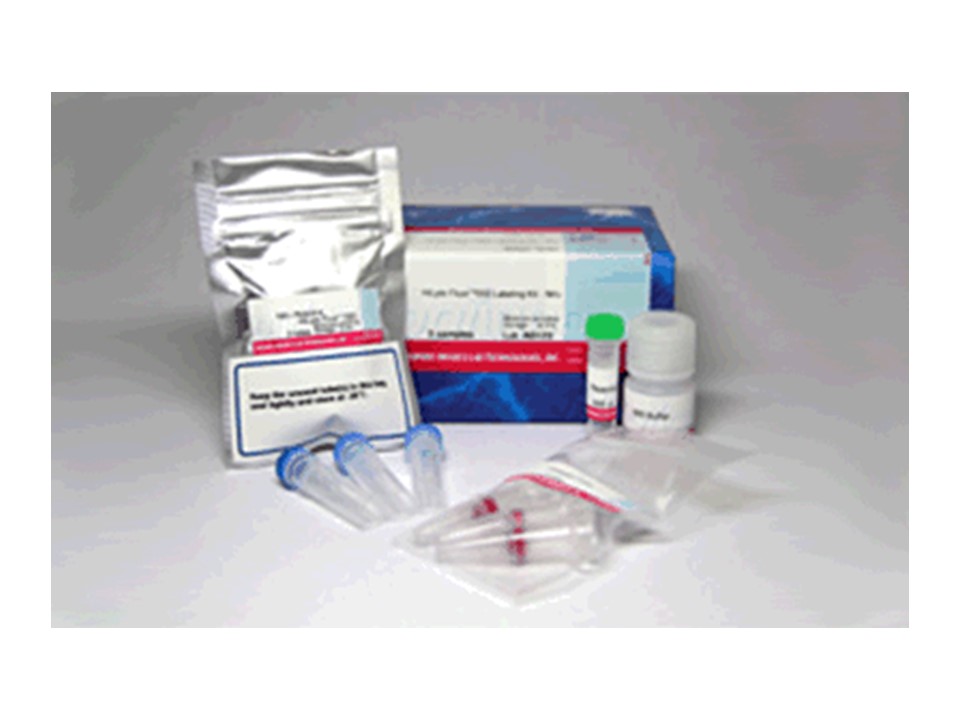
特点:
● POD标记的产品可以在大约3个小时内制备。
● 可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
● 可以标记50至200μg的蛋白质。
● POD标记的产品只需与SH反应过氧化物酶混合即可形成。
● 还可以通过使用附着的还原剂标记不具有游离SH基团的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● POD标签可与随附的存储溶液一起存储。


试剂盒内含

产品概述
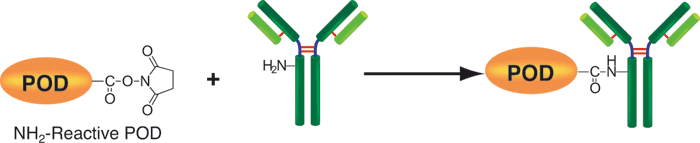
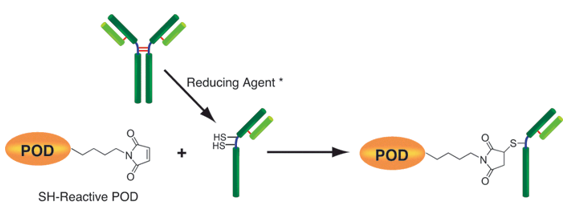
该试剂盒主要用于制备酶免疫分析(EIA)所需的辣根过氧化物酶标IgG以及竞争性EIA所需的辣根过氧化物酶标抗原。该试剂盒中的SH-reactive peroxidase能够与含有巯基的蛋白质或者其他分子反应。该试剂盒包含了标记过程中所需的全部试剂,包括还原剂和储存用缓冲液。SH-reactive peroxidase可以和靶分子形成共价键,还原剂能够在IgG分子上建立自由巯基。当辣根过氧化物酶标IgG用于EIA时,SH-reactive peroxidase的高效性足以使它在标记后省去纯化的过程。即使在标记后需要有一个高纯度的精制过程,也只要用亲和柱或凝胶渗透柱就能简单达到目的。在标记小分子的时候,使用试剂盒中包含的过滤管即可除去分子量较大的分子。
原理
操作步骤
使用注意事项:
1.所需标记的较大的蛋白质的分子量要>50,000。
2.所需标记的较小的巯基化合物的分子量要<5,000。
3.标记过程中,标记前后的IgG总是在过滤管的滤膜上。
4.如果IgG溶液含有其它分子量超过10,000的蛋白质,如BSA或凝胶,在使用该试剂盒标记前请先纯化IgG溶液。IgG溶液能够使用IgG纯化试剂盒来纯化(不包含于此试剂盒中)。
5.如果IgG溶液中含有小的不溶物,离心后提取上清液来标记。
6.如果长时间不使用,建议您把试剂盒中的酶SH -reactive peroxidase放在-20℃冰箱中保存,不需要充氮气,可以更好地保持酶的活性,但请不要把其它试剂和过滤管放到-20℃冰箱中,仍请放在0-5℃冰箱中保存。
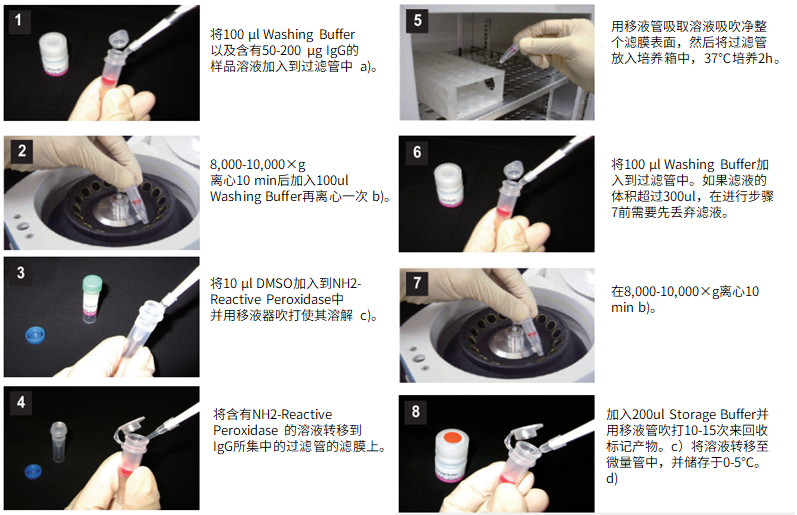
标记IgG操作步骤:
(1)将100μl Solution A以及含有50-200μg IgG的样品溶液加入到过滤管中。a)
(2)用移液器使溶液混合,8,000-10,000g离心10分钟。b)
(3)将150μl Solution A加入到Reducing agent中并用移液器吹打使其溶解。
(4)将100μl步骤3所得溶液转移到IgG所集中的过滤管的滤膜上。
(5)用移液器吹打数次,然后在37℃下培养30分钟。
(6)将100μl Solution B加入到过滤管中,8,000-10,000g离心10分钟。除去滤液,加入200μl Solution B,再离心一次。b)
(7)将50μl Reaction buffer加入到SH-reactive peroxidase中并用移液器吹打使其溶解。
(8)将SH-reactive peroxidase溶液移到被还原的IgG所集中的过滤管的滤膜上。
(9)用移液器吹打数次,然后在37℃下培养1小时。
(10)将100μl Solution A加入到试管中,8,000-10,000g离心10分钟。b)
(11)加入200μl Storage buffer并吹打10-15次来回收标记产物。c)将此溶液转移至一支0.5ml的试管,并储存于0-5℃。

a)推荐的IgG的量为100μg,样品溶液的体积不应超过100μl。如果抗体浓度低于0.5mg/ml,重复步骤1和2直至总的IgG聚积量达到50-200μg。如果在聚积过程中,滤液体积超过了400μl,则需在进行下一步离心前将滤液除去。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度为0.5-1.3mg/ml。在进行后续的酶免疫,免疫印迹,免疫转染试验前先要将标记后的IgG稀释至适当的浓度。每个还原后的IgG分子上会被标记 上1到2个辣根过氧化物酶分子。没有被结合的辣根过氧化物酶不会干扰正常的免疫试验。如果一定要纯化的话,可以使用凝胶渗透柱或亲合柱。
d)通常辣根过氧化物酶标记后的还原型IgG在Storage buffer中,0-5℃下至少能够保存2个月,如果需要保存更久,可以添加等量的丙三醇(终浓度:50%),并在-20℃下存放。另外,还要注意样品自身是否稳定。
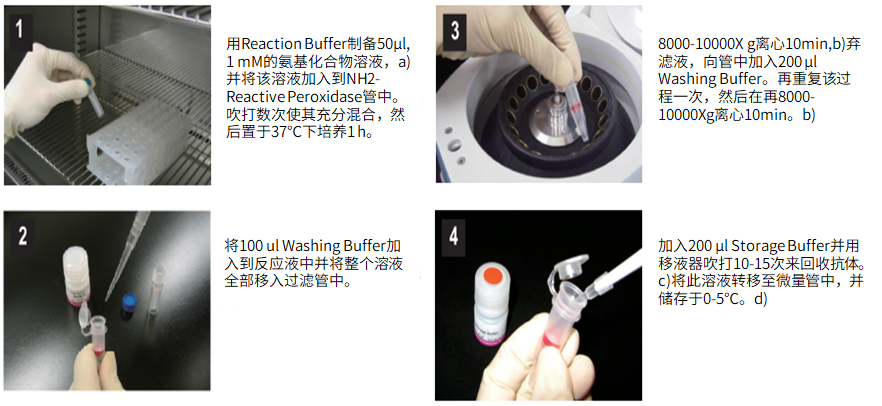
标记小分子操作步骤:
(1)用Reaction buffer制备50μl,1 mM的巯基化合物溶液,a)并将该溶液加入到SH-reactive peroxidase管中。吹打数次使其充分混合,然后置于37℃下培养1小时。
(2)将100μl Solution A加入到反应液中并将整个溶液全部移入过滤管中。
(3)在8,000-10,000g离心10分钟,b)弃滤液,向管中加入200μl Solution A。再重复该过程一次,然后再在8,000-10,000g离心10分钟。b)
(4)加入200μl Storage buffer并用移液器吹打10-15次来回收抗体。c)将此溶液转移至一支0.5ml的试管中,并储存于0-5℃下。d)
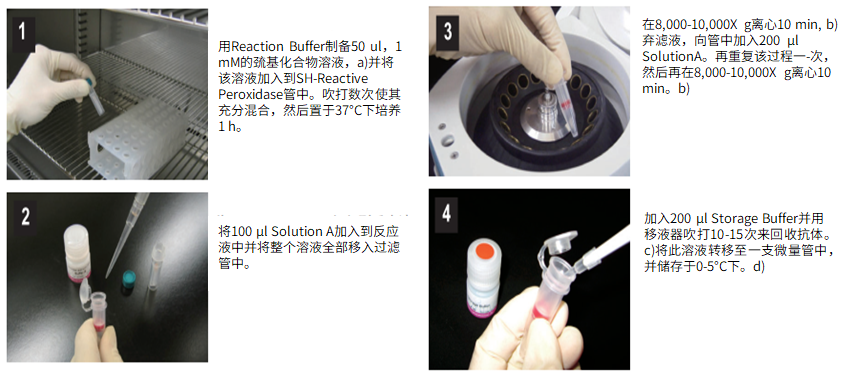
a)如果巯基化合物无法在水溶液中溶解,可以用DMSO使其溶解,制备成10mM的溶液,取5μl 与45μl Reaction buffer混合。
b)如果溶液在离心后仍然残留在膜上,可以再离心5分钟或者适当增加转速。
c)标记产物的浓度大约为400-500μg/ml(10-12.5μM)。1到2个靶分子能够和1个辣根过氧化物酶分子结合。
d)标记后的小分子在0-5℃下能够存放至少6个月。
产品优势
1)POD标记的产品可以在大约3个小时内制备。
2)可以标记高分子量化合物(MW> 50,000)和低分子量化合物(MW <5,000)。
3)可以标记50至200μg的蛋白质。
4)POD标记的产品只需与SH反应过氧化物酶混合即可形成。
5)还可以通过使用附着的还原剂标记不具有游离SH基团的蛋白质。
6)可以通过使用过滤管的分离操作以高回收率获得标记物质。
7)POD标签可与随附的存储溶液一起存储。
常见问题Q&A
| Q1: 能够使用这个试剂盒标记F(ab’)2吗? |
| A:可以标记。请参照标记IgG的操作说明,回收率通常都超过80%。 |
| Q2: 能够用这个试剂盒标记其他蛋白质或者多肽吗? |
| A:可以,只要标记分子的还原型分子量>50,000或者<5,000且具有活性巯基结构。如果分子量.>50,000,参照IgG的标记操作说明,使用0.5-1 nmol蛋白样品用 LK09-10来标记。如果分子量<5,000,参照标记小分子的操作说明。如果分子量>5,000且<50,000,请咨询我们的客户服务。Email:info@dojindo.cn 免费电话 :800-988-0083 |
| Q3: 能够使用这个试剂盒标记寡核苷酸或者寡肽吗? |
| A:可以,只要它的分子量小于5,000且具有活性巯基。可以参照标记小分子的操作说明。 |
| Q4:LK09所能标记的最小的IgG的量是多少? |
| A:最小量为50 μg。标记50 μg与200 μg之间的IgG,在灵敏度和本底上没有太大的区别。但是,在步骤8,使用SH-reactive peroxidase溶液时,用量缩小为原来的1/5,也能够标记10 μg的IgG。 |
| Q5: 每个IgG能够标记多少辣根过氧化物酶分子? |
| A:每个IgG平均能标记上1-2个辣根过氧化物酶分子。 |
| Q6:标记蛋白质之前是否必须先使用过滤管? |
| A:如果蛋白溶液中不含有带有活性巯基的小分子并且蛋白浓度在10 mg/ml或者70 μM左右,则没有必要使用过滤管。只需要将样品溶液和Solution B混合,再把混合液加入到SH-reactive peroxidase管中即可。 |
| Q7:是否必须要使用试剂盒所包含的Storage Buffer? |
| A:不一定要使用试剂盒所包含的Storage Buffer。可以选择任何适用于该试验的缓冲液。但是,Storage Buffer能够提高标记产物的稳定性。 |
| Q8:我的样品中含有小的不溶物,我该怎么办? |
| A:低速离心后用上清液来标记。 |
| Q9:标记反应结束后,未标记的SH-reactive peroxidase是否仍然含有活性马来酰亚胺? |
| A:不含有。几乎100%的SH-reactive peroxidase都被用于了IgG或者小分子的标记。 |
| Q10:Storage Buffer中是否含有动物产品或者高分子聚合物? |
| A:Storage Buffer中不含有任何动物产品,高分子聚合物或者重金属离子。 |
参考文献
| 1) 広田次郎, 清水眞也, “キットを用いたモノクローナル抗体への迅速・簡便なペルオキシダーゼ標識法”, 動物衛生研究所研究報告, 2005, 111, 37. |
| 2) K. Inoue, A. Sugiyama, P. C. Reid, Y. Ito, K. Miyauchi, S. Mukai, M. Sagara, K. Miyamoto, H. Satoh, I. Kohno, T. Kurata, H. Ota, A. Mantovani, T. Hamakubo, H. Daida and T. Kodama, “Establishment of a High Sensitivity Plasma Assay for Human Pentraxin3 as a Marker for Unstable Angina Pectoris”, Arterioscler. Thromb. Vasc. Biol., 2007, 27, 161. |
| 3) N. Esaki, Y. Ohkawa, N. Hashimoto, Y. Tsuda, Y. Ohmi, R. H. Bhuiyan, N. Kotani, K. Honke, A. Enomoto, M. Takahashi, K. Furukawa, and K. Furukawa, “ASC amino acid transporter 2, defined by enzyme-mediated activation of radical sources, enhances malignancy of GD2-positive small-cell lung cancer.”, Cancer Sci.., 2018, 109, (1), 141. |
| 4) G.W.Zhanga, S.J.Lai, Y.Yoshimura, and N.Isobe, “Messenger RNA expression and immunolocalization of psoriasin in the goat mammary gland and its milk concentration after an intramammary infusion of lipopolysaccharide”, Vet. J.., 2014, 202, (1), 89. |
| 5) G-W. Zhang, S-J. Lai, Y. Yoshimura, and N. Isobe, “Expression of cathelicidins mRNA in the goat mammary gland and effect of the intramammary infusion of lipopolysaccharide on milk cathelicidin-2 concentration”, Vet. Microbiol.., 2014, 170, (1-2), 125. |
| 6) H. Tateno, S. Saito, K. Hiemori, K. Kiyoi, K. Hasehira, M. Toyoda, Y. Onuma, Y. Ito, H. Akutsu, and J. Hirabayashi, “α2–6 sialylation is a marker of the differentiation potential of human mesenchymal stem cells”, Glycobiology., 2016, 26, (12), 1328. |
| 7) K. Iizumi, H. Kawasaki, A. Shigenaga, M. Tominaga, A. Otsu, A. Kamo, Y. Kamata, K. Takamori, and F. Yamakura, “Tryptophan nitration of immunoglobulin light chain as a new possible biomarker for atopic dermatitis”, J Clin Biochem Nutr., 2018, 63, (3), 197. |
| 8) K. Morioka, K. Fukai, K. Yoshida, R. Yamazoe, H. Onozato, S. Ohashi, T. Tsuda, and K. Sakamoto, “Foot-and-Mouth Disease Virus Antigen Detection Enzyme-Linked Immunosorbent Assay Using Multiserotype-Reactive Monoclonal Antibodies”, J. Clin. Microbiol.., 2009, 47, (11), 3663. |
| 9) M. Watanabe, I. Takemasa, N. Kaneko, Y. Yokoyama, E. Matsuo, S. Iwasa, M. Mori, N. Matsuura, M. Monden, and O. Nishimura, “Clinical significance of circulating galectins as colorectal cancer markers”, Oncol. Rep.., 2011, 25, (5), 1217. |
| 10) M. Yasunaga, S. Saijou, S. Hanaoka, T. Anzai, R. Tsumura, and Y. Matsumura, “Significant antitumor effect of an antibody against TMEM180, a new colorectal cancer‐specific molecule”, Cancer Sci.., 2019, 110, (2), 761. |
| 11) N. Esaki, Y. Ohkawa, N. Hashimoto, Y. Tsuda, Y. Ohmi, R. H. Bhuiyan, N. Kotani, K. Honke, A. Enomoto, M. Takahashi, K. Furukawa, and K. Furukawa, “ASC amino acid transporter 2, defined by enzyme‐mediated activation of radical sources, enhances malignancy of GD2‐positive small‐cell lung cancer”, Cancer Sci.., 2018, 109, (1), 141. |
| 12) N. Hashimoto, K. Hamamura, N. Kotani, K. Furukawa, K. Kaneko, K. Honke, and K. Furukawa, “Proteomic analysis of ganglioside‐associated membrane molecules: Substantial basis for molecular clustering”, Proteomics., 2012, 12, (21), 3154. |
| 13) N. Kotani, Y. Ida, T. Nakano, I. Sato, R. Kuwahara, A. Yamaguchi, M. Tomita, K. Honke, and T. Murakoshi, “Tumor-dependent secretion of close homolog of L1 results in elevation of its circulating level in mouse model for human lung tumor”, Biochem. Biophys. Res. Commun.., 2018, 501, (4), 982. |
| 14) R. Yamashita, N. Kotani, Y. Ishiura, S. Higashiyama, and K. Honke, “Spatiotemporally-regulated interaction between β1 integrin and ErbB4 that is involved in fibronectin-dependent cell migration”, J. Biol. Chem.., 2011, 149, (3), 347. |
| 15) T. Noro, E. Oishi, T. Kaneshige, K. Yaguchi, K. Amimoto, and M. Shimizu, “Identification and characterization of haemagglutinin epitopes of Avibacterium paragallinarum serovar C”, Vet. Microbiol.., 2008, 131, (3-4), 406. |
| 16) K. Okada, H. Itoh and M. Ikemotob, “Circulating S100A8/A9 is potentially a biomarker that could reflect the severity of experimental colitis in rats’, Heliyon, 2020, 6, (2), e03470. |