特点:
● 只需添加小分子量荧光试剂即可轻松检测线粒体
● 可以使用荧光显微镜进行活细胞成像
● 可以与附着的溶酶体染色剂同时染色
关联产品





特点:
● 只需添加小分子量荧光试剂即可轻松检测线粒体
● 可以使用荧光显微镜进行活细胞成像
● 可以与附着的溶酶体染色剂同时染色
关联产品





C38H37ClN2O5
637.17
特点:
● 基于膜电位对线粒体染色
● 红色荧光
● 激发和发射波长分别为560 nm和580 nm


规格性状
规格
特性:该产物为品红色至紫棕色固体,可溶于二甲基亚砜和甲醇。
可溶于二甲基亚砜:试验成功
NMR光谱:试验适合
产品概述
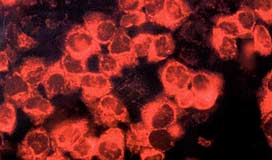
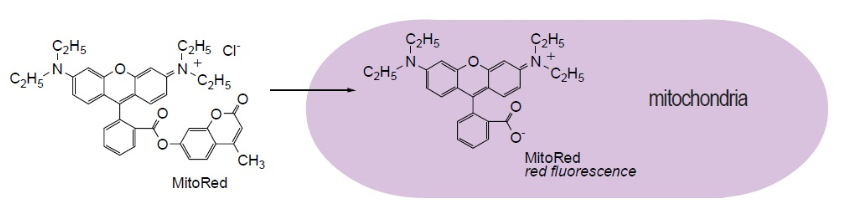
MitoRed为基于罗丹明的可透过细胞膜的染料。它集中于线粒体内并发出红色荧光。MitoRed与线粒体的相互作用取决于线粒体的膜电位。
可用20-200 nM MitoRed对线粒体染色。MitoRed的激发和发射波长分别为560 nm和580 nm。
荧光特性
λex=560 nm, λem=580 nm
操作说明
染色步骤
1. 将50 µg MitoRed溶解到78 µl DMSO中制备成1 mM MitoRed-DMSO溶液。
2. 用载玻片准备细胞。细胞数目应为5×104-5×105个/ml。
3. 孵育该载玻片,用PBS或Hank’s液洗涤细胞。
4. 用培养基稀释1 mM MitoRed溶液以制备20-200 nM MitoRed缓冲液。
5. 将MitoRed缓冲液a) 加入载玻片并在37℃下孵育30分钟至1小时。
6. 去除MitoRed缓冲液并用培养基洗涤细胞。b)
7. 用带有罗丹明滤光片的荧光显微镜观察细胞。
a) 加入细胞前将MitoRed缓冲液放在37℃下孵育。
b) 洗涤细胞后为了固定,加入10%福尔马林缓冲液并孵育15-20分钟,接着用PBS洗涤。
文献
1) R. Ikeda, T. Sugita, E. S. Jacobson and T. Shinoda, “Effects of Melanin upon Susceptibility of Cryptococcus to Antifungals”, Microbiol. Immunol., 2003, 47(4), 271.
常见问题Q&A
| Q1:如何使用Mito Red。
|
|
A1: 下面显示了一个使用HeLa细胞的示例。 *根据细胞类型和观察条件,有必要检查试剂浓度和染色条件。 <试剂> -Cellstain®-MitoRed 二甲基亚砜 用DMSO 78μL→1 mmol / L溶液溶解MitoRed 50μg(1瓶) <操作方法> 1.培养小室玻片上的细胞,以使细胞密度合适。 (1×105至1×106细胞/ mL) 2.除去培养基,并轻轻洗涤(培养基,PBS,Hank溶液等)。 用中等浓度将3.1 mmol / L的MitoRed溶液稀释至最终浓度为20-200 nmol / L。 (最好先将其在37°C的温度下保温,然后再添加到细胞中) 将稀释的MitoRed溶液加入孔中,并在培养条件下孵育大约30分钟至1小时。 4.除去MitoRed溶液,并用中性溶液洗涤。 5.在荧光显微镜G激发下观察。 (Λex= 560 nm,λem= 580 nm) 固定电池时,请执行以下(3)之后的操作。 4.除去MitoRed溶液并洗涤。 (无血清培养基,PBS,Hank溶液等) 5.用5.10%中性福尔马林缓冲液固定15至20分钟。 6.用PBS清洁。 7.在荧光显微镜下观察。
|
|
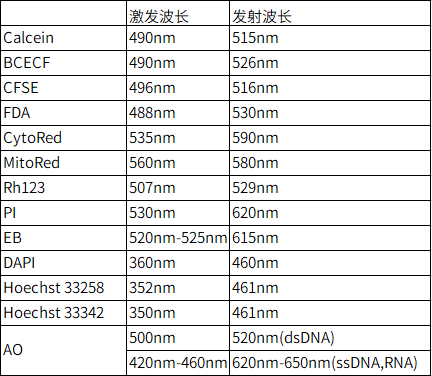
Q2:细胞染料的激发波长和发射波长是多少。 |
| A2: |
|
Q3:不管是活细胞还是死细胞,它都会染色细胞内线粒体吗?
|
|
A3:仅活细胞。它不能用于死细胞,因为线粒体的膜电位会丢失。
|
关联产品





特点:
● 灵敏度高
● 易上手
● 多种仪器均可检测


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. ROS Assay Kit 活性氧检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.5. Mitophagy Detection Kit 线粒体自噬检测
试剂盒内含

产品概述
细胞中的线粒体作为有氧呼吸产生ATP的主要场所,是体内重要的细胞器之一,常被用于早期细胞毒性、氧化应激、细胞凋亡等研究中1)。线粒体活性的降低与机能失调,已被证实与癌症、衰老、神经退行性疾病 (如阿尔兹海默症、帕金森病等) 等密切相关2)3)。
JC-1是一种被广泛使用的小分子线粒体膜电位探针,依赖于线粒体膜电位在线粒体中聚集,染料伴随聚集过程,荧光从绿色 (530 nm) 变为红色 (590 nm)。当线粒体发生去极化,红/绿荧光强度比值降低。以往的研究者反映,JC-1不易溶于水并有大量沉淀产生。但与其他公司的产品不同,同仁化学研究所研制的JC-1试剂解决了这一问题,避免了沉淀的产生。同时使用试剂盒中配制的成像缓冲液 (Imaging Buffer),可大幅降低荧光背景并在检测过程中保护细胞不受损伤。
当JC-1工作液的浓度为2 μmol/l, 每次用量为100 μl时,可以检测500次。
产品特点
1.为什么要检测线粒体膜电位
线粒体不仅是细胞内产生能量的场所,它还与癌症、衰老、阿尔兹海默症、帕金森等神经变异性疾病密切相关。因此,针对线粒体状态的研究非常重要,其中线粒体膜电位的变化经常被作为重要的指标之一检测。
当线粒体正常、膜电位差保持不变时,JC-1会聚集并发出红色荧光,而当膜电位降低时,JC-1会作为单体存在并发出绿色荧光。红色和绿色荧光强度的变化可以作为检测线粒体状态的指标。
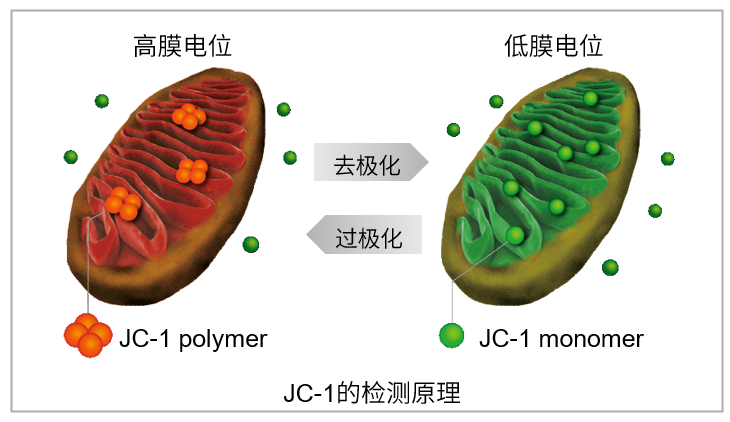
2.初次使用也很容易上手

3.去极化的检测实例
使用去极化剂carbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)对HeLa细胞进行处理,用本试
剂盒进行检测。可以发现与未加药物的细胞相比,加药组细胞的红色荧光明显减少。
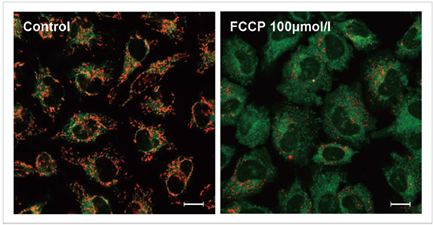
实验条件
JC-1浓度: 2 μmol/l in MEM, 染色时间30 min
FCCP浓度:100 μmol/l, FCCP处理时间1 h
检测条件
Green : Ex 488 nm/ Em 500-550 nm;
Red : Ex 561 nm/ Em 560-610 nm;
标尺: 20 μm
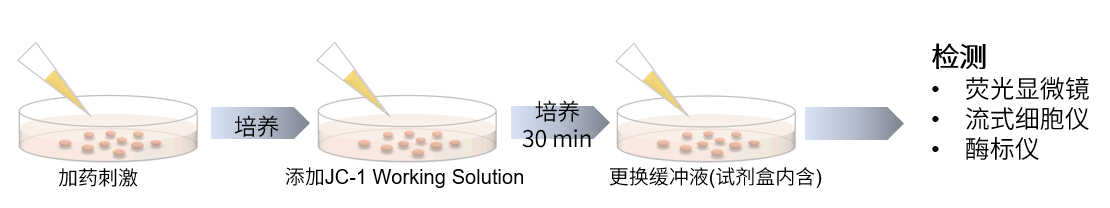
操作步骤
实验例
1.诱导凋亡的实验例
1.1 荧光显微镜
通过荧光颜色的改变判断由凋亡导致的线粒体膜电位的变化。
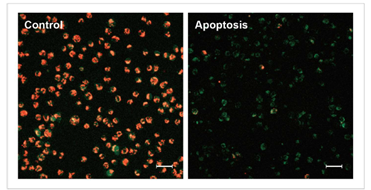
检测条件
Green: Ex 488 nm / Em 500-550 nm
Red : Ex 561 nm / Em 560-610 nm
标尺: 80 μm
1.2 流式细胞仪
定量分析单个细胞的膜电位变化
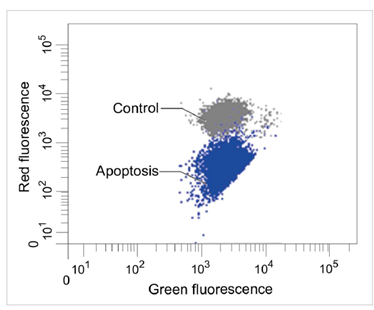
检测条件
Green: Ex 488 nm / Em 515-545 nm
Red : Ex 488 nm / Em 564-604 nm
1.3 酶标仪
确认孔板中吸光度来判断线粒体膜电位的变化
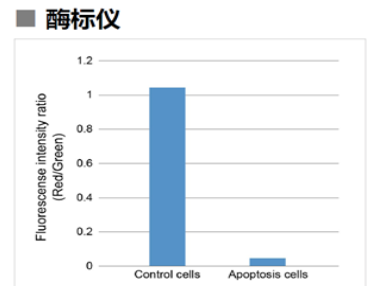
检测条件
Green: Ex 485 nm / Em 525-545 nm
Red : Ex 535 nm / Em 585-605 nm
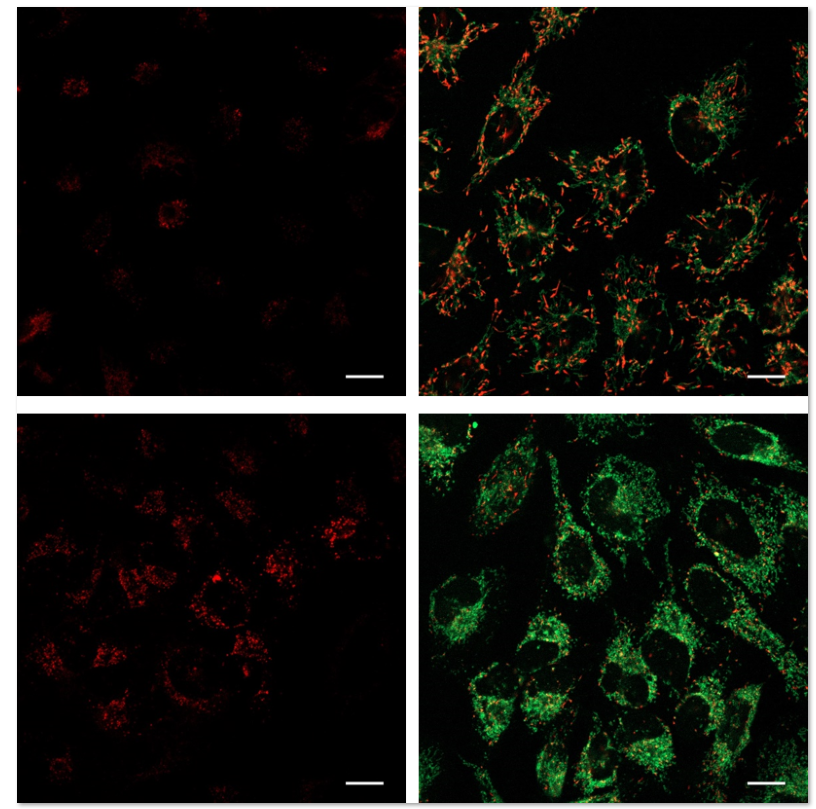
2.诱导自噬的实验例
使用表达Parkin的HeLa细胞,分别使用线粒体自噬试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit: MT09)来观察添加和不添加CCCP(羰基氰化物间氯苯)的线粒体状态的变化。
结果证明在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 而在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光的降低)和线粒体的自噬(Mtphagy染料的荧光的增强)。
<检测条件>
线粒体自噬检测
Ex:561 nm,Em:570-700 nm
线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
实验条件
1.将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
然后过夜培养,收集细胞进行以下检测。
2.自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。荧光显微镜下观察处理后的细胞。
3.线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作溶液使终浓度至2 μmol/l,并将细胞溶液在37℃下孵育30分钟。孵育后将细胞用HBSS洗涤,加入成像缓冲液,在荧光显微镜下观察细胞。
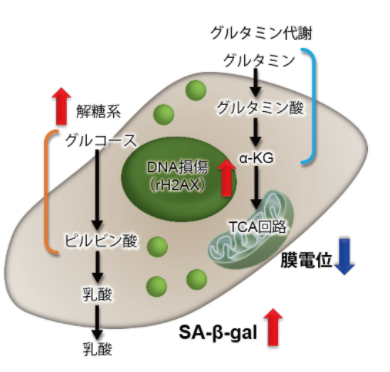
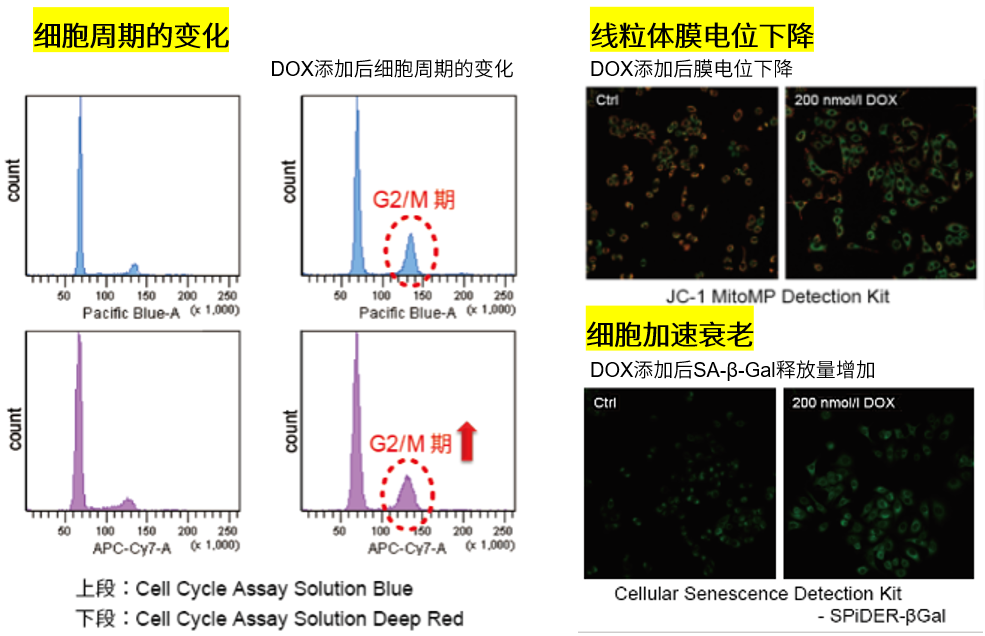
3.线粒体膜电位与细胞周期关联性
将已知能在细胞周期的G2/M期起作用以终止细胞增殖并诱导细胞衰老的阿霉素(DOX)加入A549细胞后,
使用细胞周期检测试剂盒蓝色(产品代码:C549)/深红色(产品代码:C548)后检测。
结果证实了A549细胞的细胞周期确实发生了变化,同时用细胞衰老检测试剂盒–SPiDER-βGal(产品代码:SG03)证实了细胞产生衰老,实验证实了线粒体膜电位会发生变化。
参考文献
| No. | Sample Type | Instrument | Reference |
| 1 | Cell:A549 | Microscope | K. Li, S. Sun, L. Xiao and Z. Zhang, “Bioactivity-guided fractionation of Helicteres angustifolia L. extract and its molecular evidence for tumor suppression”, Front Cell Dev Biol.,2023, doi: 10.3389/fcell.2023.1157172. |
| 2 | Cell:A549 | Flow Cytometer | C. N. D’Alessandro-Gabazza, T. Yasuma, T. Kobayashi, M. Toda1, A. M. Abdel-Hamid, H. Fujimoto, O. Hataji, H. Nakahara, A. Takeshita, K. Nishihama, T. Okano, H. Saiki, Y. Okano, A. Tomaru, V. F. D’Alessandro, M. Shiraishi, A. Mizoguchi, R. Ono, J. Ohtsuka, M. Fukumura, T. Nosaka, X. Mi, D. Shukla, K. Kataoka, Y. Kondoh, M. Hirose, T. Arai, Y. Inoue, Y. Yano, R. I. Mackie, I. Cann and E. C. Gabazza, “Inhibition of lung microbiota-derived proapoptotic peptides ameliorates acute exacerbation of pulmonary fibrosis”, Nat. Comm., 2022, doi:10.1038/s41467-022-29064-3. |
| 3 | Cell:A549, HeLa | Plate reader | J. Yang, L. Liu, Y. Oda, K. Wada, M. Ago, S. Matsuda, M. Hattori, T. Goto, Y. Kawashima, Y. Matsuzaki and T. Taketani,”Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer”, Stem Cell Res Ther., 2023, doi: 10.1186/s13287-023-03274-y. |
| 4 | Cell:ALM | Plate reader | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , “The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.”, Cancer Discov, 2019, 9, |
| 5 | Cell:ARPE-19 | Flow Cytometer/ | J. Hamuro, T. Yamashita, Y. Otsuki, N. Hiramoto, M. Adachi, T. Miyatani, H. Tanaka, M. Ueno, S. Kinoshita and C. Sotozono,”Spatiotemporal Coordination of RPE Cell Quality by Extracellular Vesicle miR-494-3p Via Competitive Interplays With SIRT3 or PTEN”, Invest Ophthalmol Vis Sci., 2023, doi: 10.1167/iovs.64.5.9. |
| 6 | Cell:ARPE-19 | Microscope | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, “Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation”, Int J Nanomedicine., 2020, 15, 3695–3716. |
| 7 | Cell:C2C12, myocytes | – | Z. Jing, T. Iba, H. Naito, P. Xu, J.I. Morishige, N. Nagata, H. Okubo and H.Ando ,”L-carnitine prevents lenvatinib-induced muscle toxicity without impairment of the anti-angiogenic efficacy”, Front Pharmacol., 2023, doi: 10.3389/fphar.2023.1182788. |
| 8 | Cell:C2C12, 3T3L1 | Plate reader | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , “Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate “, Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 9 | Cell:Colon 26 | Microscope | B. Uranbileg, M. Kurano, K. Kano, E. Sakai, J. Arita, K. Hasegawa, T. Nishikawa, S. Ishihara, H. Yamashita, Y. Seto, H. Ikeda, J. Aoki and Y. Yatomi,”Sphingosine 1‐phosphate lyase facilitates cancer progression through converting sphingolipids to glycerophospholipids”, Clin Transl Med., 2022, doi: 10.1002/ctm2.1056. |
| 10 | Tissue: Frozen heart slides |
Microscope | W. Yu, Y. Hu, Z. Liu, K. Guo, D. Ma, M. Peng, Y. Wang, J. Zhang, X. Zhang, P. Wang, J. Zhang, P. Liu and J. Lu,”Sorting nexin 3 exacerbates doxorubicin-induced cardiomyopathy via regulation of TFRC-dependent ferroptosis”, Acta Pharmaceutica Sinica B., 2023, doi: https://doi.org/10.1016/j.apsb.2023.08.016. |
| 11 | Cell:HCE | Microscope | T. Yamashita, K. Asada, M. Ueno, N. Hiramoto, T. Fujita, M. Toda, C. Sotozono, S. Kinoshita and J. Hamuro,”Cellular interplay through extracellular vesicle miR-184 alleviates corneal endothelium degeneration”, Ophthalmol Sci., 2022, doi: 10.1016/j.xops.2022.100212. |
| 12 | Cell:HCE | Microscope | M. Ueno, K Yoshii, T. Yamashita, K. Sonomura, K. Asada, E. Ito, T. Fujita, C. Sotozono, S. Kinoshita and J. Hamuro,”The Interplay Between Metabolites and MicroRNAs in Aqueous Humor to Coordinate Corneal Endothelium Integrity”, Ophthalmol Sci., 2023, doi: 10.1016/j.xops.2023.100299. |
| 13 | Cell:HCE-T | – | W. Otsu, T. Yako, E. Sugisawa, S. Nakamura, H. Tsusaki, N. Umigai, M. Shimazawa and H. Hara,”Crocetin protects against mitochondrial damage induced by UV-A irradiation in corneal epithelial cell line HCE-T cells”, J Pharmacol Sci., 2022, doi: 10.1016/j.jphs.2022.10.005. |
| 14 | Cell:HCE-T | Microscope | K. Ishida, T. Yako, M. Tanaka, W. Otsu, S. Nakamura, M. Shimazawa, H. Tsusaki and H. Hara,”Free-radical scavenger NSP-116 protects the corneal epithelium against UV-A and blue led light exposure”, Biol Pharm Bull., 2021, doi: 10.1248/bpb.b21-00017. |
| 15 | Cell:HepG | Microscope/Spectrophotometer | M. Ikura, K. Furuya, T. Matsuda and T. Ikura,”Impact of Nuclear De Novo NAD+ Synthesis via Histone Dynamics on DNA Repair during Cellular Senescence To Prevent Tumorigenesis”, Mol Cell Biol., 2022, doi: 10.1128/mcb.00379-22. |
| 16 | Cell:hiPSCs, Neurons | Microscope | T. Hara, M. Toyoshima, Y. Hisano, S. Balan, Y. Iwayama, H. Aono,Y. Futamura, H. Osada, Y. Owada and T. Yoshikawa,”Glyoxalase I disruption and external carbonyl stress impair mitochondrial function in human induced pluripotent stem cells and derived neurons”, Translational Psychiatry., 2021, doi: 10.1038/s41398-021-01392-w. |
| 17 | Cell:HSCs | Microscope | Y. Su, S. Lu, C. Hou, K. Ren, M. Wang, X. Liu, S. Zhao and X. Liu ,”Mitigation of liver fibrosis via hepatic stellate cells mitochondrial apoptosis induced by metformin”, International Immunopharmacology., 2022, doi: 10.1016/j.intimp.2022.108683. |
| 18 | Cell:HUVECs | Microscope | D. Ueno, K. Ikeda, E. Yamazaki, A. Katayama, R. Urata and S. Matoba ,”Spermidine improves angiogenic capacity of senescent endothelial cells, and enhances ischemia-induced neovascularization in aged mice”, Sci Rep., 2023, doi: 10.1038/s41598-023-35447-3. |
| 19 | Cell:KYSE30 | Microscope | Q. Luo, X. Wu, P. Zhao, Y. Nan, W. Chang, X. Zhu, D. Su and Z. Liu,”OTUD1 activates caspase‐independent and caspase‐dependent apoptosis by promoting AIF nuclear translocation and MCL1 degradation”, Adv Sci (Weinh)., 2021, doi: 10.1002/advs.202002874. |
| 20 | Cell: Macrophage | Microscope | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, “A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis” , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 21 | Cell:MDA-MB-415, MCF-7 | Microscope | S.Y. Park, K.J. Jeong, A. Poire, D. Zhang, Y.H. Tsang, A.S. Blucher and G.B. Mills ,”Irreversible HER2 inhibitors overcome resistance to the RSL3 ferroptosis inducer in non-HER2 amplified luminal breast cancer”, Cell Death & Disease., 2023, doi: 10.1038/s41419-023-06042-1. |
| 22 | Cell:MIN6 | Plate reader/Microscope | N. Mizusawa, N. Harada, T. Iwata, I. Ohigashi, M. Itakura and K. Yoshimoto,”Identification of protease serine S1 family member 53 as a mitochondrial protein in murine islet beta cells”, Islets., 2022, doi: 10.1080/19382014.2021.1982325. |
| 23 | Cell:MSCs | Flow Cytometer | S.Y. Jo, H.J. Cho and T.M. Kim,”Fenoldopam mesylate enhances the survival of mesenchymal stem cells under oxidative stress and increases the therapeutic function in acute kidney injury”, Cell Transplant., 2023, doi: 10.1177/09636897221147920. |
| 24 | Cell:Neuro-2A | Microscope、Plate reader | Y. Wang, Y. Shinoda, A. Cheng, I. Kawahata and K. Fukunaga,”Epidermal fatty acid-binding protein 5 (FABP5) Involvement in alpha-synuclein-induced mitochondrial injury under oxidative stress”, Biomedicines., 2021, doi: 10.3390/biomedicines9020110. |
| 25 | Cell:Neuron | Microscope | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , “Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons “, Int J Mol Sci., 2019, 20, 5358. |
| 26 | Cell:Neuron | Microscope | A. Fukuda, S. Nakashima,Y. Oda, K. Nishimura, H. Kawashima, H. Kimura, T. Ohgita, E. Kawashita, K. Ishihara, A. Hanaki, M. Okazaki, E. Matsuda, Y. Tanaka, S. Nakamura, T. Matsumoto, S. Akiba, H. Saito, H. Matsuda and K. Takata,”Plantainoside B in Bacopa monniera Binds to Aβ Aggregates Attenuating Neuronal Damage and Memory Deficits Induced by Aβ”, Biol Pharm Bull., 2023, doi: 10.1248/bpb.b22-00797. |
| 27 | Cell:PAECs | Plate reader | T. Sakai, H. Takagaki, N. Yamagiwa, M. Ui, S. Hatta and J. Imai,”Effects of the cytoplasm and mitochondrial specific hydroxyl radical scavengers TA293 and mitoTA293 in bleomycin-induced pulmonary fibrosis model mice”, Antioxidants (Basel)., 2021, doi: 10.3390/antiox10091398. |
| 28 | Cell:PANC-1 | Plate reader | W.A. Naime, A. Kimishima, A. Setiawan, J.R. Fahim, M.A. Fouad, M.S. Kamel and M. Arai,”Mitochondrial Targeting in an Anti-Austerity Approach Involving Bioactive Metabolites Isolated from the Marine-Derived Fungus Aspergillus sp.”, Marine drugs., 2020, doi: 10.3390/md18110555. |
| 29 | Cell:PANC-1, MIAPaca-2 | Microscope | T. Taniai, Y. Shirai,Y. Shimada, R. Hamura, M. Yanagaki, N. Takada, T. Horiuchi, K. Haruki, K. Furukawa, T. Uwagawa, K. Tsuboi, Y. Okamoto, S. Shimada, S. Tanaka, T. Ohashi and T. Ikegami,”Inhibition of acid ceramidase elicits mitochondrial dysfunction and oxidative stress in pancreatic cancer cells”, Cancer Sci., 2021, doi: 10.1111/cas.15123. |
| 30 | Cell:PC | Flow Cytometer | R. Hamura, Y. Shirai,Y. Shimada, N. Saito, T. Taniai, T. Horiuchi, N. Takada, Y. Kanegae, T. Ikegami, T. Ohashi and K. Yanaga ,”Suppression of lysosomal acid alpha‐glucosidase impacts the modulation of transcription factor EB translocation in pancreatic cancer”, Cancer Sci., 2021, doi: 10.1111/cas.14921. |
| 31 | Cell:Porcine oocytes | Microscope | W. Hu, Y. Zhang, D. Wang, T. Yang, J. Qi, Y. Zhang, H. Jiang, J Zhang, B. Sun and S. Liang,”Iron Overload-Induced Ferroptosis Impairs Porcine Oocyte Maturation and Subsequent Embryonic Developmental Competence in vitro”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.673291. |
| 32 | Cell:Porcine oocytes | Microscope | Y. Xiao, B. Yuan, W. Hu, J. Qi, H. Jiang, B. Sun, J. Zhang and S. Liang,”Tributyltin Oxide Exposure During in vitro Maturation Disrupts Oocyte Maturation and Subsequent Embryonic Developmental Competence in Pigs”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.683448. |
| 33 | Cell:RGC-5 | Plate reader | Y. Aoyama, S. Inagaki, K. Aoshima, Y. Iwata, S. Nakamura, H. Hara and M. Shimazawa,”Involvement of endoplasmic reticulum stress in rotenone-induced leber hereditary optic neuropathy model and the discovery of new therapeutic agents”, J Pharmacol Sci . .,2021, doi: 10.1016/j.jphs.2021.07.003. |
| 34 | Cell:SAS,HSC-2 | Plate reader | K. Yamana, J. Inoue, R. Yoshida, J. Sakata, H. Nakashima, H. Arita, S. Kawaguchi, S. Gohara, Y. Nagao, H. Takeshita, M. Maeshiro, R. Liu, Y. Matsuoka, M. Hirayama, K. Kawahara, M. Nagata, A. Hirosue, R. Toya, R. Murakami, Y. Kuwahara, M. Fukumoto and H. Nakayama,”Extracellular vesicles derived from radioresistant oral squamous cell carcinoma cells contribute to the acquisition of radioresistance via the miR‐503‐3p‐BAK axis”, J Extracell Vesicles., 2021, doi: 10.1002/jev2.12169. |
| 35 | Cell:SBC-3 | Flow Cytometer | N. Takahashi, T. Iguchi, M. Kuroda, M. Mishima and Y. Mimaki,”Novel Oleanane-Type Triterpene Glycosides from the Saponaria officinalis L. Seeds and Apoptosis-Inducing Activity via Mitochondria”, Int J Mol Sci., 2022, doi: 10.3390/ijms23042047. |
| 36 | Cell:SH-SY5Y | Microscope | Q. Guo, I. Kawahata, A. Cheng, H. Wang, W. Jia, H. Yoshino and K. Fukunaga,”Fatty acid-binding proteins 3 and 5 are involved in the initiation of mitochondrial damage in ischemic neurons”, Redox Biology., 2023, doi: 10.1016/j.redox.2022.102547. |
| 37 | Cell:SiHa | Microscope | F.F. Gao, J.H. Quan, M.A. Lee, W. Ye, J.M. Yuk, G.H. Cha, I.W. Choi and Y.H. Lee,”Trichomonas vaginalis induces apoptosis via ROS and ER stress response through ER–mitochondria crosstalk in SiHa cells”, Parasites &vectors., 2021, doi: 10.1186/s13071-021-05098-2. |
| 38 | Cell:SU-DHL-2 | Flow Cytometer | Q. Zhao, D. Jiang, X. Sun, Q. Mo, S. Chen, W. Chen, R. Gui and X. Ma,”Biomimetic nanotherapy: core–shell structured nanocomplexes based on the neutrophil membrane for targeted therapy of lymphoma”, J Nanobiotechnology., 2021, doi: 10.1186/s12951-021-00922-4. |
| 39 | Cell:THP-1 | Microscope | W. Zheng, Z. Zhou, Y. Rui, R. Ye, F. Xia, F. Guo, X. Liu, J. Su, M. Lou, and X.F. Yu,”TRAF3 activates STING-mediated suppression of EV-A71 and target of viral evasion”, Signal Transduct Target Ther., 2023, doi: 10.1038/s41392-022-01287-2. |
| 40 | Cell:TSM15 | In Cell Analyzer | M. Honda, F. Shimizu, R. Sato, Y. Mizukami, K. Watanabe, Y. Takeshita, T. Maeda, M. Koga and T. Kanda,”Jo-1 Antibodies From Myositis Induce Complement-Dependent Cytotoxicity and TREM-1 Upregulation in Muscle Endothelial Cells”, Neurol Neuroimmunol Neuroinflamm., 2023, doi: 10.1212/NXI.0000000000200116. |
| 41 | Cell:tumor | Flow Cytometer | H. Wang, X. Rong, G. Zhao, Y. Zhou, Y. Xiao, D. Ma, X. Jin, Y. Wu, Y. Yan, H. Yang, Y. Zhou, M. Qian, C. Niu, X. Hu, D.Q. Li, Q. Liu, Y. Wen, Y.Z. Jiang, C. Zhao and Z.M. Shao ,”The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer”, Cell Metab., 2022, doi: 10.1016/j.cmet.2022.02.010. |
| 42 | Cell:TY10 | In Cell Analyzer | F. Shimizu, R. Ogawa, Y. Mizukami, K. Watanabe, K. Hara, C. Kadono, T. Takahashi, T. Misu, Y. Takeshita, Y. Sano, M. Fujisawa, T. Maeda, I. Nakashima, K. Fujihara and T. Kanda,”GRP78 antibodies are associated with blood-brain barrier breakdown in anti–myelin oligodendrocyte glycoprotein antibody–associated disorder”, Neurol Neuroimmunol Neuroinflamm., 2022, doi: 10.1212/NXI.0000000000001038. |
| 43 | Cell:U2OS, HeLa | Microscope | T. Namba, “BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites “, Sci Adv., 2019, 5, (6), 1386. |
常见问题Q&A
| Q1: 本试剂盒可以检测多少次? |
| A1:大概的使用次数请参考下表: |
| 检测装置 | 容器 | 使用次数 | 液量 |
| 流式细胞仪 | – | 100次 | 0.5 ml/次 |
| 荧光显微镜 荧光酶标仪 |
35 mm dish | 25块板 | 2 ml/孔 |
| 8孔Chamber Slide | 30块板 | 200 μl/孔 | |
| 96孔板 | 5块板 | 100 μl/孔 |
| Q2:在JC-1染色后,可以使用PBS代替HBSS洗涤吗? |
| A2:我们建议使用HBSS来减少对细胞的损伤。如果您手边没有HBSS的话,建议使用培养基洗净。 |
| Q3:可以使用含血清的培养基吗? |
| A3:在清洗细胞和Working Solution中可以使用含血清的培养基。在观察荧光时建议使用Imaging Buffer。如果一定要使用含血清的培养基的话,建议不要加酚红。 |
| Q4:染色后细胞固定或者固定后进行染色可以实现吗? |
| A4:细胞固定操作会使得线粒体去极化,所以染色前后均不能进行细胞固定。 |
|
Q5:处理后的样品与对照组相比较,红和绿两种荧光值都增加(或减少)了,结果该如何解释? |
| A5:请先比较实验组和对照组的荧光比值,两者相比,荧光比越低,线粒体膜电位越低。
用荧光之比进行结果分析的理由。 JC-1由于膜电位依存性地在细胞中积蓄,根据细胞的状态,每个细胞的JC-1的浓度有可能不同。 由于对照组和实验组处理样品的细胞状态不同,JC-1的累积浓度不同。) 另外,在线粒体膜电位较高的状态下,JC-1会聚集在一起,使荧光从绿色转移到红色。 该聚集体的量取决于膜电位的程度,因此可以用红/绿之比来比较样品之间的线粒体膜电位。 <参考文献> 1) Cossarizza, A. et al., Biochem Biophys Res Commun., 1993, 197(1), 40. 2) Perelman, A. et al., Cell Death and Disease, 2012, 3, e430 3) Smiley, S. T. et al., Proc. Nail. Acad. Sci., 1991, 88, 3671. |
关联产品





特点:
● 灵敏度高
● 易上手
● 多种仪器均可检测


产品解说
活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. ROS Assay Kit 活性氧检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.5. Mitophagy Detection Kit 线粒体自噬检测
试剂盒内含

产品概述
细胞中的线粒体作为有氧呼吸产生ATP的主要场所,是体内重要的细胞器之一,常被用于早期细胞毒性、氧化应激、细胞凋亡等研究中1)。线粒体活性的降低与机能失调,已被证实与癌症、衰老、神经退行性疾病 (如阿尔兹海默症、帕金森病等) 等密切相关2)3)。
JC-1是一种被广泛使用的小分子线粒体膜电位探针,依赖于线粒体膜电位在线粒体中聚集,染料伴随聚集过程,荧光从绿色 (530 nm) 变为红色 (590 nm)。当线粒体发生去极化,红/绿荧光强度比值降低。以往的研究者反映,JC-1不易溶于水并有大量沉淀产生。但与其他公司的产品不同,同仁化学研究所研制的JC-1试剂解决了这一问题,避免了沉淀的产生。同时使用试剂盒中配制的成像缓冲液 (Imaging Buffer),可大幅降低荧光背景并在检测过程中保护细胞不受损伤。
当JC-1工作液的浓度为2 μmol/l, 每次用量为100 μl时,可以检测500次。
产品特点
1.为什么要检测线粒体膜电位
线粒体不仅是细胞内产生能量的场所,它还与癌症、衰老、阿尔兹海默症、帕金森等神经变异性疾病密切相关。因此,针对线粒体状态的研究非常重要,其中线粒体膜电位的变化经常被作为重要的指标之一检测。
当线粒体正常、膜电位差保持不变时,JC-1会聚集并发出红色荧光,而当膜电位降低时,JC-1会作为单体存在并发出绿色荧光。红色和绿色荧光强度的变化可以作为检测线粒体状态的指标。

2.初次使用也很容易上手

3.去极化的检测实例
使用去极化剂carbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)对HeLa细胞进行处理,用本试
剂盒进行检测。可以发现与未加药物的细胞相比,加药组细胞的红色荧光明显减少。

实验条件
JC-1浓度: 2 μmol/l in MEM, 染色时间30 min
FCCP浓度:100 μmol/l, FCCP处理时间1 h
检测条件
Green : Ex 488 nm/ Em 500-550 nm;
Red : Ex 561 nm/ Em 560-610 nm;
标尺: 20 μm
操作步骤

实验例
1.诱导凋亡的实验例
1.1 荧光显微镜
通过荧光颜色的改变判断由凋亡导致的线粒体膜电位的变化。

检测条件
Green: Ex 488 nm / Em 500-550 nm
Red : Ex 561 nm / Em 560-610 nm
标尺: 80 μm
1.2 流式细胞仪
定量分析单个细胞的膜电位变化

检测条件
Green: Ex 488 nm / Em 515-545 nm
Red : Ex 488 nm / Em 564-604 nm
1.3 酶标仪
确认孔板中吸光度来判断线粒体膜电位的变化

检测条件
Green: Ex 485 nm / Em 525-545 nm
Red : Ex 535 nm / Em 585-605 nm
2.诱导自噬的实验例
使用表达Parkin的HeLa细胞,分别使用线粒体自噬试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit: MT09)来观察添加和不添加CCCP(羰基氰化物间氯苯)的线粒体状态的变化。
结果证明在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 而在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光的降低)和线粒体的自噬(Mtphagy染料的荧光的增强)。
<检测条件>
线粒体自噬检测
Ex:561 nm,Em:570-700 nm
线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
实验条件
1.将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
然后过夜培养,收集细胞进行以下检测。
2.自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。荧光显微镜下观察处理后的细胞。
3.线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作溶液使终浓度至2 μmol/l,并将细胞溶液在37℃下孵育30分钟。孵育后将细胞用HBSS洗涤,加入成像缓冲液,在荧光显微镜下观察细胞。

3.线粒体膜电位与细胞周期关联性
将已知能在细胞周期的G2/M期起作用以终止细胞增殖并诱导细胞衰老的阿霉素(DOX)加入A549细胞后,
使用细胞周期检测试剂盒蓝色(产品代码:C549)/深红色(产品代码:C548)后检测。
结果证实了A549细胞的细胞周期确实发生了变化,同时用细胞衰老检测试剂盒–SPiDER-βGal(产品代码:SG03)证实了细胞产生衰老,实验证实了线粒体膜电位会发生变化。


参考文献
| No. | Sample Type | Instrument | Reference |
| 1 | Cell:A549 | Microscope | K. Li, S. Sun, L. Xiao and Z. Zhang, “Bioactivity-guided fractionation of Helicteres angustifolia L. extract and its molecular evidence for tumor suppression”, Front Cell Dev Biol.,2023, doi: 10.3389/fcell.2023.1157172. |
| 2 | Cell:A549 | Flow Cytometer | C. N. D’Alessandro-Gabazza, T. Yasuma, T. Kobayashi, M. Toda1, A. M. Abdel-Hamid, H. Fujimoto, O. Hataji, H. Nakahara, A. Takeshita, K. Nishihama, T. Okano, H. Saiki, Y. Okano, A. Tomaru, V. F. D’Alessandro, M. Shiraishi, A. Mizoguchi, R. Ono, J. Ohtsuka, M. Fukumura, T. Nosaka, X. Mi, D. Shukla, K. Kataoka, Y. Kondoh, M. Hirose, T. Arai, Y. Inoue, Y. Yano, R. I. Mackie, I. Cann and E. C. Gabazza, “Inhibition of lung microbiota-derived proapoptotic peptides ameliorates acute exacerbation of pulmonary fibrosis”, Nat. Comm., 2022, doi:10.1038/s41467-022-29064-3. |
| 3 | Cell:A549, HeLa | Plate reader | J. Yang, L. Liu, Y. Oda, K. Wada, M. Ago, S. Matsuda, M. Hattori, T. Goto, Y. Kawashima, Y. Matsuzaki and T. Taketani,”Highly-purified rapidly expanding clones, RECs, are superior for functional-mitochondrial transfer”, Stem Cell Res Ther., 2023, doi: 10.1186/s13287-023-03274-y. |
| 4 | Cell:ALM | Plate reader | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , “The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.”, Cancer Discov, 2019, 9, |
| 5 | Cell:ARPE-19 | Flow Cytometer/ | J. Hamuro, T. Yamashita, Y. Otsuki, N. Hiramoto, M. Adachi, T. Miyatani, H. Tanaka, M. Ueno, S. Kinoshita and C. Sotozono,”Spatiotemporal Coordination of RPE Cell Quality by Extracellular Vesicle miR-494-3p Via Competitive Interplays With SIRT3 or PTEN”, Invest Ophthalmol Vis Sci., 2023, doi: 10.1167/iovs.64.5.9. |
| 6 | Cell:ARPE-19 | Microscope | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, “Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation”, Int J Nanomedicine., 2020, 15, 3695–3716. |
| 7 | Cell:C2C12, myocytes | – | Z. Jing, T. Iba, H. Naito, P. Xu, J.I. Morishige, N. Nagata, H. Okubo and H.Ando ,”L-carnitine prevents lenvatinib-induced muscle toxicity without impairment of the anti-angiogenic efficacy”, Front Pharmacol., 2023, doi: 10.3389/fphar.2023.1182788. |
| 8 | Cell:C2C12, 3T3L1 | Plate reader | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , “Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate “, Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 9 | Cell:Colon 26 | Microscope | B. Uranbileg, M. Kurano, K. Kano, E. Sakai, J. Arita, K. Hasegawa, T. Nishikawa, S. Ishihara, H. Yamashita, Y. Seto, H. Ikeda, J. Aoki and Y. Yatomi,”Sphingosine 1‐phosphate lyase facilitates cancer progression through converting sphingolipids to glycerophospholipids”, Clin Transl Med., 2022, doi: 10.1002/ctm2.1056. |
| 10 | Tissue: Frozen heart slides |
Microscope | W. Yu, Y. Hu, Z. Liu, K. Guo, D. Ma, M. Peng, Y. Wang, J. Zhang, X. Zhang, P. Wang, J. Zhang, P. Liu and J. Lu,”Sorting nexin 3 exacerbates doxorubicin-induced cardiomyopathy via regulation of TFRC-dependent ferroptosis”, Acta Pharmaceutica Sinica B., 2023, doi: https://doi.org/10.1016/j.apsb.2023.08.016. |
| 11 | Cell:HCE | Microscope | T. Yamashita, K. Asada, M. Ueno, N. Hiramoto, T. Fujita, M. Toda, C. Sotozono, S. Kinoshita and J. Hamuro,”Cellular interplay through extracellular vesicle miR-184 alleviates corneal endothelium degeneration”, Ophthalmol Sci., 2022, doi: 10.1016/j.xops.2022.100212. |
| 12 | Cell:HCE | Microscope | M. Ueno, K Yoshii, T. Yamashita, K. Sonomura, K. Asada, E. Ito, T. Fujita, C. Sotozono, S. Kinoshita and J. Hamuro,”The Interplay Between Metabolites and MicroRNAs in Aqueous Humor to Coordinate Corneal Endothelium Integrity”, Ophthalmol Sci., 2023, doi: 10.1016/j.xops.2023.100299. |
| 13 | Cell:HCE-T | – | W. Otsu, T. Yako, E. Sugisawa, S. Nakamura, H. Tsusaki, N. Umigai, M. Shimazawa and H. Hara,”Crocetin protects against mitochondrial damage induced by UV-A irradiation in corneal epithelial cell line HCE-T cells”, J Pharmacol Sci., 2022, doi: 10.1016/j.jphs.2022.10.005. |
| 14 | Cell:HCE-T | Microscope | K. Ishida, T. Yako, M. Tanaka, W. Otsu, S. Nakamura, M. Shimazawa, H. Tsusaki and H. Hara,”Free-radical scavenger NSP-116 protects the corneal epithelium against UV-A and blue led light exposure”, Biol Pharm Bull., 2021, doi: 10.1248/bpb.b21-00017. |
| 15 | Cell:HepG | Microscope/Spectrophotometer | M. Ikura, K. Furuya, T. Matsuda and T. Ikura,”Impact of Nuclear De Novo NAD+ Synthesis via Histone Dynamics on DNA Repair during Cellular Senescence To Prevent Tumorigenesis”, Mol Cell Biol., 2022, doi: 10.1128/mcb.00379-22. |
| 16 | Cell:hiPSCs, Neurons | Microscope | T. Hara, M. Toyoshima, Y. Hisano, S. Balan, Y. Iwayama, H. Aono,Y. Futamura, H. Osada, Y. Owada and T. Yoshikawa,”Glyoxalase I disruption and external carbonyl stress impair mitochondrial function in human induced pluripotent stem cells and derived neurons”, Translational Psychiatry., 2021, doi: 10.1038/s41398-021-01392-w. |
| 17 | Cell:HSCs | Microscope | Y. Su, S. Lu, C. Hou, K. Ren, M. Wang, X. Liu, S. Zhao and X. Liu ,”Mitigation of liver fibrosis via hepatic stellate cells mitochondrial apoptosis induced by metformin”, International Immunopharmacology., 2022, doi: 10.1016/j.intimp.2022.108683. |
| 18 | Cell:HUVECs | Microscope | D. Ueno, K. Ikeda, E. Yamazaki, A. Katayama, R. Urata and S. Matoba ,”Spermidine improves angiogenic capacity of senescent endothelial cells, and enhances ischemia-induced neovascularization in aged mice”, Sci Rep., 2023, doi: 10.1038/s41598-023-35447-3. |
| 19 | Cell:KYSE30 | Microscope | Q. Luo, X. Wu, P. Zhao, Y. Nan, W. Chang, X. Zhu, D. Su and Z. Liu,”OTUD1 activates caspase‐independent and caspase‐dependent apoptosis by promoting AIF nuclear translocation and MCL1 degradation”, Adv Sci (Weinh)., 2021, doi: 10.1002/advs.202002874. |
| 20 | Cell: Macrophage | Microscope | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, “A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis” , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 21 | Cell:MDA-MB-415, MCF-7 | Microscope | S.Y. Park, K.J. Jeong, A. Poire, D. Zhang, Y.H. Tsang, A.S. Blucher and G.B. Mills ,”Irreversible HER2 inhibitors overcome resistance to the RSL3 ferroptosis inducer in non-HER2 amplified luminal breast cancer”, Cell Death & Disease., 2023, doi: 10.1038/s41419-023-06042-1. |
| 22 | Cell:MIN6 | Plate reader/Microscope | N. Mizusawa, N. Harada, T. Iwata, I. Ohigashi, M. Itakura and K. Yoshimoto,”Identification of protease serine S1 family member 53 as a mitochondrial protein in murine islet beta cells”, Islets., 2022, doi: 10.1080/19382014.2021.1982325. |
| 23 | Cell:MSCs | Flow Cytometer | S.Y. Jo, H.J. Cho and T.M. Kim,”Fenoldopam mesylate enhances the survival of mesenchymal stem cells under oxidative stress and increases the therapeutic function in acute kidney injury”, Cell Transplant., 2023, doi: 10.1177/09636897221147920. |
| 24 | Cell:Neuro-2A | Microscope、Plate reader | Y. Wang, Y. Shinoda, A. Cheng, I. Kawahata and K. Fukunaga,”Epidermal fatty acid-binding protein 5 (FABP5) Involvement in alpha-synuclein-induced mitochondrial injury under oxidative stress”, Biomedicines., 2021, doi: 10.3390/biomedicines9020110. |
| 25 | Cell:Neuron | Microscope | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , “Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons “, Int J Mol Sci., 2019, 20, 5358. |
| 26 | Cell:Neuron | Microscope | A. Fukuda, S. Nakashima,Y. Oda, K. Nishimura, H. Kawashima, H. Kimura, T. Ohgita, E. Kawashita, K. Ishihara, A. Hanaki, M. Okazaki, E. Matsuda, Y. Tanaka, S. Nakamura, T. Matsumoto, S. Akiba, H. Saito, H. Matsuda and K. Takata,”Plantainoside B in Bacopa monniera Binds to Aβ Aggregates Attenuating Neuronal Damage and Memory Deficits Induced by Aβ”, Biol Pharm Bull., 2023, doi: 10.1248/bpb.b22-00797. |
| 27 | Cell:PAECs | Plate reader | T. Sakai, H. Takagaki, N. Yamagiwa, M. Ui, S. Hatta and J. Imai,”Effects of the cytoplasm and mitochondrial specific hydroxyl radical scavengers TA293 and mitoTA293 in bleomycin-induced pulmonary fibrosis model mice”, Antioxidants (Basel)., 2021, doi: 10.3390/antiox10091398. |
| 28 | Cell:PANC-1 | Plate reader | W.A. Naime, A. Kimishima, A. Setiawan, J.R. Fahim, M.A. Fouad, M.S. Kamel and M. Arai,”Mitochondrial Targeting in an Anti-Austerity Approach Involving Bioactive Metabolites Isolated from the Marine-Derived Fungus Aspergillus sp.”, Marine drugs., 2020, doi: 10.3390/md18110555. |
| 29 | Cell:PANC-1, MIAPaca-2 | Microscope | T. Taniai, Y. Shirai,Y. Shimada, R. Hamura, M. Yanagaki, N. Takada, T. Horiuchi, K. Haruki, K. Furukawa, T. Uwagawa, K. Tsuboi, Y. Okamoto, S. Shimada, S. Tanaka, T. Ohashi and T. Ikegami,”Inhibition of acid ceramidase elicits mitochondrial dysfunction and oxidative stress in pancreatic cancer cells”, Cancer Sci., 2021, doi: 10.1111/cas.15123. |
| 30 | Cell:PC | Flow Cytometer | R. Hamura, Y. Shirai,Y. Shimada, N. Saito, T. Taniai, T. Horiuchi, N. Takada, Y. Kanegae, T. Ikegami, T. Ohashi and K. Yanaga ,”Suppression of lysosomal acid alpha‐glucosidase impacts the modulation of transcription factor EB translocation in pancreatic cancer”, Cancer Sci., 2021, doi: 10.1111/cas.14921. |
| 31 | Cell:Porcine oocytes | Microscope | W. Hu, Y. Zhang, D. Wang, T. Yang, J. Qi, Y. Zhang, H. Jiang, J Zhang, B. Sun and S. Liang,”Iron Overload-Induced Ferroptosis Impairs Porcine Oocyte Maturation and Subsequent Embryonic Developmental Competence in vitro”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.673291. |
| 32 | Cell:Porcine oocytes | Microscope | Y. Xiao, B. Yuan, W. Hu, J. Qi, H. Jiang, B. Sun, J. Zhang and S. Liang,”Tributyltin Oxide Exposure During in vitro Maturation Disrupts Oocyte Maturation and Subsequent Embryonic Developmental Competence in Pigs”, Front Cell Dev Biol., 2021, doi: 10.3389/fcell.2021.683448. |
| 33 | Cell:RGC-5 | Plate reader | Y. Aoyama, S. Inagaki, K. Aoshima, Y. Iwata, S. Nakamura, H. Hara and M. Shimazawa,”Involvement of endoplasmic reticulum stress in rotenone-induced leber hereditary optic neuropathy model and the discovery of new therapeutic agents”, J Pharmacol Sci . .,2021, doi: 10.1016/j.jphs.2021.07.003. |
| 34 | Cell:SAS,HSC-2 | Plate reader | K. Yamana, J. Inoue, R. Yoshida, J. Sakata, H. Nakashima, H. Arita, S. Kawaguchi, S. Gohara, Y. Nagao, H. Takeshita, M. Maeshiro, R. Liu, Y. Matsuoka, M. Hirayama, K. Kawahara, M. Nagata, A. Hirosue, R. Toya, R. Murakami, Y. Kuwahara, M. Fukumoto and H. Nakayama,”Extracellular vesicles derived from radioresistant oral squamous cell carcinoma cells contribute to the acquisition of radioresistance via the miR‐503‐3p‐BAK axis”, J Extracell Vesicles., 2021, doi: 10.1002/jev2.12169. |
| 35 | Cell:SBC-3 | Flow Cytometer | N. Takahashi, T. Iguchi, M. Kuroda, M. Mishima and Y. Mimaki,”Novel Oleanane-Type Triterpene Glycosides from the Saponaria officinalis L. Seeds and Apoptosis-Inducing Activity via Mitochondria”, Int J Mol Sci., 2022, doi: 10.3390/ijms23042047. |
| 36 | Cell:SH-SY5Y | Microscope | Q. Guo, I. Kawahata, A. Cheng, H. Wang, W. Jia, H. Yoshino and K. Fukunaga,”Fatty acid-binding proteins 3 and 5 are involved in the initiation of mitochondrial damage in ischemic neurons”, Redox Biology., 2023, doi: 10.1016/j.redox.2022.102547. |
| 37 | Cell:SiHa | Microscope | F.F. Gao, J.H. Quan, M.A. Lee, W. Ye, J.M. Yuk, G.H. Cha, I.W. Choi and Y.H. Lee,”Trichomonas vaginalis induces apoptosis via ROS and ER stress response through ER–mitochondria crosstalk in SiHa cells”, Parasites &vectors., 2021, doi: 10.1186/s13071-021-05098-2. |
| 38 | Cell:SU-DHL-2 | Flow Cytometer | Q. Zhao, D. Jiang, X. Sun, Q. Mo, S. Chen, W. Chen, R. Gui and X. Ma,”Biomimetic nanotherapy: core–shell structured nanocomplexes based on the neutrophil membrane for targeted therapy of lymphoma”, J Nanobiotechnology., 2021, doi: 10.1186/s12951-021-00922-4. |
| 39 | Cell:THP-1 | Microscope | W. Zheng, Z. Zhou, Y. Rui, R. Ye, F. Xia, F. Guo, X. Liu, J. Su, M. Lou, and X.F. Yu,”TRAF3 activates STING-mediated suppression of EV-A71 and target of viral evasion”, Signal Transduct Target Ther., 2023, doi: 10.1038/s41392-022-01287-2. |
| 40 | Cell:TSM15 | In Cell Analyzer | M. Honda, F. Shimizu, R. Sato, Y. Mizukami, K. Watanabe, Y. Takeshita, T. Maeda, M. Koga and T. Kanda,”Jo-1 Antibodies From Myositis Induce Complement-Dependent Cytotoxicity and TREM-1 Upregulation in Muscle Endothelial Cells”, Neurol Neuroimmunol Neuroinflamm., 2023, doi: 10.1212/NXI.0000000000200116. |
| 41 | Cell:tumor | Flow Cytometer | H. Wang, X. Rong, G. Zhao, Y. Zhou, Y. Xiao, D. Ma, X. Jin, Y. Wu, Y. Yan, H. Yang, Y. Zhou, M. Qian, C. Niu, X. Hu, D.Q. Li, Q. Liu, Y. Wen, Y.Z. Jiang, C. Zhao and Z.M. Shao ,”The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer”, Cell Metab., 2022, doi: 10.1016/j.cmet.2022.02.010. |
| 42 | Cell:TY10 | In Cell Analyzer | F. Shimizu, R. Ogawa, Y. Mizukami, K. Watanabe, K. Hara, C. Kadono, T. Takahashi, T. Misu, Y. Takeshita, Y. Sano, M. Fujisawa, T. Maeda, I. Nakashima, K. Fujihara and T. Kanda,”GRP78 antibodies are associated with blood-brain barrier breakdown in anti–myelin oligodendrocyte glycoprotein antibody–associated disorder”, Neurol Neuroimmunol Neuroinflamm., 2022, doi: 10.1212/NXI.0000000000001038. |
| 43 | Cell:U2OS, HeLa | Microscope | T. Namba, “BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites “, Sci Adv., 2019, 5, (6), 1386. |
常见问题Q&A
| Q1: 本试剂盒可以检测多少次? |
| A1:大概的使用次数请参考下表: |
| 检测装置 | 容器 | 使用次数 | 液量 |
| 流式细胞仪 | – | 100次 | 0.5 ml/次 |
| 荧光显微镜 荧光酶标仪 |
35 mm dish | 25块板 | 2 ml/孔 |
| 8孔Chamber Slide | 30块板 | 200 μl/孔 | |
| 96孔板 | 5块板 | 100 μl/孔 |
| Q2:在JC-1染色后,可以使用PBS代替HBSS洗涤吗? |
| A2:我们建议使用HBSS来减少对细胞的损伤。如果您手边没有HBSS的话,建议使用培养基洗净。 |
| Q3:可以使用含血清的培养基吗? |
| A3:在清洗细胞和Working Solution中可以使用含血清的培养基。在观察荧光时建议使用Imaging Buffer。如果一定要使用含血清的培养基的话,建议不要加酚红。 |
| Q4:染色后细胞固定或者固定后进行染色可以实现吗? |
| A4:细胞固定操作会使得线粒体去极化,所以染色前后均不能进行细胞固定。 |
|
Q5:处理后的样品与对照组相比较,红和绿两种荧光值都增加(或减少)了,结果该如何解释? |
| A5:请先比较实验组和对照组的荧光比值,两者相比,荧光比越低,线粒体膜电位越低。
用荧光之比进行结果分析的理由。 JC-1由于膜电位依存性地在细胞中积蓄,根据细胞的状态,每个细胞的JC-1的浓度有可能不同。 由于对照组和实验组处理样品的细胞状态不同,JC-1的累积浓度不同。) 另外,在线粒体膜电位较高的状态下,JC-1会聚集在一起,使荧光从绿色转移到红色。 该聚集体的量取决于膜电位的程度,因此可以用红/绿之比来比较样品之间的线粒体膜电位。 <参考文献> 1) Cossarizza, A. et al., Biochem Biophys Res Commun., 1993, 197(1), 40. 2) Perelman, A. et al., Cell Death and Disease, 2012, 3, e430 3) Smiley, S. T. et al., Proc. Nail. Acad. Sci., 1991, 88, 3671. |
关联产品





特点:
● 固定后仍可检测
● 荧光滞留性强
● 灵敏度高


产品解说
产品概述
线粒体利用氧气合成ATP,从而产生细胞所需的能量,是重要的细胞器之一。线粒体活性低下和机能障碍与癌症、老化、阿尔茨海默病、帕金森病等神经变性疾病密切相关。因此,线粒体膜电位(MMP)作为线粒体相关疾病的一个有希望的靶点已被广泛研究。
产品特点
解决传统试剂的三个问题
观察线粒体膜电位时,使用JC-1、TMRE、TMRM,但由于PFA不可固定、容易淬灭,数据的再现性等问题。MT-1 MitoMP Detection Kit是克服了这些问题的线粒体膜电位的检测试剂。
并且,通过本试剂盒中包含的Imaging Buffer,可以在抑制了荧光背景和对细胞的损伤的状态下进行观察。
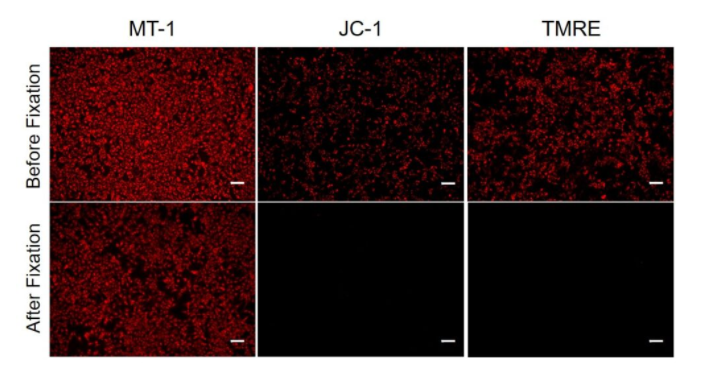
①固定后也可检测
由于微小的细胞状态的变化,也会造成线粒体膜电位发生变化,所以取得数据的重现性需要特别注意。通用的线粒体膜电位检测试剂(JC-1、TMRE)如果对细胞进行固定处理的话会失去荧光,所以需要使用活细胞进行迅速的测定。MT-1即使进行染色后进行PFA固定操作,也能保持荧光,因此可以进行高重复性的实验。
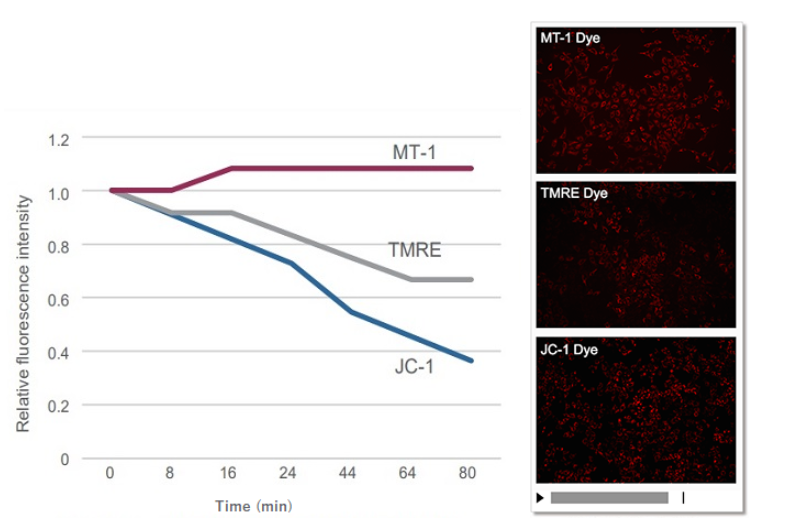
②可监控
没有进行药物刺激的细胞通过各种试剂染色,确认了荧光强度的变化。结果,JC-1和TMRE在染色后约10分钟左右荧光强度下降,MT-1仍保持了一定的荧光强度
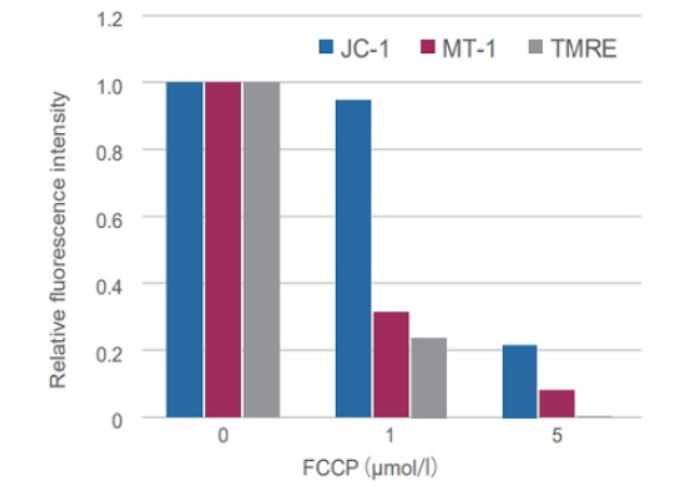
③高灵敏度
线粒体膜电位的细微变化在JC-1中有难以检测的情况,在这种情况下,使用四甲基罗丹明乙酯(TMRE)监测MMP。MT-1可提供与TMRE同等的检测灵敏度。
与各种试剂的比较
| Features | Sensitivity | Fixation | Monitoring | Fluorescence change (upon loss of mitochondrial membrane potential) | Detection (ex/em) |
|
| JC-1 (JC-1 MitoMP Detection Kit) |
Recomended for starting-up | ✓ | Color change from red to green | Green: 450-490 nm / 500-550 nm Red: 530-560 nm / 570-640 nm
|
||
| MT-1 (MT-1 MitoMP Detection Kit) |
Recommended for more detailed analysis | ✓ (High) |
✓ | ✓ | Decrease in fluorescence intensity | 530-560 nm / 570-640 nm |
| TMRE | Widely used | ✓ (High) |
Decrease in fluorescence intensity | 530-560 nm / 570-640 nm |
实验例
1.通过去极化的实验例
通过线粒体去极化剂的cyanide-p-trifluoromethoxyphenylhydrazone (FCCP)处理HeLa细胞,用该试剂观察膜电位的变化。
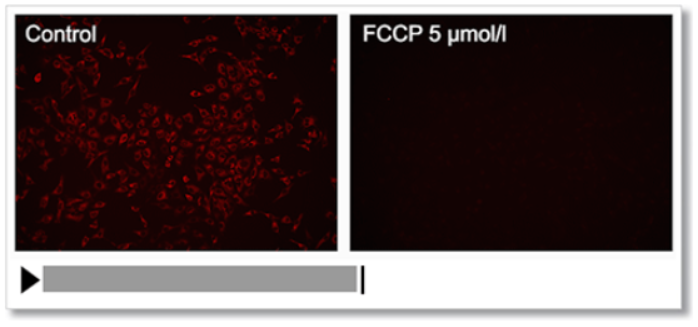
结果,确认了FCCP处理的细胞线粒体膜电位下降的情况。
2.凋亡诱导细胞线粒体膜电位的变化
预先在MT-1中染色的HL60细胞中添加Etoposide,诱导凋亡后,与Annexin V、FITC Conjugate一同染色,并通过流式细胞仪检测。
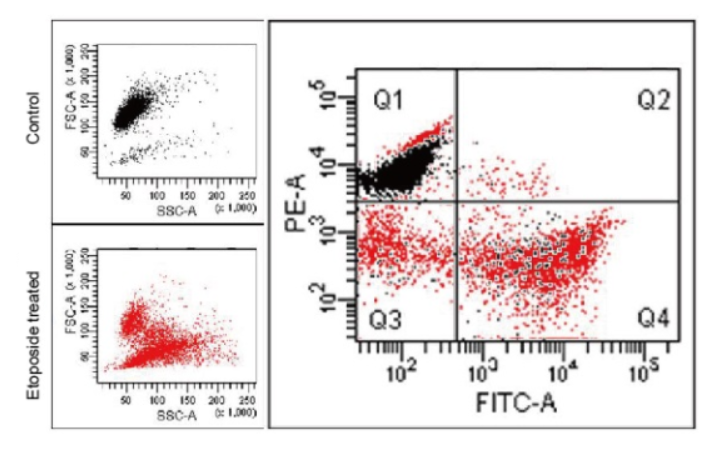
结果发现Annexin V-FITC产生的荧光强度变化(绿色荧光强度的增加)确认了凋亡的发生,以及从MT-1产生的荧光强度变化(红色荧光强度的降低)发现了线粒体膜电位的变化。
3.同时评估线粒体超氧化物和膜电位
用 HBSS 冲洗 HeLa 细胞后,用 MT-1 线粒体氧化酶检测试剂盒和线粒体超氧化物检测染料((mtSOX Deep Red: MT14)共同染色,同时观察线粒体 ROS 和膜电位的产生情况。因此,线粒体膜电位的降低和线粒体 ROS 的产生是同时观察到的。
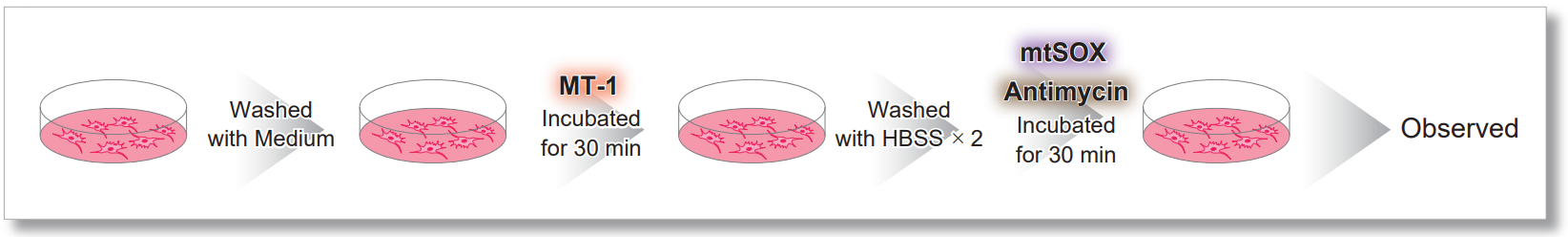
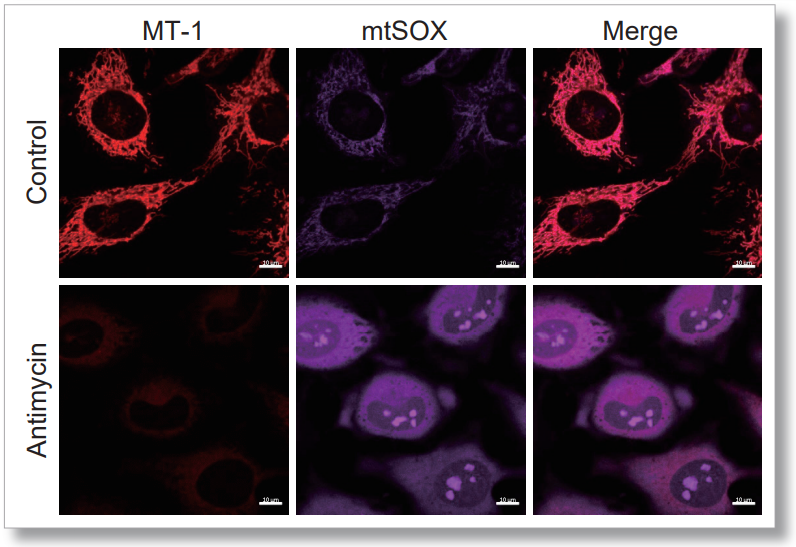
<成像条件>(共聚焦显微镜)
MT-1: Ex=561, Em=560-600 nm
mtSOX: Ex=633 nm, Em=640-700 nm
Scale bar: 10 μm
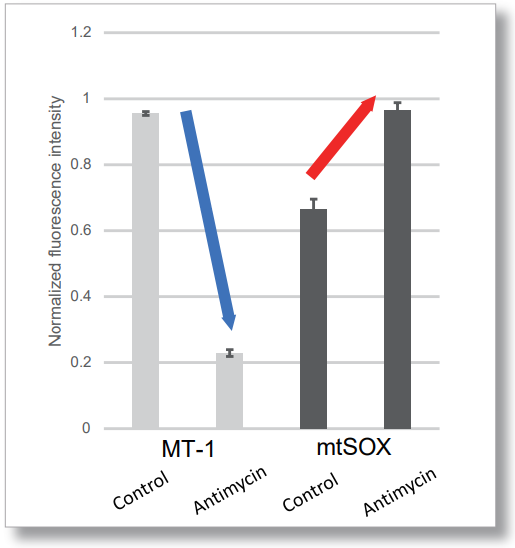
<检测条件>(酶标仪)Tecan,Infinite M200 Pro
MT-1: Ex=540-550 nm, Em=590-610 nm (Gain=200)
mtSOX: Ex=545-555 nm, Em = 665-685 nm
常见问题Q&A
| Q1:使用荧光显微镜检测时需要注意什么? |
| A1:请尽量减少激发光照射时间并提高检测灵敏度。
细胞长期暴露于激发光内可能导致细胞损伤和荧光染料降解,请优化检测时间。 |
| Q2:MT-1检测后可以固定吗? |
| A2:应使用4%多聚甲醛(PFA)固定,且不能与(Triton X-100、NP-40等)一起使用,因为这可能导致染泄漏。 |
| Q3:固定后可以对细胞染色吗? |
| A3:由于MT-1在线粒体中的积累取决于线粒体膜电位,因此固定后不适用于染色。 |
| Q4:是否需要做阳性对照? |
| A4:作为阳性对照,可在技术手册中找到使用FCCP(羰基氰化物-对三氟甲氧基苯腙)的实验例。 |
|
Q5:优化染色条件时,应使用何种浓度的MT-1染料 |
|
A5:MT-1染料的浓度建议稀释1000倍。但在优化染色条件时,请参考以下内容。 <荧光强度弱> 请优化以下浓度:稀释500-1000倍。 <观察到非特异性吸附> 请优化以下浓度:稀释1000至2000倍。 |
| Q6:我可以使用缓冲液来制备MT-1工作溶液吗? |
| A6:可以使用Hanks的HEPES和HBSS。也可以使用MEM、RPMI和含10%FBS的MEM制备。 |
| Q7:添加MT-1工作液后,可以不清洗直接上机检测吗? |
| A7:染色后,无需清洗即可观察样品。但我们不建议在不清洗的情况下长期观察它们,因为它们可能具有细胞毒性。
我们建议去除上清液并用培养基替换。 |
| Q8:MT-1染色后,是否可以用PBS代替HBSS来清洗? |
| A8:我们建议使用HBSS来减少细胞损伤。如果您没有HBSS,我们建议使用培养基来代替清洗。 |
参考文献
| No. | Sample | Instrument | Reference |
|---|---|---|---|
| 1 | STHdh Cells | Microscope | N. Okada, T. Yako, S. Nakamura, M. Shimazawa, H. Hara, “Reduced mitochondrial complex II activity enhances cell death via intracellular reactive oxygen species in STHdhQ111 striatal neurons Q1 with mutant huntingtin”, J. Pharmacol. Sci., 2021, doi:10.1016/j.jphs.2021.09.001. |
| 2 | Panc-1 Cells | Microscope | N. Okuni, Y. Honma, T. Urano, K. Tamura, “Romidepsin and tamoxifen cooperatively induce senescence of pancreatic cancer cells through downregulation of FOXM1 expression and induction of reactive oxygen species/lipid peroxidation”, Mol. Biol. Rep., 2022, doi:10.1007/s11033-022-07192-9. |
| 3 | BM Cells | Microscope | Y. Aoyagi, Y. Hayashi, Y. Harada, K. Choi, N. Matsumura, D. Sadato, Y. Maemoto, A. Ito, S. Yanagi, D. Starczynowski, H. Harada, “Mitochondrial Fragmentation Triggers Ineffective Hematopoiesis in Myelodysplastic Syndromes”, Cancer Discovery, 2022, doi:10.1158/2159-8290.CD-21-0032. |
| 4 | Flies indirect flight muscle Cells | Microscope | N. Nozawa, M. Noguchi, K. Shinno, M. Tajima, S. Aizawa, T. Saito, A. Asada, T. Ishii, M. Ishizuka, K. Iijima and K. Ando, “5-Aminolevulinic acid and sodium ferrous citrate ameliorate muscle aging and extend healthspan in Drosophila”, FEBS Open Bio, 2022, doi:10.1002/2211-5463.13338. |
| 5 | HBME Cells | Microscope | Y. Sakai, M. Taguchi, Y. Morikawa, H. Miyazono, K. Suenami, Y. Ochiai, E. Yanase, T. Takayama, A. Ikari, T. Matsunaga, “Apoptotic mechanism in human brain microvascular endothelial cells triggered by 40-iodo-α-pyrrolidinononanophenone: Contribution of decrease in antioxidant properties”, Toxicol. Lett., 2022, doi:10.1016/j.toxlet.2021.11.018. |
| 6 | MIN6-M9 Cells | Microscope | R. Inoe, T. Tsuno, Y. Togashi, T. Okuyama, A. Sato, K. Nishiyama, M. Kyohara, J. Li, S. Fukushima, T. Kin, D. Miyashita, Y. Shiba, Y. Atobe, H. Kiyonari, K. Bando, A. S. Shapiro, K. Funakoshi, R. N. Kulkarni, Y. Terauchi, and J. Shirakawa, “Uncoupling protein 2 and aldolase B impact insulin release by modulating mitochondrial function and Ca2+ release from the ER”, 2022, iScience, doi:10.1016/j.isci.2022.104603. |
| 7 | SH-SY5Y Cells | Flow Cytometer | M. Hashimoto, M. Fujimoto, K. Konno, M. L. Lee, Y. Yamada, K. Yamashita, C. Toda, M. Tomura, M. Watanabe, O. Inanami and H. Kitamura, “Ubiquitin-Specific Protease 2 in the Ventromedial Hypothalamus Modifies Blood Glucose Levels by Controlling Sympathetic Nervous Activation”, J. Neurosci., 2022, doi:10.1523/JNEUROSCI.2504-21.2022. |
| 8 | Fibroblasts, ciBAs | Microscope | Y. Takeda and P. Dai, “Chronic Fatty Acid Depletion Induces Uncoupling Protein 1 (UCP1) Expression to Coordinate Mitochondrial Inducible Proton Leak in a Human-Brown-Adipocyte Model”, 2022, doi:10.3390/cells11132038. |
| 9 | Sperm cells from C. osakensis queens | Microscope | A. Gotoh, M. Takeshima and K Mizutani, “Near-anoxia induces immobilization and sustains viability of sperm stored in ant queens”, Sci. Rep., 2023, doi:10.1038/s41598-023-29705-7. |
| 10 | Nucleus Pulposus Cells | Microscope | K. Suyama, D. Sakai, S. Hayashi, N. Qu, H. Terayama, D. Kiyoshima, K. Nagahori and M. Watanabe, “Bag-1 Protects Nucleus Pulposus Cells from Oxidative Stress by Interacting with HSP70”, Biomedicines, 2023, doi:10.3390/biomedicines11030863. |
| 11 | HL60 Cells, KG1a Cells | Flow Cytometer | K. Kamachi, H. Ureshino, T. Watanabe, N. Y. Sakai, Y. F. Kurahashi, K. Kawasoe, T. Hoshiko, Y. Yamamoto, Y. Kurahashi, and S. Kimura , “Combination of a New Oral Demethylating Agent, OR2100, and Venetoclax for Treatment of Acute Myeloid Leukemia”, Cancer Res Commun., 2023, doi:10.1158/2767-9764.CRC-22-0259. |
| 12 | RAW264 Cells | Microscope | H. Gu, Y. Zhu, J. Yang, R. Jiang, Y. Deng, A. Li, Y. Fang, Q. Wu, H. Tu, H. Chang, J. Wen and X. Jiang, “Liver-Inspired Polyetherketoneketone Scaffolds Simulate Regenerative Signals and Mobilize Anti-Inflammatory Reserves to Reprogram Macrophage Metabolism for Boosted Osteoporotic Osseointegration”, Adv sci, 2023, doi:10.1002/advs.202302136. |
关联产品





特点:
● 荧光持续时间长
● 可在含血清培养基中染色
● 荧光显微镜、流式细胞仪均可检测


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Mitophagy Detection Kit 线粒体自噬检测
NO.2. FerroOrange 细胞亚铁离子检测
NO.3. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.4. Cellstain- Hoechst 33342 solution 细胞核染色
NO.5. Liperfluo 细胞脂质过氧化物检测
产品概述
细胞内有各种各样的细胞器,承担着各种各样必须的生命活动。其中线粒体不仅是通过氧化磷酸化反应生成ATP 的场所,它还与癌症、细胞衰老、阿尔兹海默症、帕金森综合症等神经退行性疾病紧密相关,因此它是细胞内最重要的细胞器之一。
在对线粒体的形态和动态进行观察以及定量检测时,通常使用小分子荧光探针标记和荧光蛋白的基因转染两种方法。荧光蛋白的基因转染存在转染效率不稳定等情况,因此操作简便的小分子荧光探针的使用更为广泛。现在市面上销售的小分子荧光探针中,多为含有氯甲基的探针,该探针存在观察时间短,染色时不能使用含血清的培养基,染色后荧光背景高等问题。MitoBright LT 荧光探针克服了这些问题,可在线粒体内稳定存在一天以上,条件合适的情况下可达到一周。而且与含有氯甲基的探针相比,染色后的荧光强度更高。本品直接采用DMSO 溶液包装,可快速方便的进行线粒体染色。荧光颜色有Green, Red, Deep Red 等多种选择,可满足多重染色等各种各样的实验要求。
产品特点
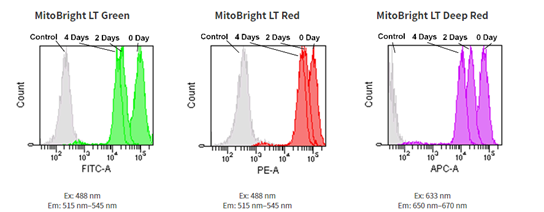
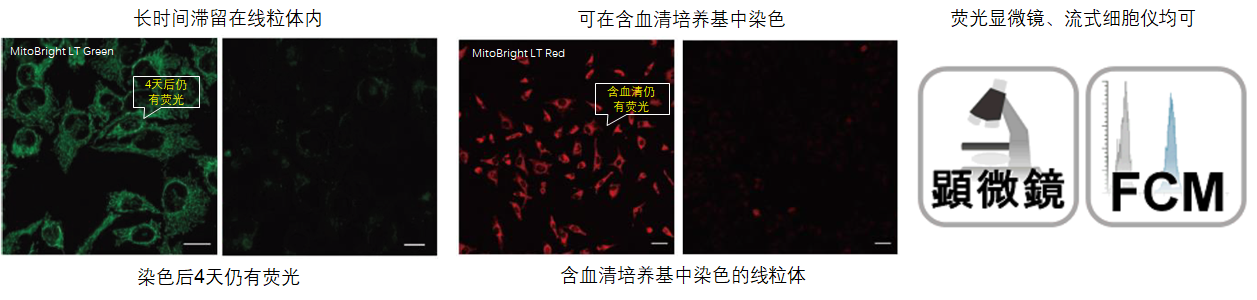
1.可长时间在细胞内存在
用HBSS 清洗 HeLa 细胞后,分别用 MitoBright LT 和其他公司的试剂进行染色,更换含血清的培养基,培养 4 天后观察线粒体染色情况。其他公司的染色试剂在 4 天后荧光强度大幅降低,而 MitoBrightLT 依然维持着高荧光强度,并且在染色 7 日后依然可以观察到荧光。
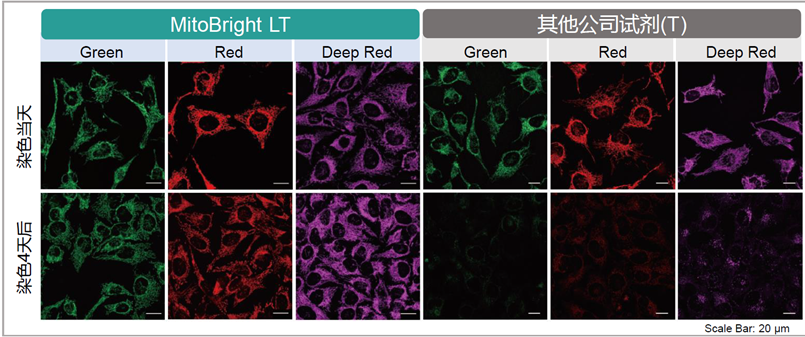
<检测条件>
MitoBright LT Green 、(T 公司)Green:Ex:488 nm/Em:500–560 nm
MitoBright LT Red 、(T 公司)Red:Ex 561:nm/Em:560–620 nm
MitoBright LT Deep Red 、(T 公司)Deep Red:Ex:640 nm/Em:650–700 nm
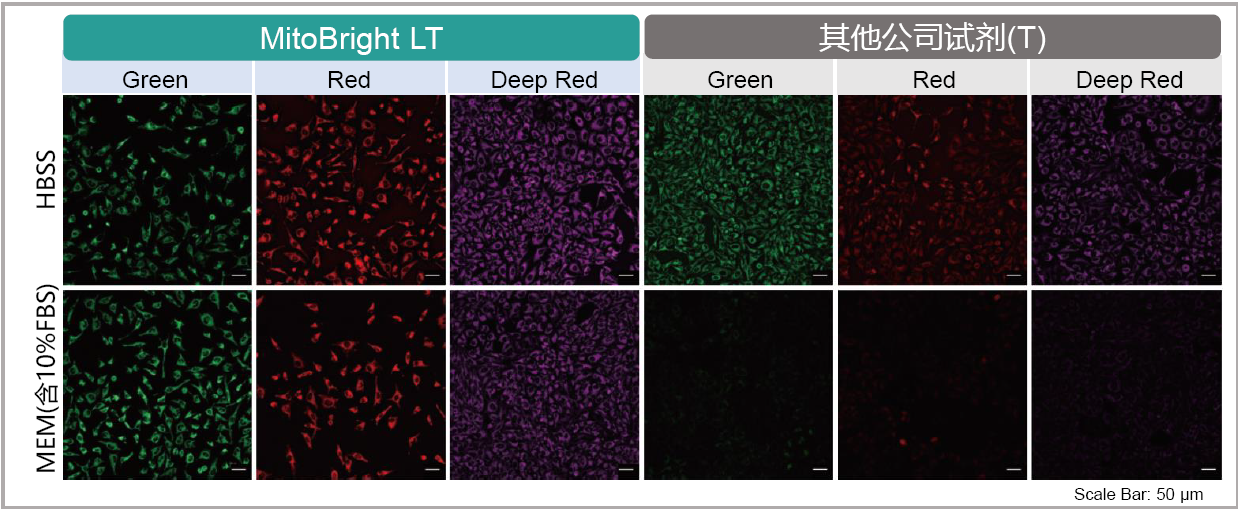
2.可以使用含血清培养基
用MitoBright LT 和其他公司试剂,分别用含有血清和不含血清的培养基染色。其他公司试剂在含有血清的培养基染色时,荧光明显减弱,而 MitoBright LT 在含有血清的培养基条件下,荧光没有减弱,可明显观察到线粒体的染色情况。
3.线粒体的分裂和融合
用100 nmol/l MitoBrightLT Red将HeLa细胞染色后,换入无血清培养基30分钟后观察线粒体形态。
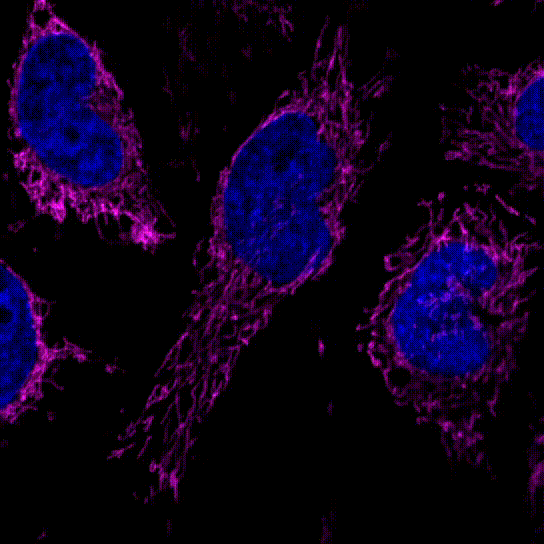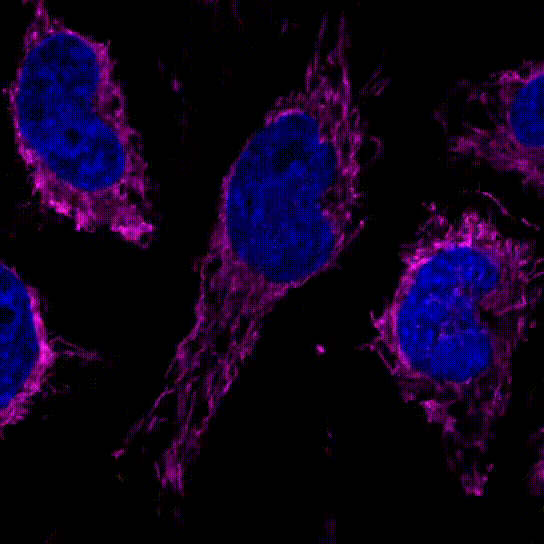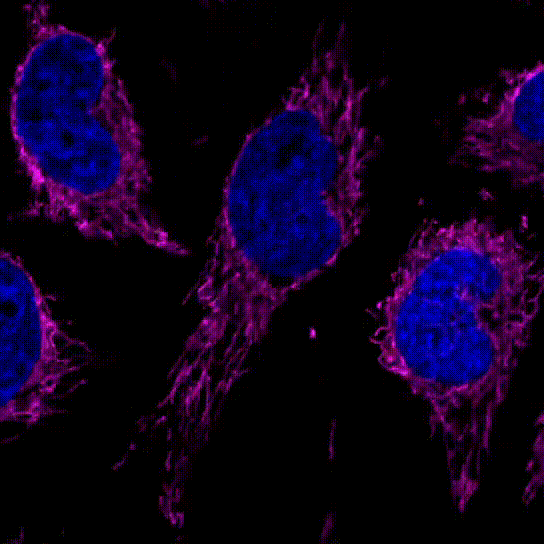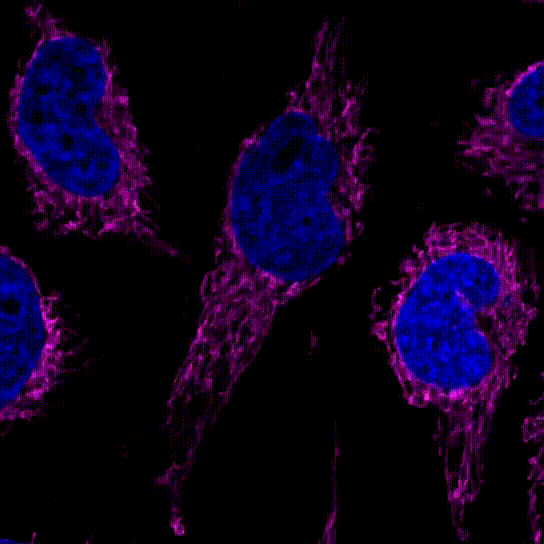
<检测仪器>
共聚焦显微镜,放大倍率:63倍
<检测条件>
Ex:561 nm/Em:560–620 nm
实验例
用流式细胞仪检测
1. 用RPMI 培养基(10% fetal bovine serum, 1% penicillin-streptomycin)配制Jurkat 细胞悬液(3.2×105cell/mL)播种于5 cm 培养皿,37℃,5% CO2 培养箱内培养一晚。
2. 去除培养基,加入MitoBright LT Working Solution (0.1 μmol/L, 5 mL), 37℃培养30 分钟。
3. 去除溶液,用 5mL 的PRPMI 培养基清洗细胞2 次。
4. 添加RPMI 培养基,持续培养细胞,每隔2 天用流式细胞仪检测。
在胶原蛋白涂覆玻璃板上观察线粒体荧光成像
胶原蛋白涂覆玻璃板通常用于线粒体形态的高倍放大观察。
现有的线粒体染色试剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以在不受背景影响的情况下清楚地对线粒体进行染色。
<染色条件>
将HeLa细胞接种在胶原蛋白涂覆玻璃板上,培养24小时,提取上清液并用HBSS洗涤。
加入100nmol / L的MitoBright LT Green工作溶液,培养30分钟后,提取上清液并用HBSS洗涤后用荧光显微镜观察。
<检测条件>
Ex488 nm,Em 500-560 nm
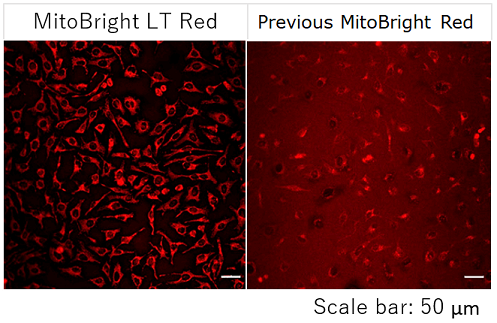
<结果>
现有的线粒体染色剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以清晰地对线粒体染色,而不受背景影响。
通过超分辨率激光显微镜(STED)观察线粒体内部构造
线粒体疾病致突变的Cybrid细胞用MitoBright-LT-Deep Red染色,用超分辨激光显微镜(STED)观察,证实线粒体嵴结构异常。
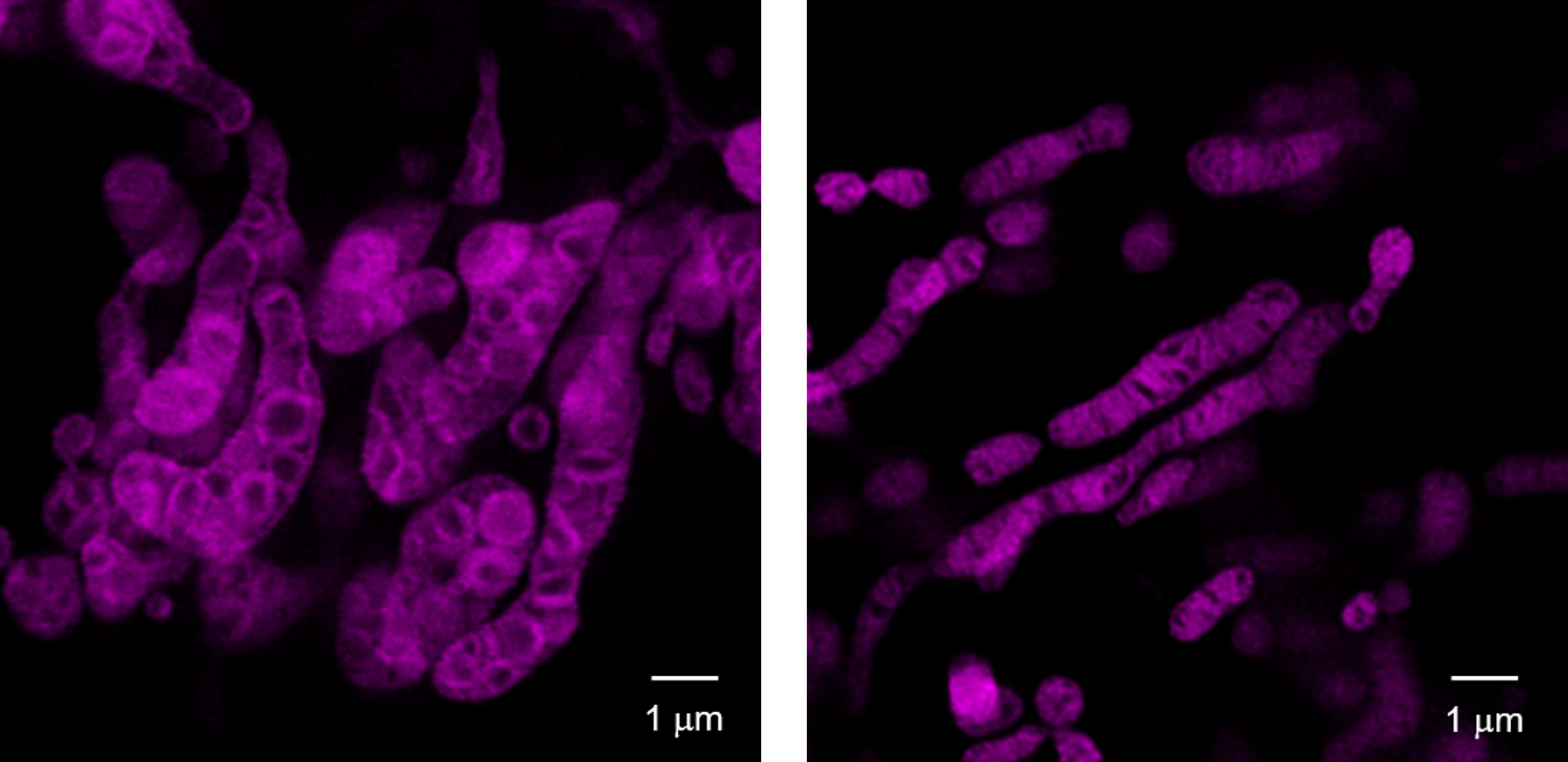
<实验条件>
色素:MitoBrightLT Deep Red(100nmol/l)
仪器:Leica超分辨率激光显微镜TCS SP8 STED 3X
Ex. 640 nm / Em. 650-700 nm
STED激光:775nm
<实验步骤>
1将细胞接种在玻璃培养皿中,培养2天(37℃,5% CO2)。
2去除培养基后,加入使用L-15培养基(含10%FBS)制备的MitoBrightLT Deep Red(100nmol/l)工作液。
3孵育45分钟(37度,5% CO2)。
4去除上清液,用HBSS清洗两次。
5加入L-15培养基(含10%FBS),通过超分辨率激光显微镜(Leica TCS SP8 STED)进行观察。
以上数据由东京都老年学研究所衰老控制研究小组的大澤郁朗博士和藤田泰典博士友情提供。
产品论文
同仁化学研究所开发的线粒体长效染色荧光探针MitoBright LT系列在世界范围内广受科研人员的好评。在上市后的很短时间内,就出现了多篇使用MitoBright LT系列探针的论文,下面收集整理了部分的论文,其中红色字体标记的是使用本产品标记线粒体后,长时间(最长至5天)观察线粒体动态的报道,供感兴趣的科研人员参考。
| 产品名 | 检测样品 | 染色后的 观察时间 |
检测仪器 | 发表期刊(含原文链接) | 影响因子 |
| MitoBright LT Green | 细胞 (U251) | 立即 | 荧光显微镜 | Pharmaceuticals | 4.286 |
| MitoBright LT Green | 酵母 (Lipomyces starkeyi) | 立即 | 荧光显微镜 | Genes to Cells | 1.655 |
| MitoBright LT Green | 细胞 (HeLa) | 立即 | 荧光酶标仪 | Biomaterials | 10.317 |
| MitoBright LT Green | 细胞 (Naive CD4+ T cells) | 立即 | 荧光显微镜 | Cell Reports | 9.423 |
| MitoBright LT Green | 细胞 (CT26) | 立即 | 流式细胞仪 | Journal of Radiation Research | 2.841 |
| MitoBright LT Green | 细胞 (C2C12) | 5 天 | 荧光显微镜 | Polymers | 4.329 |
| MitoBright LT Green | 细胞 (BMM) | 36 小时 or
3 天 |
荧光显微镜/ 流式细胞仪 |
JCI Insights | 8.315 |
| MitoBright LT Green | 细胞 (mouse erythrocytes) | 立即 | 荧光显微镜 | Front. Cell. Infect. Microbiol. | 5.293 |
| MitoBright LT Red | 细胞 (SH-SY5Y) | 立即 | 荧光显微镜 | Free Radical Biol. Med. | 7.376 |
| MitoBright LT Red | 细胞 (MRC-5) | 立即 | 荧光显微镜 | The FEBS Journal | 5.542 |
| MitoBright LT Red | 细胞 (A11 cells/ P29 cells) | 3 天 | 荧光显微镜 | BMC Mol. Cell Biol. | 5.293 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7; HCT-116 ) | 立即 | 荧光显微镜 | Small | 13.281 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7 ) | 8 小时 | 荧光显微镜 | Advanced Therapeutics | – |
| MitoBright LT Deep Red | 细胞 (4T1) | 24 小时 | 荧光显微镜 | Advanced Functional Materials | 18.808 |
| MitoBright LT Deep Red | 细胞 (SW982) | 立即 | 荧光显微镜 | Gene | 3.368 |
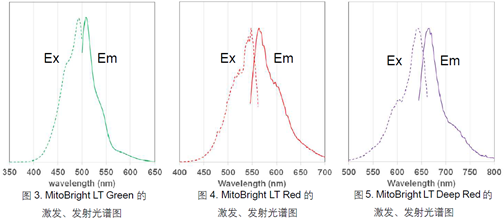
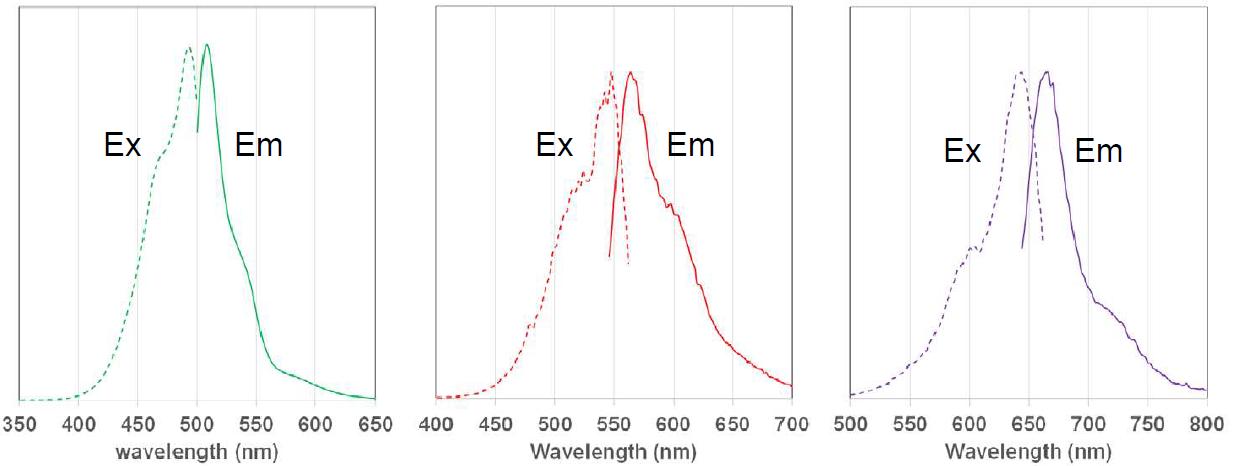
荧光特性
MitoBright LT 染料的荧光特性
常见问题Q&A
| Q1:MitoBright LT需要用DMSO溶液配制,反复冻结融化也不会影响试剂质量吗? |
| A1:我们已经确认可以使用冻融30次的溶液进行染色。 |
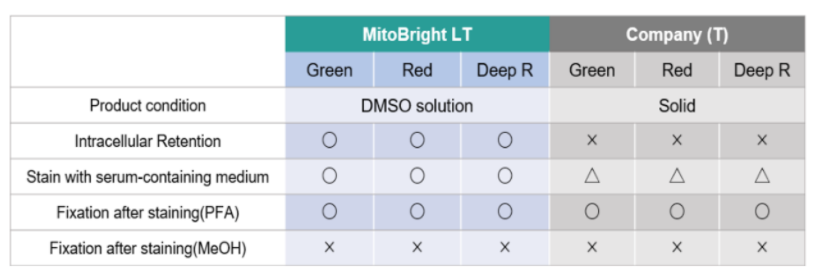
| Q2:MitoBright LT和MitoBright的区别。 |
| A2:MitoBright LT是MitoBright具有更强细胞内滞留性性能的产品。另外MitoBright LT是溶于DMSO的产品,可以立即使用,而无需准备染色溶液。 |
|
Q3:用MitoBright LT系列染色后再去极化是否会影响染色效果? |
| A3:我们确认了去极化和细胞种类对于染色效果的影响,MitoBright LT的每种染料都有不同程度的影响。作为参考,本公司将HeLa细胞用不同的MitoBrightLT试剂进行染色,在以下条件下进行去极化处理,观察荧光染色的变化。
<染色条件> HeLa细胞用MitoBright LT(100 μmol/l,孵育30分钟)染色,并用HBSS洗涤。 用FCCP(100 μmol/l,孵育60分钟)处理,用HBSS洗涤2次,然后观察荧光。
<检测条件> MitoBright LT Green :Ex 488 nm/Em 500–560 nm MitoBright LT Red :Ex 561 nm/Em 560–620 nm MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm |
规格性状
性状:本品是黄色液体
吸光度:0.600~0.800(490 nm附近)
产品文献
1、L. Zhou, Q. Guan, W. Li, Z. Zhang, Y. Li and Y. Dong, “A Ferrocene-Functionalized Covalent Organic Framework for Enhancing Chemodynamic Therapy via Redox Dyshomeostasis”, 2021, doi:10.1002/smll.202101368.
2、Q. Guan, L. Zhou, Y. Dong, “Construction of Nanoscale Covalent Organic Frameworks via Photocatalysis-Involved Cascade Reactions for Tumor-Selective Treatment”, 2021, doi:10.1002/adtp.202100177.
3、X. Chen, X Yin, L. Zhan, J. Zhang, Y. Zhang, Y. Wu, J. Ju, Y. Li, Q. Xue, X. Wang, C. Li, R. R. L. Reis and Y. Wang, “Organelle-Specific Anchored Delivery System Stretching a Reversal of Tumor Hypoxia Microenvironment to a Combinational Chemo-Photothermal Therapy”, 2021, doi:10.1002/adfm.202108603.
4、S. Xia, Z. Ma, B. Wang, F. Gao, C. Yi, X. Zhou, S. Guo, L. Zhou, “In vitro anti-synovial sarcoma effect of diallyl trisulfide and mRNA profiling”, 2021, doi:10.1016/j.gene.2021.146172.
5、Y. Fujita, M. Iketani, M. Ito, I. Ohsawa, “Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts”, 2022, doi:10.1016/j.exger.2022.111866.
6、Wenxuan Yang, Satoshi Abe, Yasuhiko Tabata ,”Association with cationized gelatin nanospheres enhances cell internalization of mitochondria efficiency”,2023,doi:10.1016/j.reth.2023.06.011.
关联产品





特点:
● 标记稳定性强、特异性高
● 可用于免疫荧光共染色

规格性状

产品概述
线粒体不仅是细胞中产生能量的场所,也是与癌症、衰老、神经退行性疾病(例如,阿尔茨海默症、帕金森症)等密切相关的最重要的细胞器之一。
近年来,随着显微镜技术的发展,有关细胞器的研究正在由原来的“单独研究线粒体的机能””逐渐向“线粒体与其他细胞器之间的相互作用”的方向转移。因此,对于线粒体的更详细的形态观察需求越来越大。
MitoBright IM Red克服了其他染料的靶向标记稳定性差的问题,是一种可以用于免疫荧光共染色线粒体荧光探针。
实验例:与内质网标记物KDEL的共染色
用MitoBrightIM Red标记HeLa细胞的线粒体,经固定化和膜透性处理后再用内质网标记物KDEL的抗体进行免疫共染色。并且在左图的箭头所示范围内进行了荧光强度的检测。从荧光图像可以清晰的观察线粒体与附近的内质网的形态。
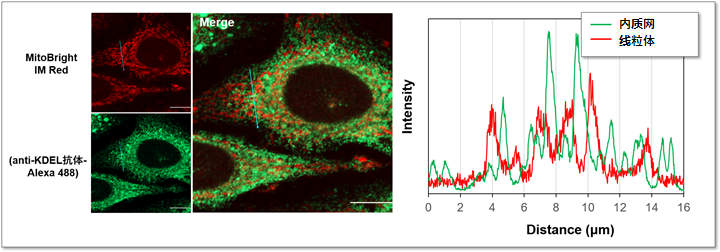
<检测条件>
MitoBright IM Red (红) Ex: 561 nm, Em: 560-620 nm
KDEL抗体-Alexa488 (绿) Ex: 488 nm, Em= 490-550 nm
Scale bar: 10 μm
MitoBright IM Red与其他试剂的不同
传统的小分子荧光染料在染色后的固定化操作或透膜剂处理后,往往会失去靶向性。而MitoBright IM Red与其他染料相比,提高了靶向稳定性,可以抑制免疫荧光实验时固定化操作造成的荧光强度减弱等问题。
・荧光强度差的比较
MitoBright IM与(T公司的)传统荧光染料相比,在活细胞线粒体染色后的固定化处理和透膜剂处理后的荧光强度如下图所示。固定化处理和透膜剂处理后,荧光强度都有一定的下降,但是MitoBright IM比传统染料的靶向标记稳定性更高,因此可以观察到更清晰的线粒体染色情况。
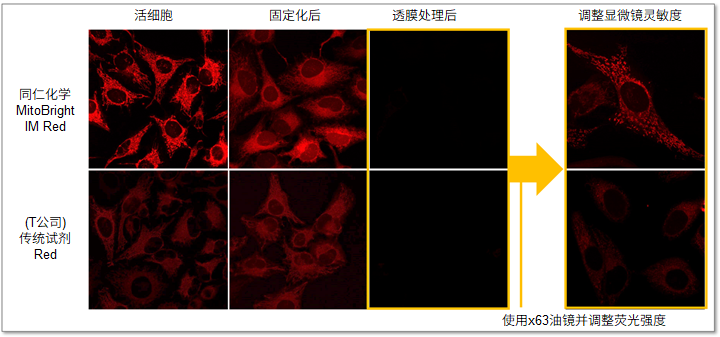
<检测条件>
Ex=561 nm; Em= 560-620 nm
・荧光背景的比较
使用线粒体标记物TOM20抗体比较MitoBrightIM和传统试剂的免疫染色后的线粒体定位情况。 用MitoBrightIM和传统试剂对HeLa细胞进行染色,然后用TOM20抗体进行二抗免疫荧光染色。 结果显示, 用MitoBrightIM或现有试剂对HeLa细胞进行染色,然后用TOM20抗体进行二抗染色。 结果显示,传统试剂有扩散到线粒体以外区域的情况,导致背景很高,而MitoBrightIM的背景更低,而且定位与TOM20抗体一致。
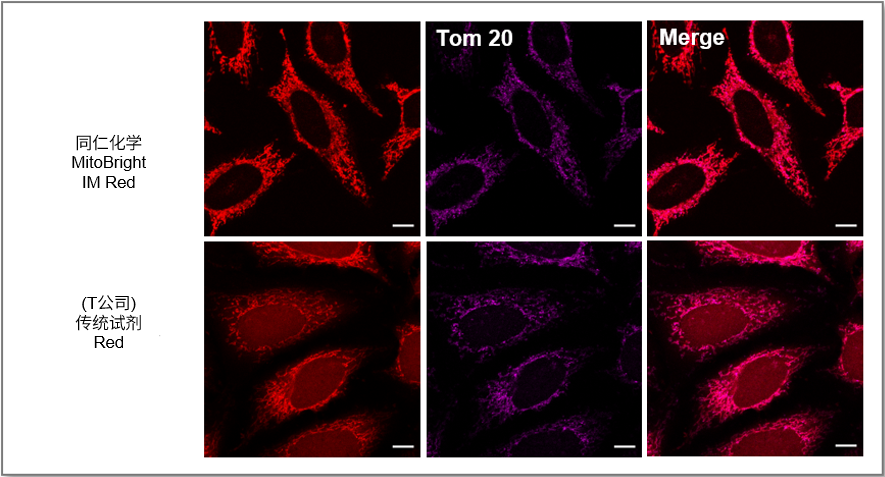
<检测条件>
Ex=561 nm; Em= 560-620 n
与传统试剂的对比
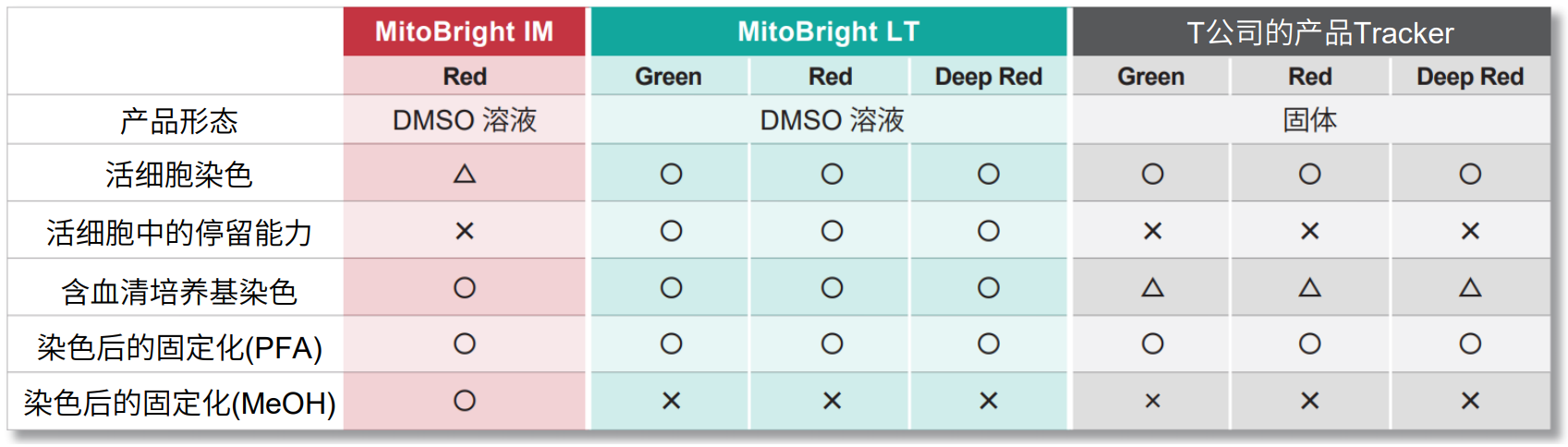
可检测的次数
| MitoBright IM Red
规格 |
荧光显微镜 |
| (35 mm dish, working solution 2 ml/dish时) | |
| 20 μl | 10 枚 |
| 20 µl x3 | 30 枚 |
荧光特性
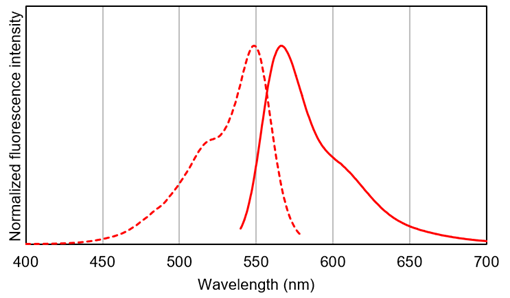
激发波长(λex) : 548 nm
发射波长(λem) : 566 nm
常见问题Q&A
| Q: MitoBright IM Red出厂就是是DMSO溶液状态,反复冻融是否会影响染色结果? |
| 我们做过反复冻融5次的稳定性实验,染色结果正常。如果长时间保存时需要反复冻融,保险起见建议提前分装,分开保存。 |
| Q:先药物刺激再进行MitoBright IM染色时,发现有荧光辉斑产生,请问是否有好的解决办法? |
| A:请在药物刺激前进行MitoBright IM的染色。 由于本试剂是依靠线粒体膜电位在线粒体处积累的,如果线粒体膜电位大幅降低,会导致试剂无法在线粒体处聚集。
(参考实验) 分别采用“先FCCP刺激后染色” 和“先染色后FCCP刺激” 的方法对HeLa细胞进行实验并观察荧光。 先进行MitoBright IM染色再FCCP刺激的实验组很顺利的观察到了荧光,而相反的实验组没有观察到荧光。
|
关联产品





特点:
● 荧光持续时间长
● 可在含血清培养基中染色
● 荧光显微镜、流式细胞仪均可检测


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Mitophagy Detection Kit 线粒体自噬检测
NO.2. FerroOrange 细胞亚铁离子检测
NO.3. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.4. Cellstain- Hoechst 33342 solution 细胞核染色
NO.5. Liperfluo 细胞脂质过氧化物检测
产品概述
细胞内有各种各样的细胞器,承担着各种各样必须的生命活动。其中线粒体不仅是通过氧化磷酸化反应生成ATP 的场所,它还与癌症、细胞衰老、阿尔兹海默症、帕金森综合症等神经退行性疾病紧密相关,因此它是细胞内最重要的细胞器之一。
在对线粒体的形态和动态进行观察以及定量检测时,通常使用小分子荧光探针标记和荧光蛋白的基因转染两种方法。荧光蛋白的基因转染存在转染效率不稳定等情况,因此操作简便的小分子荧光探针的使用更为广泛。现在市面上销售的小分子荧光探针中,多为含有氯甲基的探针,该探针存在观察时间短,染色时不能使用含血清的培养基,染色后荧光背景高等问题。MitoBright LT 荧光探针克服了这些问题,可在线粒体内稳定存在一天以上,条件合适的情况下可达到一周。而且与含有氯甲基的探针相比,染色后的荧光强度更高。本品直接采用DMSO 溶液包装,可快速方便的进行线粒体染色。荧光颜色有Green, Red, Deep Red 等多种选择,可满足多重染色等各种各样的实验要求。
产品特点
1.可长时间在细胞内存在
用HBSS 清洗 HeLa 细胞后,分别用 MitoBright LT 和其他公司的试剂进行染色,更换含血清的培养基,培养 4 天后观察线粒体染色情况。其他公司的染色试剂在 4 天后荧光强度大幅降低,而 MitoBrightLT 依然维持着高荧光强度,并且在染色 7 日后依然可以观察到荧光。

<检测条件>
MitoBright LT Green 、(T 公司)Green:Ex:488 nm/Em:500–560 nm
MitoBright LT Red 、(T 公司)Red:Ex 561:nm/Em:560–620 nm
MitoBright LT Deep Red 、(T 公司)Deep Red:Ex:640 nm/Em:650–700 nm
2.可以使用含血清培养基
用MitoBright LT 和其他公司试剂,分别用含有血清和不含血清的培养基染色。其他公司试剂在含有血清的培养基染色时,荧光明显减弱,而 MitoBright LT 在含有血清的培养基条件下,荧光没有减弱,可明显观察到线粒体的染色情况。

3.线粒体的分裂和融合
用100 nmol/l MitoBrightLT Red将HeLa细胞染色后,换入无血清培养基30分钟后观察线粒体形态。

<检测仪器>
共聚焦显微镜,放大倍率:63倍
<检测条件>
Ex:561 nm/Em:560–620 nm
实验例
用流式细胞仪检测
1. 用RPMI 培养基(10% fetal bovine serum, 1% penicillin-streptomycin)配制Jurkat 细胞悬液(3.2×105cell/mL)播种于5 cm 培养皿,37℃,5% CO2 培养箱内培养一晚。
2. 去除培养基,加入MitoBright LT Working Solution (0.1 μmol/L, 5 mL), 37℃培养30 分钟。
3. 去除溶液,用 5mL 的PRPMI 培养基清洗细胞2 次。
4. 添加RPMI 培养基,持续培养细胞,每隔2 天用流式细胞仪检测。

在胶原蛋白涂覆玻璃板上观察线粒体荧光成像
胶原蛋白涂覆玻璃板通常用于线粒体形态的高倍放大观察。
现有的线粒体染色试剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以在不受背景影响的情况下清楚地对线粒体进行染色。
<染色条件>
将HeLa细胞接种在胶原蛋白涂覆玻璃板上,培养24小时,提取上清液并用HBSS洗涤。
加入100nmol / L的MitoBright LT Green工作溶液,培养30分钟后,提取上清液并用HBSS洗涤后用荧光显微镜观察。
<检测条件>
Ex488 nm,Em 500-560 nm

<结果>
现有的线粒体染色剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以清晰地对线粒体染色,而不受背景影响。
通过超分辨率激光显微镜(STED)观察线粒体内部构造
线粒体疾病致突变的Cybrid细胞用MitoBright-LT-Deep Red染色,用超分辨激光显微镜(STED)观察,证实线粒体嵴结构异常。

<实验条件>
色素:MitoBrightLT Deep Red(100nmol/l)
仪器:Leica超分辨率激光显微镜TCS SP8 STED 3X
Ex. 640 nm / Em. 650-700 nm
STED激光:775nm
<实验步骤>
1将细胞接种在玻璃培养皿中,培养2天(37℃,5% CO2)。
2去除培养基后,加入使用L-15培养基(含10%FBS)制备的MitoBrightLT Deep Red(100nmol/l)工作液。
3孵育45分钟(37度,5% CO2)。
4去除上清液,用HBSS清洗两次。
5加入L-15培养基(含10%FBS),通过超分辨率激光显微镜(Leica TCS SP8 STED)进行观察。
以上数据由东京都老年学研究所衰老控制研究小组的大澤郁朗博士和藤田泰典博士友情提供。
产品论文
同仁化学研究所开发的线粒体长效染色荧光探针MitoBright LT系列在世界范围内广受科研人员的好评。在上市后的很短时间内,就出现了多篇使用MitoBright LT系列探针的论文,下面收集整理了部分的论文,其中红色字体标记的是使用本产品标记线粒体后,长时间(最长至5天)观察线粒体动态的报道,供感兴趣的科研人员参考。
| 产品名 | 检测样品 | 染色后的 观察时间 |
检测仪器 | 发表期刊(含原文链接) | 影响因子 |
| MitoBright LT Green | 细胞 (U251) | 立即 | 荧光显微镜 | Pharmaceuticals | 4.286 |
| MitoBright LT Green | 酵母 (Lipomyces starkeyi) | 立即 | 荧光显微镜 | Genes to Cells | 1.655 |
| MitoBright LT Green | 细胞 (HeLa) | 立即 | 荧光酶标仪 | Biomaterials | 10.317 |
| MitoBright LT Green | 细胞 (Naive CD4+ T cells) | 立即 | 荧光显微镜 | Cell Reports | 9.423 |
| MitoBright LT Green | 细胞 (CT26) | 立即 | 流式细胞仪 | Journal of Radiation Research | 2.841 |
| MitoBright LT Green | 细胞 (C2C12) | 5 天 | 荧光显微镜 | Polymers | 4.329 |
| MitoBright LT Green | 细胞 (BMM) | 36 小时 or
3 天 |
荧光显微镜/ 流式细胞仪 |
JCI Insights | 8.315 |
| MitoBright LT Green | 细胞 (mouse erythrocytes) | 立即 | 荧光显微镜 | Front. Cell. Infect. Microbiol. | 5.293 |
| MitoBright LT Red | 细胞 (SH-SY5Y) | 立即 | 荧光显微镜 | Free Radical Biol. Med. | 7.376 |
| MitoBright LT Red | 细胞 (MRC-5) | 立即 | 荧光显微镜 | The FEBS Journal | 5.542 |
| MitoBright LT Red | 细胞 (A11 cells/ P29 cells) | 3 天 | 荧光显微镜 | BMC Mol. Cell Biol. | 5.293 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7; HCT-116 ) | 立即 | 荧光显微镜 | Small | 13.281 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7 ) | 8 小时 | 荧光显微镜 | Advanced Therapeutics | – |
| MitoBright LT Deep Red | 细胞 (4T1) | 24 小时 | 荧光显微镜 | Advanced Functional Materials | 18.808 |
| MitoBright LT Deep Red | 细胞 (SW982) | 立即 | 荧光显微镜 | Gene | 3.368 |
荧光特性
MitoBright LT 染料的荧光特性

常见问题Q&A
| Q1:MitoBright LT需要用DMSO溶液配制,反复冻结融化也不会影响试剂质量吗? |
| A1:我们已经确认可以使用冻融30次的溶液进行染色。 |
| Q2:MitoBright LT和MitoBright的区别。 |
| A2:MitoBright LT是MitoBright具有更强细胞内滞留性性能的产品。另外MitoBright LT是溶于DMSO的产品,可以立即使用,而无需准备染色溶液。 |

|
Q3:用MitoBright LT系列染色后再去极化是否会影响染色效果? |
| A3:我们确认了去极化和细胞种类对于染色效果的影响,MitoBright LT的每种染料都有不同程度的影响。作为参考,本公司将HeLa细胞用不同的MitoBrightLT试剂进行染色,在以下条件下进行去极化处理,观察荧光染色的变化。
<染色条件> HeLa细胞用MitoBright LT(100 μmol/l,孵育30分钟)染色,并用HBSS洗涤。 用FCCP(100 μmol/l,孵育60分钟)处理,用HBSS洗涤2次,然后观察荧光。
<检测条件> MitoBright LT Green :Ex 488 nm/Em 500–560 nm MitoBright LT Red :Ex 561 nm/Em 560–620 nm MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm |
规格性状
性状:本品是黄色液体
吸光度:0.600~0.800(490 nm附近)
产品文献
1、L. Zhou, Q. Guan, W. Li, Z. Zhang, Y. Li and Y. Dong, “A Ferrocene-Functionalized Covalent Organic Framework for Enhancing Chemodynamic Therapy via Redox Dyshomeostasis”, 2021, doi:10.1002/smll.202101368.
2、Q. Guan, L. Zhou, Y. Dong, “Construction of Nanoscale Covalent Organic Frameworks via Photocatalysis-Involved Cascade Reactions for Tumor-Selective Treatment”, 2021, doi:10.1002/adtp.202100177.
3、X. Chen, X Yin, L. Zhan, J. Zhang, Y. Zhang, Y. Wu, J. Ju, Y. Li, Q. Xue, X. Wang, C. Li, R. R. L. Reis and Y. Wang, “Organelle-Specific Anchored Delivery System Stretching a Reversal of Tumor Hypoxia Microenvironment to a Combinational Chemo-Photothermal Therapy”, 2021, doi:10.1002/adfm.202108603.
4、S. Xia, Z. Ma, B. Wang, F. Gao, C. Yi, X. Zhou, S. Guo, L. Zhou, “In vitro anti-synovial sarcoma effect of diallyl trisulfide and mRNA profiling”, 2021, doi:10.1016/j.gene.2021.146172.
5、Y. Fujita, M. Iketani, M. Ito, I. Ohsawa, “Temporal changes in mitochondrial function and reactive oxygen species generation during the development of replicative senescence in human fibroblasts”, 2022, doi:10.1016/j.exger.2022.111866.
6、Wenxuan Yang, Satoshi Abe, Yasuhiko Tabata ,”Association with cationized gelatin nanospheres enhances cell internalization of mitochondria efficiency”,2023,doi:10.1016/j.reth.2023.06.011.
关联产品





特点:
● 荧光持续时间长
● 可在含血清培养基中染色
● 荧光显微镜、流式细胞仪均可检测


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. FerroOrange 细胞亚铁离子检测
NO.2. MitoPeDPP 线粒体内脂质过氧化物检测
NO.3. Liperfluo 细胞脂质过氧化物检测
NO.4. ROS Assay Kit -Highly Sensitive DCFH-DA- ROS检测
NO.5. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
产品概述
细胞内有各种各样的细胞器,承担着各种各样必须的生命活动。其中线粒体不仅是通过氧化磷酸化反应生成ATP 的场所,它还与癌症、细胞衰老、阿尔兹海默症、帕金森综合症等神经退行性疾病紧密相关,因此它是细胞内最重要的细胞器之一。
在对线粒体的形态和动态进行观察以及定量检测时,通常使用小分子荧光探针标记和荧光蛋白的基因转染两种方法。荧光蛋白的基因转染存在转染效率不稳定等情况,因此操作简便的小分子荧光探针的使用更为广泛。现在市面上销售的小分子荧光探针中,多为含有氯甲基的探针,该探针存在观察时间短,染色时不能使用含血清的培养基,染色后荧光背景高等问题。MitoBright LT 荧光探针克服了这些问题,可在线粒体内稳定存在一天以上,条件合适的情况下可达到一周。而且与含有氯甲基的探针相比,染色后的荧光强度更高。本品直接采用DMSO 溶液包装,可快速方便的进行线粒体染色。荧光颜色有Green, Red, Deep Red 等多种选择,可满足多重染色等各种各样的实验要求。
产品特点
1.可长时间在细胞内存在
用HBSS 清洗 HeLa 细胞后,分别用 MitoBright LT 和其他公司的试剂进行染色,更换含血清的培养
基,培养4天后观察线粒体染色情况。其他公司的染色试剂在4天后荧光强度大幅降低,而MitoBright
LT 依然维持着高荧光强度,并且在染色7日后依然可以观察到荧光。

<检测条件>
MitoBright LT Green 、(T 公司)Green:Ex:488 nm/Em:500–560 nm
MitoBright LT Red 、(T 公司)Red:Ex:561 nm/Em:560–620 nm
MitoBright LT Deep Red 、(T 公司)Deep Red:Ex:640 nm/Em:650–700 nm
2.可以使用含血清培养基
用MitoBright LT 和其他公司试剂,分别用含有血清和不含血清的培养基染色。其他公司试剂在含有血清的培养基染色时,荧光明显减弱,而 MitoBright LT 在含有血清的培养基条件下,荧光没有减弱,可明显观察到线粒体的染色情况。

3.荧光显微镜观察
HeLa细胞用CCCP处理,并与线粒体检测试剂(Mtphagy Dye)和线粒体染色试剂(MitoBright LT Green)共同染色,并经过一段时间(6小时)后进行检测。
<检测条件>
设备:LSM-700 Laser scanning confocal microscope (LSCM)
(Carl Zeiss, Oberkochen, Germany)
激发波长:
MitoBright LT Green 488 nm
Mtphagy Dye 555 nm
物镜:63x
拍摄时间:6小时
拍摄间隔:15秒
实验例
用流式细胞仪检测
1. 用RPMI 培养基(10% fetal bovine serum, 1% penicillin-streptomycin)配制Jurkat 细胞悬液(3.2×105cell/ml)播种于5 cm 培养皿,37℃,5% CO2培养箱内培养一晚。
2. 去除培养基,加入MitoBright LT Working Solution (0.1 μmol/L,5 ml), 37℃培养30 分钟。
3. 去除溶液,用 5mL 的PRPMI 培养基清洗细胞2次。
4. 添加RPMI培养基,持续培养细胞,每隔2天用流式细胞仪检测。

在胶原蛋白涂覆玻璃板上观察线粒体荧光成像
胶原蛋白涂覆玻璃板通常用于线粒体形态的高倍放大观察。
现有的线粒体染色试剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以在不受背景影响的情况下清楚地对线粒体进行染色。
<染色条件>
将HeLa细胞接种在胶原蛋白涂覆玻璃板上,培养24小时,提取上清液并用HBSS洗涤。
加入100nmol / L的MitoBright LT Green工作溶液,培养30分钟后,提取上清液并用HBSS洗涤后用荧光显微镜观察。
<检测条件>
Ex:488 nm,Em:500-560 nm

<结果>
现有的线粒体染色剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以清晰地对线粒体染色,而不受背景影响。
通过超分辨率激光显微镜(STED)观察线粒体内部构造
线粒体疾病致突变的Cybrid细胞用MitoBright-LT-Deep Red染色,用超分辨激光显微镜(STED)观察,证实线粒体嵴结构异常。

<实验条件>
色素:MitoBrightLT Deep Red(100 nmol/l)
仪器:Leica超分辨率激光显微镜TCS SP8 STED 3X
Ex:640 nm / Em: 650-700 nm
STED激光:775nm
<实验步骤>
1将细胞接种在玻璃培养皿中,培养2天(37℃,5% CO2)。
2去除培养基后,加入使用L-15培养基(含10%FBS)制备的MitoBrightLT Deep Red(100 nmol/l)工作液。
3孵育45分钟(37度,5% CO2)。
4去除上清液,用HBSS清洗两次。
5加入L-15培养基(含10%FBS),通过超分辨率激光显微镜(Leica TCS SP8 STED)进行观察。
以上数据由东京都老年学研究所衰老控制研究小组的大澤郁朗博士和藤田泰典博士友情提供。
产品文献
同仁化学研究所开发的线粒体长效染色荧光探针MitoBright LT系列在世界范围内广受科研人员的好评。在上市后的很短时间内,就出现了多篇使用MitoBright LT系列探针的论文,下面收集整理了部分的论文,其中红色字体标记的是使用本产品标记线粒体后,长时间(最长至5天)观察线粒体动态的报道,供感兴趣的科研人员参考。
| 产品名 | 检测样品 | 染色后的 观察时间 |
检测仪器 | 发表期刊(含原文链接) | 影响因子 |
| MitoBright LT Green | 细胞 (U251) | 立即 | 荧光显微镜 | Pharmaceuticals | 4.286 |
| MitoBright LT Green | 酵母 (Lipomyces starkeyi) | 立即 | 荧光显微镜 | Genes to Cells | 1.655 |
| MitoBright LT Green | 细胞 (HeLa) | 立即 | 荧光酶标仪 | Biomaterials | 10.317 |
| MitoBright LT Green | 细胞 (Naive CD4+ T cells) | 立即 | 荧光显微镜 | Cell Reports | 9.423 |
| MitoBright LT Green | 细胞 (CT26) | 立即 | 流式细胞仪 | Journal of Radiation Research | 2.841 |
| MitoBright LT Green | 细胞 (C2C12) | 5 天 | 荧光显微镜 | Polymers | 4.329 |
| MitoBright LT Green | 细胞 (BMM) | 36 小时 or
3 天 |
荧光显微镜/ 流式细胞仪 |
JCI Insights | 8.315 |
| MitoBright LT Green | 细胞 (mouse erythrocytes) | 立即 | 荧光显微镜 | Front. Cell. Infect. Microbiol. | 5.293 |
| MitoBright LT Red | 细胞 (SH-SY5Y) | 立即 | 荧光显微镜 | Free Radical Biol. Med. | 7.376 |
| MitoBright LT Red | 细胞 (MRC-5) | 立即 | 荧光显微镜 | The FEBS Journal | 5.542 |
| MitoBright LT Red | 细胞 (A11 cells/ P29 cells) | 3 天 | 荧光显微镜 | BMC Mol. Cell Biol. | 5.293 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7; HCT-116 ) | 立即 | 荧光显微镜 | Small | 13.281 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7 ) | 8 小时 | 荧光显微镜 | Advanced Therapeutics | – |
| MitoBright LT Deep Red | 细胞 (4T1) | 24 小时 | 荧光显微镜 | Advanced Functional Materials | 18.808 |
| MitoBright LT Deep Red | 细胞 (SW982) | 立即 | 荧光显微镜 | Gene | 3.368 |
荧光特性
MitoBright LT 染料的荧光特性
常见问题Q&A
| Q1:MitoBright LT需要用DMSO溶液配制,反复冻结融化也不会影响试剂质量吗? |
| A1:我们已经确认可以使用冻融30次的溶液进行染色。 |
| Q2:MitoBright LT和MitoBright的区别。 |
| A2:MitoBright LT是MitoBright具有更强细胞内滞留性性能的产品。另外MitoBright LT是溶于DMSO的产品,可以立即使用,而无需准备染色溶液。 |

|
Q3:用MitoBright LT系列染色后再去极化是否会影响染色效果? |
| A3:我们确认了去极化和细胞种类对于染色效果的影响,MitoBright LT的每种染料都有不同程度的影响。作为参考,本公司将HeLa细胞用不同的MitoBrightLT试剂进行染色,在以下条件下进行去极化处理,观察荧光染色的变化。
<染色条件> HeLa细胞用MitoBright LT(100 μmol/l,孵育30分钟)染色,并用HBSS洗涤。 用FCCP(100 μmol/l,孵育60分钟)处理,用HBSS洗涤2次,然后观察荧光。
<检测条件> MitoBright LT Green :Ex 488 nm/Em 500–560 nm MitoBright LT Red :Ex 561 nm/Em 560–620 nm MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm |
规格性状
性状:本品是黄色液体
吸光度:0.600~0.800(490 nm附近)
关联产品





特点:
● 荧光持续时间长
● 可在含血清培养基中染色
● 荧光显微镜、流式细胞仪均可检测


活动进行中
订购满5000元,200元礼品等你拿
凑单关联产品TOP5
NO.1. Mitophagy Detection Kit 线粒体自噬检测
NO.2. FerroOrange 细胞亚铁离子检测
NO.3. DALGreen – Autophagy Detection 细胞自噬检测
NO.4. Liperfluo 细胞脂质过氧化物检测
NO.5. Lactate Assay Kit-WST 乳酸检测
产品概述
细胞内有各种各样的细胞器,承担着各种各样必须的生命活动。其中线粒体不仅是通过氧化磷酸化反应生成ATP的场所,它还与癌症、细胞衰老、阿尔兹海默症、帕金森综合症等神经退行性疾病紧密相关,因此它是细胞内最重要的细胞器之一。
在对线粒体的形态和动态进行观察以及定量检测时,通常使用小分子荧光探针标记和荧光蛋白的基因转染两种方法。荧光蛋白的基因转染存在转染效率不稳定等情况,因此操作简便的小分子荧光探针的使用更为广泛。现在市面上销售的小分子荧光探针中,多为含有氯甲基的探针,该探针存在观察时间短,染色时不能使用含血清的培养基,染色后荧光背景高等问题。MitoBright LT荧光探针克服了这些问题,可在线粒体内稳定存在一天以上,条件合适的情况下可达到一周。而且与含有氯甲基的探针相比,染色后的荧光强度更高。本品直接采用DMSO溶液包装,可快速方便的进行线粒体染色。荧光颜色有Green, Red, Deep Red等多种选择,可满足多重染色等各种各样的实验要求。
产品特点

1.可长时间在细胞内存在
用HBSS清洗HeLa细胞后,分别用MitoBright LT和其他公司的试剂进行染色,更换含血清的培养基,培养4天后观察线粒体染色情况。其他公司的染色试剂在4天后荧光强度大幅降低,而MitoBright LT依然维持着高荧光强度,并且在染色7日后依然可以观察到荧光。

<检测条件>
MitoBright LT Green 、(T公司)Green:Ex 488 nm/Em 500–560 nm
MitoBright LT Red 、(T公司)Red:Ex 561 nm/Em 560–620 nm
MitoBright LT Deep Red 、(T公司)Deep Red:Ex 640 nm/Em 650–700 nm
2.可以使用含血清培养基
用MitoBright LT和其他公司试剂,分别用含有血清和不含血清的培养基染色。其他公司试剂在含有血清的培养基染色时,荧光明显减弱,而MitoBright LT在含有血清的培养基条件下,荧光没有减弱,可明显观察到线粒体的染色情况。

实验例
实时荧光观察
HeLa细胞用CCCP处理,并与线粒体检测试剂(Mtphagy Dye)和线粒体染色试剂(MitoBright LT Green)共同染色,并经过一段时间(6小时)后进行检测。
<检测条件>
设备:LSM-700 Laser scanning confocal microscope (LSCM)
(Carl Zeiss, Oberkochen, Germany)
激发波长:
MitoBright LT Green 488 nm
Mtphagy Dye 555 nm
物镜:63x
拍摄时间:6小时
拍摄间隔:15秒
用流式细胞仪检测
1. 用RPMI培养基(10% Fetal Bovine Serum, 1% Penicillin-Streptomycin)配制Jurkat细胞悬液(3.2×105cell/ml)接种于5 cm培养皿中,在37℃,5% CO2培养箱内过夜培养。
2. 去除培养基,加入MitoBright LT Working Solution (0.1 μmol/l, 5 ml), 在37℃培养30分钟。
3. 去除溶液,用 5 ml的PRPMI培养基清洗细胞2 次。
4. 更换RPMI培养基,持续培养细胞,每隔2 天用流式细胞仪检测。
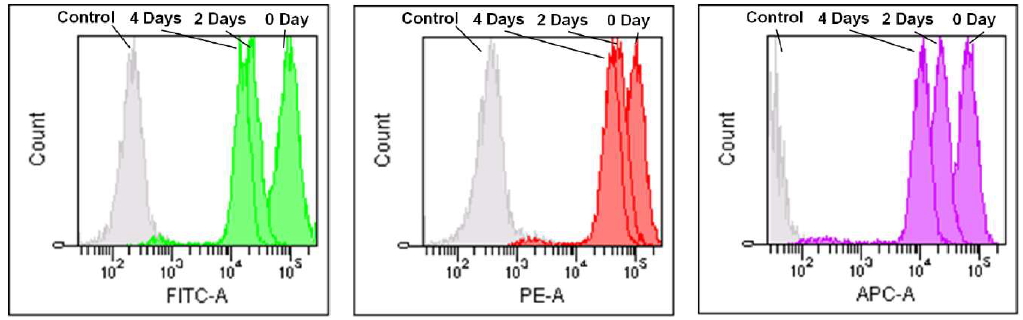
MitoBright LT Green MitoBright LT Red MitoBright LT Deep Red
Excitation: 488 nm Excitation: 488 nm Excitation: 633 nm
Emission: 515-545 nm Emission: 564-604 nm Emission: 650-670 nm
在胶原蛋白涂覆玻璃板上观察线粒体荧光成像
胶原蛋白涂覆玻璃板通常用于线粒体形态的高倍放大观察。
现有的线粒体染色试剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以在不受背景影响的情况下清楚地对线粒体进行染色。
<染色条件>
将HeLa细胞接种在胶原蛋白涂覆玻璃板上,培养24小时,提取上清液并用HBSS洗涤。
加入100 nmol/l的MitoBright LT Green工作溶液,培养30分钟后,提取上清液并用HBSS洗涤后用荧光显微镜观察。
<检测条件>
Ex 488 nm,Em 500-560 nm
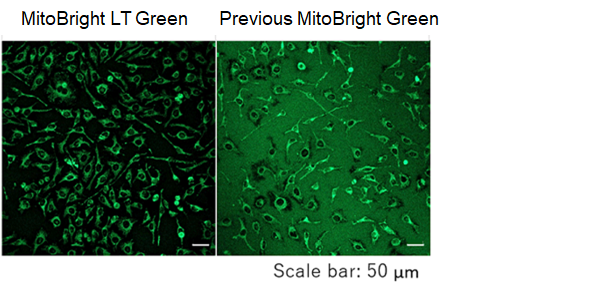
<结果>
现有的线粒体染色剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以清晰地对线粒体染色,而不受背景影响。
通过超分辨率激光显微镜(STED)观察线粒体内部构造
线粒体疾病致突变的Cybrid细胞用MitoBright-LT-Deep Red染色,用超分辨激光显微镜(STED)观察,证实线粒体嵴结构异常。

<实验条件>
色素:MitoBrightLT Deep Red(100 nmol/l)
仪器:Leica超分辨率激光显微镜TCS SP8 STED 3X
Ex. 640 nm / Em. 650-700 nm
STED激光:775nm
<实验步骤>
1将细胞接种在玻璃培养皿中,培养2天(37℃,5% CO2)。
2去除培养基后,加入使用L-15培养基(含10%FBS)制备的MitoBrightLT Deep Red(100 nmol/l)工作液。
3孵育45分钟(37度,5% CO2)。
4去除上清液,用HBSS清洗两次。
5加入L-15培养基(含10%FBS),通过超分辨率激光显微镜(Leica TCS SP8 STED)进行观察。
以上数据由东京都老年学研究所衰老控制研究小组的大澤郁朗博士和藤田泰典博士友情提供。
产品文献
同仁化学研究所开发的线粒体长效染色荧光探针MitoBright LT系列在世界范围内广受科研人员的好评。在上市后的很短时间内,就出现了多篇使用MitoBright LT系列探针的论文,下面收集整理了部分的论文,其中红色字体标记的是使用本产品标记线粒体后,长时间(最长至5天)观察线粒体动态的报道,供感兴趣的科研人员参考。
| 产品名 | 检测样品 | 染色后的 观察时间 |
检测仪器 | 发表期刊(含原文链接) | 影响因子 |
| MitoBright LT Green | 细胞 (U251) | 立即 | 荧光显微镜 | Pharmaceuticals | 4.286 |
| MitoBright LT Green | 酵母 (Lipomyces starkeyi) | 立即 | 荧光显微镜 | Genes to Cells | 1.655 |
| MitoBright LT Green | 细胞 (HeLa) | 立即 | 荧光酶标仪 | Biomaterials | 10.317 |
| MitoBright LT Green | 细胞 (Naive CD4+ T cells) | 立即 | 荧光显微镜 | Cell Reports | 9.423 |
| MitoBright LT Green | 细胞 (CT26) | 立即 | 流式细胞仪 | Journal of Radiation Research | 2.841 |
| MitoBright LT Green | 细胞 (C2C12) | 5 天 | 荧光显微镜 | Polymers | 4.329 |
| MitoBright LT Green | 细胞 (BMM) | 36 小时 or
3 天 |
荧光显微镜/ 流式细胞仪 |
JCI Insights | 8.315 |
| MitoBright LT Green | 细胞 (mouse erythrocytes) | 立即 | 荧光显微镜 | Front. Cell. Infect. Microbiol. | 5.293 |
| MitoBright LT Red | 细胞 (SH-SY5Y) | 立即 | 荧光显微镜 | Free Radical Biol. Med. | 7.376 |
| MitoBright LT Red | 细胞 (MRC-5) | 立即 | 荧光显微镜 | The FEBS Journal | 5.542 |
| MitoBright LT Red | 细胞 (A11 cells/ P29 cells) | 3 天 | 荧光显微镜 | BMC Mol. Cell Biol. | 5.293 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7; HCT-116 ) | 立即 | 荧光显微镜 | Small | 13.281 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7 ) | 8 小时 | 荧光显微镜 | Advanced Therapeutics | – |
| MitoBright LT Deep Red | 细胞 (4T1) | 24 小时 | 荧光显微镜 | Advanced Functional Materials | 18.808 |
| MitoBright LT Deep Red | 细胞 (SW982) | 立即 | 荧光显微镜 | Gene | 3.368 |
荧光特性
MitoBright LT 染料的荧光特性

常见问题Q&A
| Q1:MitoBright LT需要用DMSO溶液配制,反复冻结融化也不会影响试剂质量吗? |
| A1:我们已经确认可以使用冻融30次的溶液进行染色。 |
| Q2:MitoBright LT和MitoBright的区别。 |
| A2:MitoBright LT是MitoBright具有更强细胞内滞留性性能的产品。另外MitoBright LT是溶于DMSO的产品,可以立即使用,而无需准备染色溶液。 |

|
Q3:用MitoBright LT系列染色后再去极化是否会影响染色效果? |
| A3:我们确认了去极化和细胞种类对于染色效果的影响,MitoBright LT的每种染料都有不同程度的影响。作为参考,本公司将HeLa细胞用不同的MitoBrightLT试剂进行染色,在以下条件下进行去极化处理,观察荧光染色的变化。
<染色条件> HeLa细胞用MitoBright LT(100 μmol/l,孵育30分钟)染色,并用HBSS洗涤。 用FCCP(100 μmol/l,孵育60分钟)处理,用HBSS洗涤2次,然后观察荧光。
<检测条件> MitoBright LT Green :Ex 488 nm/Em 500–560 nm MitoBright LT Red :Ex 561 nm/Em 560–620 nm MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm |
规格性状
性状:本品是黄色液体
吸光度:0.600~0.800(490 nm附近)
关联产品




