特点:
● 可高灵敏的检测细胞表面抗原
● 高选择性与细胞内的滞留能力

产品概述
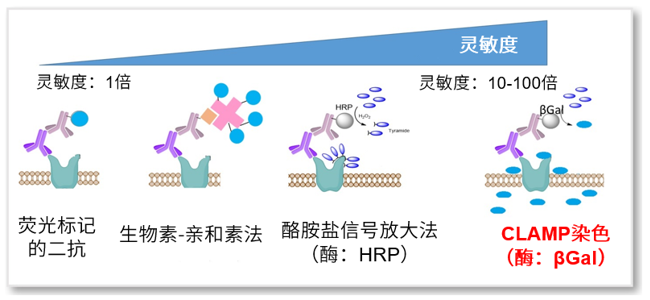
近年来,以细胞表面抗原为目标的癌症治疗和诊断的相关研究引起了科研人员的广泛关注。目前较为常用的方法是利用荧光标记的抗体来检测细胞表面抗原(免疫荧光法),但是由于许多细胞表面蛋白的表达水平不高,往往造成检测结果灵敏度低、适用范围小的问题。针对这些问题,同仁化学研究所专门开发了一种高灵敏度的荧光染色方法,即CLAMP法(quinone methide-based catalyzed signal amplification)。
*本产品是在日本九州大学片山佳树教授的指导下研制而成。
检测原理
通过利用一抗、β-Galactosidase(β-Gal)标记的二抗、β-Gal的荧光底物CLAMP F405进行荧光染色。CLAMP F405自身没有荧光也无法通过细胞膜,在与β-Gal反应后会形成具有细胞膜透过能力的Quinone methide,在进入细胞后可以与细胞内氨基和巯基结合并发出荧光。因为该荧光强度经过β-Gal的酶反应而得到增强,因此可以高灵敏的检测细胞膜上蛋白质。
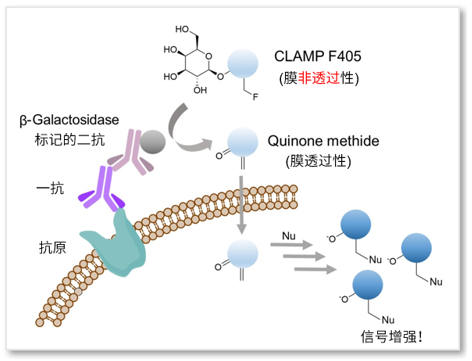
参考文献:Noguchi, K. et al., “β-Galactosidase-Catalyzed Fluorescent Reporter Labeling of Living Cells for Sensitive Detection of Cell Surface Antigens”, Bioconjugate Chem., 2020, 31(7), 1740–1744.
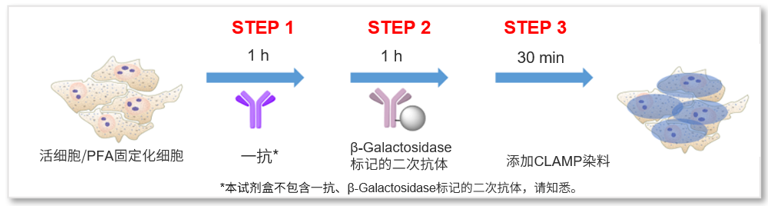
操作简单、灵敏度高
CLAMP法的操作步骤与一般的二抗法相同。依次加入目的蛋白对应的一抗、β-gal标记的二抗、染色液,简单的三步操作后即可开始检测。

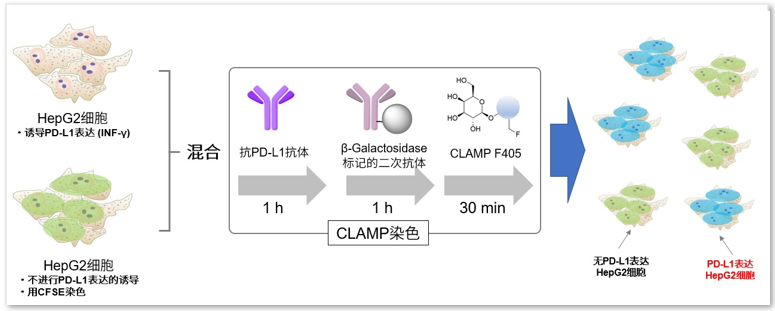
实验例
PD-1L1性能比较表
同时准备PD-L1诱导表达的HepG2细胞以及作为对照组的CFSE染色的细胞。将这两个细胞样品混合后,用CLAMP检测PD-L1表达的细胞。从结果可以看出,在CFSE染色细胞中,没有任何CLAMP法阳性细胞出现,PD-L1表达的细胞被清楚地标记区分出来。说明CLAMP可以用于检测一般的二次抗体法很难检测出来的PD-L1表达的HepG2细胞。
*CFSE: 5- or 6-(N-Succinimidyloxycarbonyl)fluorescein 3‘,6’-diacetate。(同仁货号:C375)
<检测结果>
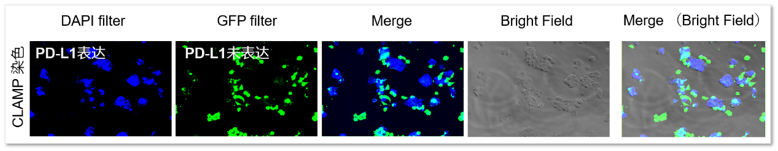
<检测条件>
Blue: Ex = 340-380 nm, Em = 435-485 nm
Green: Ex = 450-490 nm, Em = 500-550 nm
FFPE组织切片-人小肠组织
分别用CLAMP法和酪酰胺信号放大法(TSA, Tyramide signal amplification)检测人小肠FFPE组织切片上的α 平滑肌肌动蛋白(αSMA, α-smooth muscle actin)和角蛋白。结果显示CLAMP法的灵敏度更高,并且清晰的呈现了组织的免疫荧光共染色。
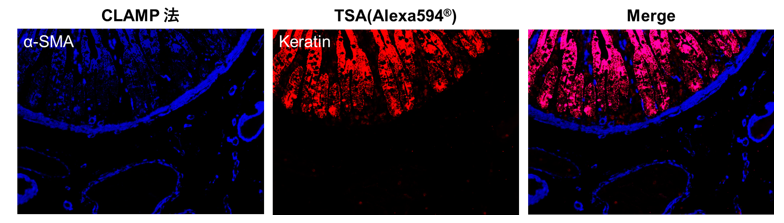
*数据提供:日本京都大学医学部附属医院病理诊断科 平田胜启老师
操作步骤实验例
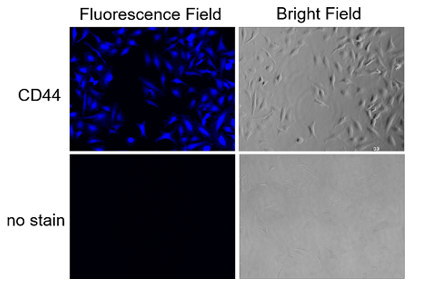
① Protocol 1 (实验例:荧光显微镜检测HeLa细胞的表面抗原CD44)
参照操作说明书的Protocol 1,用CLAMP法检测HeLa细胞上的表面抗原CD44。
<检测条件>
1. 将HeLa细胞(1 x 105 cell/ml)播种于96孔板(100 μl/well),37℃,5% CO2培养箱内过夜培养。
2. 去除上清,用100 µl MEM (10% FBS) 培养基清洗2次。
3. 去除上清,加入100 µl μg/ml 抗CD44抗体 (ab189524, abcam) /MEM (10% FBS) ,37℃,5% CO2培养箱内培养1 h。
4. 去除上清,用100 µl MEM (10% FBS)培养基清洗2次。
5. 加入100 µl x500 β-Galactosidase标记的抗体(ab136774, abcam)/MEM (10% FBS),37℃,5% CO2培养箱内培养1 h。
6. 去除上清,用100 µl HBSS清洗细胞2次。
7. 加入100 µl Staining Solution,37℃,5% CO2培养箱内培养30 min。
8. 去除上清,用100 µl HBSS清洗细胞3次。
9. 用荧光显微镜观察荧光。(DAPI filter: Ex = 320-360 nm, Em = 435-480 nm)
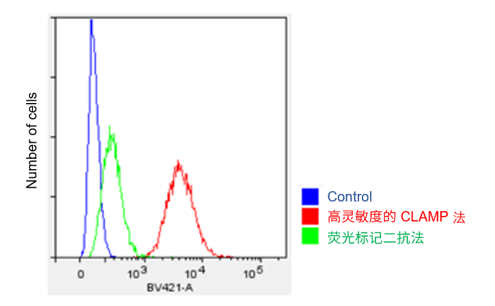
② Protocol 2 (实验例:流式细胞仪检测HeLa细胞的表面抗原CD44)
参照操作说明书的Protocol 2,用CLAMP法检测HeLa细胞上的表面抗原CD44。
<检测条件>
1. 在1.5 ml微管中用MEM培养基(10% FBS) 制成2 x 105 cells/tube HeLa细胞的细胞悬液。
2. 300×g离心5 min,去除上清。
3. 添加500 µl 2 μg/ml CD44抗体(ab189524, abcam)/MEM培养基(10% FBS),吹打混匀。
4. 在37℃静置1 h。
5. 按下列步骤进行清洗。
Ⅰ. 300×g离心5 min,去除上清。 Ⅱ. 加入500 µl培养基吹打制成细胞悬液。
Ⅲ. 300×g离心5 min,去除上清。 Ⅳ. 再重复一次步骤Ⅱ和Ⅲ。
6. 加入500 µl x500 β-Galactosidase标记的抗体(ab16774, abcam) /MEM培养基(10% FBS),吹打制成细胞悬液。
荧光二抗法使用Alexa Fluor405标记的抗体 (ab175652, abcam)
7. 在37℃静置1 h。
8. 用HBSS替代培养基,重复步骤5的清洗操作,
9. 加入500 µl用HBSS配制的Staining Solution(悬浮细胞用),吹打制成细胞悬液。
10.在37℃下,用微管旋转器(Tube Rotator)搅拌30 min。注意:不搅拌的话会造成灵敏度降低。
11. 300×g离心5 min,去除上清。
12.加入500 µl HBSS吹打混匀。
13.上流式细胞仪检测(LSR Fortessa X-20, BD)。 *BV421 filter set (Ex:405 nm, Em:430-470 nm)
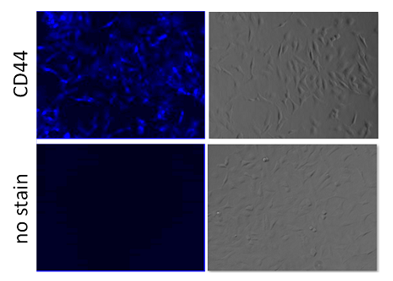
③ Protocol 3 (实验例:检测固定化HeLa细胞的表面抗原CD44)
参照操作说明书的Protocol 3,用CLAMP法检测固定化HeLa细胞上的表面抗原CD44。
<检测条件>
PFA固定细胞的准备
1. 将HeLa细胞 (1 x 105 cell/ml)播种于96孔板(100 μl/well),37℃,5% CO2培养箱内过夜培养。
2. 去除上清,用100 µl PBS清洗2次。
3. 加入100 µl 4% PFA/PBS溶液,室温静置30 min。
4. 去除上清,加入100 µl 0.1% Triton X-100/PBS溶液,室温静置30 min。
5. 去除上清,每孔加入100 µl Blocking Buffer (10% Blocking One/PBS),室温静置30 min。
染色步骤
1. 去除上清,加入100 2 μg/ml 抗CD44抗体 (ab189524, Abcam) /Blocking Buffer ,室温静置1 h。
2. 去除上清,用100 µl Blocking Buffer清洗2次。
3. 加入100 µl x500 β-Galactosidase 标记的抗体 (ab16774, abcam) /Blocking Buffer ,室温静置1 h。
4. 去除上清,用100 µl Blocking Buffer清洗2次。
5. 加入100 µl Staining Solution,37℃静置30 min 。
6. 去除上清,用100 µl PBS清洗细胞3次。
7. 用荧光显微镜观察荧光。(DAPI filter: Ex = 320-360 nm, Em = 435-480 nm)
④ Protocol 4 (实验例:检测固定化MOLT4细胞的表面抗原PD1)
参照操作说明书的Protocol 4,用CLAMP法检测固定化MOLT4细胞上的表面抗原PD1。
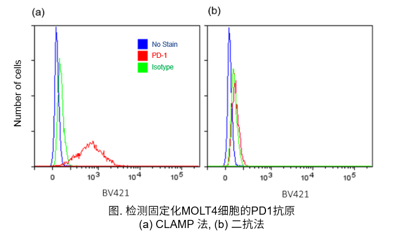
<检测条件>
PFA细胞固定的准备
1. 在1.5 ml微管中加入(2 x 105 cells/tube)MOLT4细胞制成细胞悬液。
2. 300×g离心5 min,去除上清。
3. 添加500 µl 4% PFA/PBS溶液,吹打混匀。
4. 室温静置30 min,300×g离心5 min。
5. 去除上清,加入500 µl 0.1% TritonX-100/PBS溶液,吹打混匀。
6. 室温静置30 min,300×g离心5 min。
7. 去除上清,加入500 µl Blocking Buffer (10% Blocking One/PBS),吹打混匀。
8. 去除上清后用100 µl HBSS清洗3次。
9. 室温静置30 min,300×g离心5 min,去除上清后开始染色步骤。
染色步骤
1. 加入500 µl 1 μg/ml PD1抗体(ab52587, abcam)/Blocking Buffer,吹打混匀。(同型对照使用IgG1KAPPA, 401408, Biolegend)
2. 室温静置1 h。
3. 按下列步骤进行清洗。
Ⅰ. 300×g离心5 min,去除上清。 Ⅱ. 加入500 µl Blocking Buffer吹打制成细胞悬液。
Ⅲ. 300×g离心5 min,去除上清。 Ⅳ. 再重复一次步骤Ⅱ和Ⅲ。
4. 加入<span style=”font-size: 11px; font-family: Arial; color: blac
FAQ
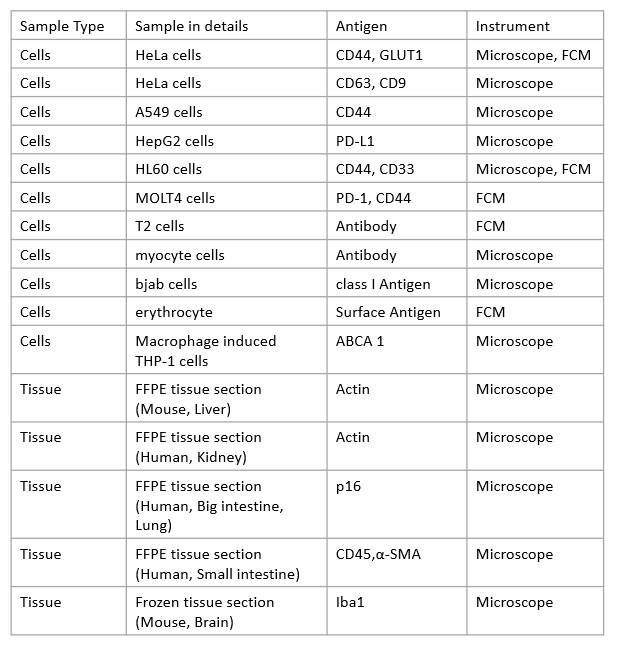
| Q:目前有染色实例的细胞和抗原有哪些? |
| A:请参考下表:
|
| Q:染色后的样品可以保存吗 |
| A:活细胞在染色后再进行PFA固定的样品可以在PBS中冷藏保存1周。已经固定好的细胞再进行染色,在PBS中也可冷藏保存1周。 |
| Q:内源性β-Galactosidase是否会影响染色结果? |
| A:活细胞染色时,CLAMP F405无法通过细胞膜,所以不会与内源性β-Galactosidase反应。而固定细胞染色时,按照书名数要求需要在PBS溶液中进行染色,一般也不会产生背景荧光上升的问题。 |
| Q:是否可以用PBS和HBSS以外的缓冲液来配制Staining Solution? |
| A:中性以外的缓冲液会对染色反应有影响,所以不推荐使用。 |
| Q:各仪器的推荐检测条件? |
| A:普通荧光显微镜:DAPI filter, Ex = 320-380 nm, Em = 435-485 nm
激光共聚焦显微镜:Ex = 405 nm, Em = 425-475 nm 流式细胞仪:Ex = 405nm, Em:BV421, Pacific Blue (450/50 nm) |
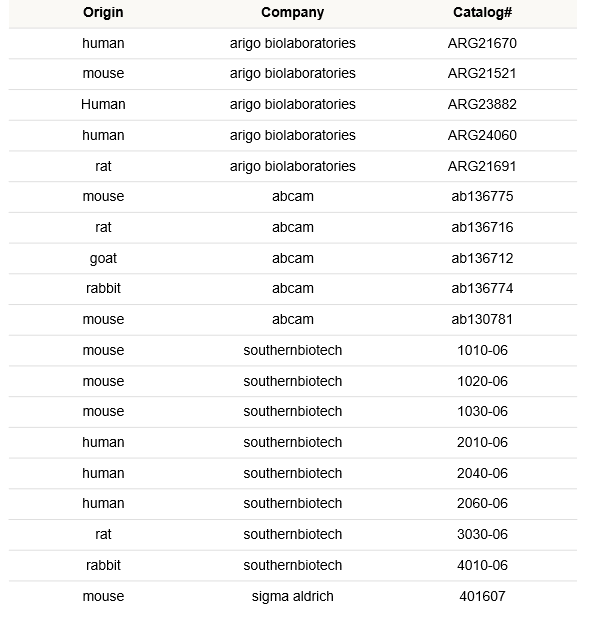
| Q:我从哪里可以购买到β-Gal标记的二次抗体? |
| A:同仁化学并不销售一抗和标标记好的二抗,下面是我们实际检测过并实验成功的抗体和厂家。
|
| Q:CLAMP F405-Signal Boosting的DMSO溶液是否可以反复冻融? |
| A:我们尝试过20次的反复冻融,对产品性能没有影响。 |
| Q:配置好的Staining Solution是否可以长期保存? |
| A:Staining Solution 无法长期保存,请现配现用。 |
| Q:是否可以用PBS和HBSS以外的缓冲液来配制Staining Solution? |
| A:中性以外的缓冲液会对染色反应有影响,所以不推荐使用。 |
| Q:各仪器的推荐检测条件? |
| A:普通荧光显微镜:DAPI filter, Ex = 320-380 nm, Em = 435-485 nm
激光共聚焦显微镜:Ex = 405 nm, Em = 425-475 nm 流式细胞仪:Ex = 405nm, Em:BV421, Pacific Blue (450/50 nm) |
| Q:如果荧光的背景高,有哪些改善的建议? |
| A:请按照操作说明书上的“抗体浓度预实验”的步骤预先摸索最佳抗体浓度。另外,对于悬浮细胞样品,在染色时请务必使用微管旋转器时刻保持微管内的悬浊状态。以上两种方法都可以降低背景荧光。 |
| Q:如果观察不到荧光,有哪些改善的建议? |
| A:重新配置Staining Solution,并且在37℃下染色30-60分钟。如果还是观察不到荧光,有可能是抗体的浓度不合适,请按照操作说明书上的“抗体浓度预实验”的步骤预先摸索最佳抗体浓度 |