特点:
● 标记的物质可以在大约2个小时内制备。
● 可以标记分子量为50,000或更高的蛋白质。
● 可以标记50至200μg的蛋白质。
● 可以通过使用过滤管的分离操作以高回收率获得标记物质。
● 标记的物质可以用所附的保存溶液保存。
试剂盒内含

产品概述
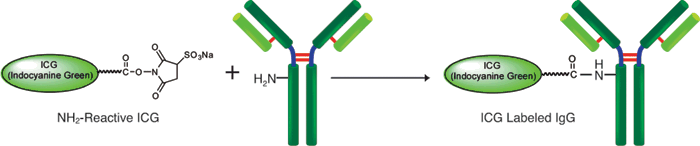
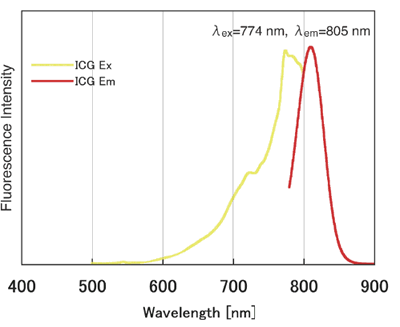
ICG(吲哚菁绿)是一种花青颜料,也用于肝功能和肝储备测试的色素负载测试中,并且在近红外区域具有荧光。激发波长在774nm附近,荧光波长在805nm附近,并且具有即使在体内使用也不容易被血红蛋白干扰的荧光特性。因此,期望将其应用于使用近红外荧光的体内荧光成像。 ICG标记试剂盒-NH2是用于标记具有氨基基团的蛋白质(尤其是抗体)的试剂盒。套件随附的NH2-Reactive以及已发布的荧光素标记套件–NH2(代码:LK01),HiLyte FluorTM 555标记套件–NH2(代码:LK14),HiLite FluorTM 647标记套件–NH2(代码:LK15)由于ICG在分子中具有活性酯,因此仅通过与具有氨基的分子混合即可形成稳定的共价键。当将ICG标记在蛋白质上时,可以使用随附的过滤管轻松去除抑制标记反应和未反应的NH2反应性ICG的低分子量化合物(例如Tris)。对于ICG标记的IgG,荧光波长为774/805nm。
该试剂盒包含标记所需的试剂和用于储存准备好的ICG标记产品的溶液。
原理
操作步骤
使用注意事项:
如果样品中含有分子量>10,000的物质 (多肽、其它蛋白等),有阻碍标记反应的可能性。在标记前需要先纯化,如果样品是抗体,可用 IgG Purification Kit (AP01,AP02)纯化,如果样品中有小的不溶物质,离心后取上清液来标记。
操作步骤:
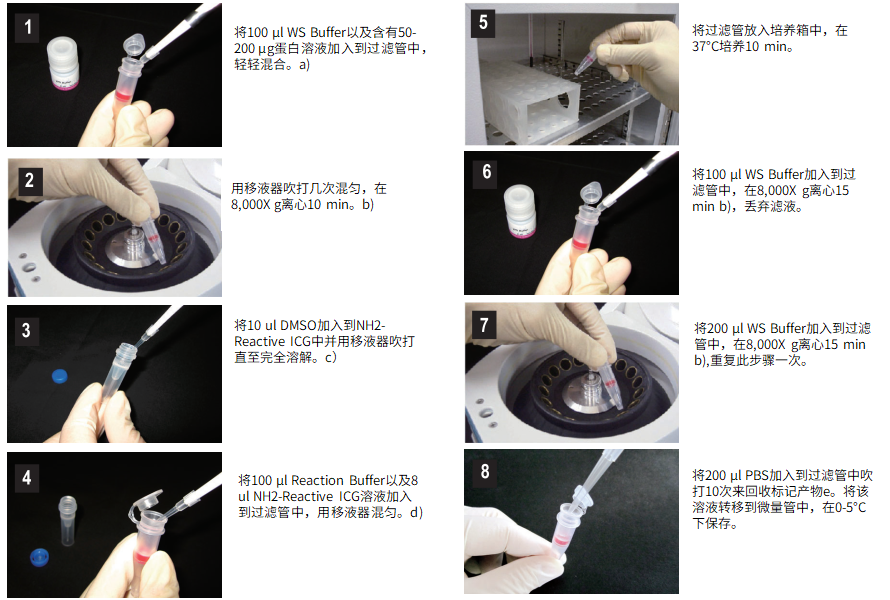
a) 蛋白溶液量要≤100ul,如果抗体浓度<0.5mg/ml,重复步骤1和2直至总蛋白量达到50-200ug。
b) 如果溶液在离心后仍然残留在膜上,继续离心5min或提高转速。
c) NH2-Reactive ICG在管子的底部,加10ul DMSO到管子的底部,用移液器反复吹打溶解。由于NH2-Reactive ICG会被DMSO中的水分水解,在制备好NH2-Reactive ICG溶液后马上进行第4步操作。
d) 如果蛋白总量达到200ug,请加入全部NH2-Reactive ICG溶液。
e) 我们推荐用WS Buffer保存标记产物,但也可以根据下一步实验要求选择合适的缓冲液。
产品优势
1)标记的物质可以在大约2个小时内制备。
2)可以标记分子量为50,000或更高的蛋白质。
3)可以标记50至200μg的蛋白质。
4)可以通过使用过滤管的分离操作以高回收率获得标记物质。
5)标记的物质可以用所附的保存溶液保存。
ICG标记实验例
图. 小鼠尾静脉注射ICG抗体的荧光成像图小鼠皮下肿瘤模型在注射了ICG抗体 (50ug) 48h后,有明显的迹象表明抗体在肿瘤中有选择性地聚集。
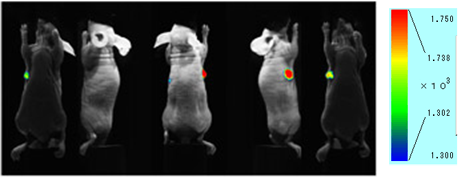
仪器:活体成像仪 (Clairvivo OPT,岛津制作所)
小鼠:BALB/c(nu/nu) 纯合子裸小鼠 (母,11周)
肿瘤细胞:HeLa细胞 (在右腋皮下移植后4周)
检测条件:Ex=785nm,Em=845/55nm
抗体:整合素α2抗体 曝光时间:10s
荧光特性
常见问题Q&A
| Q1: 标记小分子蛋白质(分子量50,000或以下)的方法。 |
| A:由于该试剂盒中包含的过滤管是分子量截断值为30K的超滤过滤器,因此我们建议使用50,000或分子量更大的蛋白质,并留有余量。
当标记分子量为50,000或更小的蛋白质时,可以通过更换为分子量分数较小的超滤过滤器来标记甚至很小的蛋白质,如下所示。 —————————————— PALL Nanocep 3K产品编号OD003C33 PALL Nanocep 10K产品编号OD010C33 —————————————— 离心所需的时间可能比试剂盒中随附的过滤器要长,因此请注意离心时间。 |
参考文献
| 1) M. Ogawa, C. A. S. Regino, J. Seidel, M. V. Green, W. Xi, M. Williams, N. Kosaka, P. L. Choyke and H. Kobayashi, “Dual-Modality Molecular Imaging Using Antibodies Labeled with Activatable Fluorescence and a Radionuclide for Specific and Quantitative Targeted Cancer Detection”, Bioconjugate Chem., 2009, 20(11), 2177. |
| 2) M. Ogawa, N. Kosaka, P. L. Choyke and H. Kobayashi, “In vivo Molecular Imaging of Cancer with a Quenching Near-Infrared Fluorescent Probe Using Conjuates of Monoclonal Antibodies and Indocyanine Green”, Cancer Res., 2009, 69(4), 1268. |
| 3) N. Kosaka, M. Ogawa, P. L. Choyke and H. Kobayashi, “Clinical implications of near-infrared fluorescence imaging in cancer”, Future Oncology, 2009, 5(9), 1501. |
| 4) 伊藤進, 六車直樹, 林重仁, 日下至弘, 多田津昌也, 多田津陽子, 岡本耕一, 井本佳孝, 稲山久美, 坂東輝美, 田岡聡子, 高川真由子, 矢野充保, 伊井邦雄, 長尾善光, 佐野茂樹, 芝村誠一, 島田典昭, 石田和彦, 中村一成, “赤外線蛍光内視鏡の原理と臨床応用”, Biomedical THERMOLOGY, 2003, 23(2), 77. |
| 5) S. Ito, N.Muguruma, S. Hayashi, S. Taoka, T. Bando, K. Inayama, M. Sogabe, T. Okahisa, S. Okamura, H. Shibata, T. Irimura, K. Takesako and S. Shibamura, “Development of Agents for Reinforcement of Fluorescence on Near-infrared Ray Excitation for Immunohistological Staining”, Bioorg. Med. Chem., 1998, 6, 613. |
| 6) S. Ito, N. Muguruma, Y. Kakehashi, S. Hayashi, S. Okamura, H. Shibata, T. Okahisa, M. Kanamori, S. Shibamura, K. Takesako, M. Nozawa, K. Ishida and M. Shiga, “Development of Fluorescence-Emitting Antibody Labeling Substance by Near-Infrared Ray Excitation”, Bioorg. Med. Chem. Lett., 1995, 5, 2689. |
| 7) K. Inayama, S. Ito, N. Muguruma, Y. Kusaka, T. Bando, Y. Tadatsu, M. Tadatsu, K. Ii, S. Shibamura and K. Takesako, “Basic Study of an Agent for Reinforcement of Near-infrared Fluorescence on Tumor Tissue”, Digestive and Liver Disease, 2003, 35, 88. |
| 8) S. Ito, N. Muguruma, S. Hayashi, S. Taoka, T. Bando, Y. Kusaka, M. Yano, S. Ichikawa, A. Hiasa, T. Omoya, H. Honda, I. Shimizu, K. Ii, K. Nakamura, K. Takesako, Y. Goto and S. Shibamura, “Visualization of Human Gastric Cancer with a Novel Infrared Fluorescent Labeling Marker of Anti-carcinoembryonic Antigen Antibody in vitro”, Dig. Endosc., 2000, 12, 33. |
| 9) S. Taoka, S. Ito, N. Muguruma, S. Hayashi, Y. Kusaka, K. Ii, K. Nakamura, K. Imaizumi, K. Takesako and S. Shibamura, “Reflected Illumination-type Imaging System for the Development of Infrared Fluorescence Endoscopy”, Dig. Endosc.,1999, 11(4), 321. |
| 10) S. Ito, N. Muguruma, S. Hayashi, S. Taoka, A. Tsutsui, T. Fukuda, T. Okahisa, Y. Ohkita, H. Matsunaga, I. Shimizu, K. Nakamura, K. Imaizumi, K. Takesako and S. Shibamura,”Development of an Imaging System Using Fluorescent Labeling Substances Excited by Infrared Rays”, Dig. Endosc., 1997, 9, 278. |
| 11) S. Ito, N. Muguruma, Y. Kusaka, M. Tadatsu, K. Inayama, Y. Musashi, M. Yano, T. Bando, H. Honda, I. Shimizu, K. Ii, K. Takesako, H. Takeuchi and S. Shibamura, “Detection of Human Ganstric Cancer of Resected Specimens Using a Novel Infrared Fluorescent Anti-Human Carcinoembryonic Antigen Antibody with an Infrared Fluorescence Endoscope in Vitro”, Endoscopy, 2001, 33(10), 849. |
| 12) N. Muguruma, S. Ito, T. Bando, S. Taoka, Y. Kusaka, S. Hayashi, S. Ichikawa, Y. Matsunaga, Y. Tada, S. Okamura, K. Ii, K. Imaizumi, K. Nakamura, K. Takesako and S. Shibamura, “Labeled Carcinoembryonic Antigen Antibodies Excitable by Infrared Rays: a Novel Diagnostic Method for Micro Cancers in the Digestive Tract”, Internal Medicine, 1999, 38(7), 537. |
| 13) T. Bando, N. Muguruma, S. Ito, Y. Musashi, K. Inayama, Y. Kusaka, M. Tadatsu, K. Ii, T. Irimura, S. Shibamura and K. Takesako, “Basic Study on a Labeled anti-mucin Antibody Detectable by Infrared-fluorescence Endoscopy”, J. Gastroenterol., 2002, 37, 260. |
| 14) N. Muguruma, S. Ito, S. Hayashi, S. Taoka, H. Kakehashi, K. Ii, S. Shibamura and K. Takesako, “Antibodies Labeled with Fluorescence-agent Excitable by Infrared Rays”, J. Gastroenterol., 1998, 33, 467. |
| 15) 伊藤進, 六車直樹,“不可視情報の画像化-新しい内視鏡診断学の展望 (5)赤外蛍光を用いた微小癌診断”, 臨牀消化器内科, 1999, 14(8), 1205. |
| 16) W. Aung, A. Tsuji, H. Sudo, A. Sugyo, T. Furukawa, Y. Ukai, Y. Kurosawa and T. Saga, “Immunotargeting of Integrin α6β4 for Single-Photon Emission Computed Tomography and Near-Infrared Fluorescence Imaging in a Pancreatic Cancer Model”, Molecular Imaging, 2016, 15, 1. |
